
методичка фкх
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ
МЕТОДИЧНІ ВКАЗІВКИ до виконання лабораторних робіт
для студентів напряму 6.051701 "Харчові технології та інженерія" денної та заочної форм навчання
Всі цитати, цифровий та фактичний матеріал, бібліографічні відомості перевірені. Написання одиниць відповідає стандартам Підписи авторів_______________
________________________2011 р.
СХВАЛЕНО на засіданні кафедри
фізичної і колоїдної хімії Протокол № 15
від 07.06.2011 р.
Київ НУХТ 2011
Фізична та колоїдна хімія: Метод. вказівки до викон. лаборатор. робіт для студ. напряму 6.051701 «Харчові технології та інженерія» ден. та заоч. форм навч. / Уклад.: О.В. Грабовська, О.М. Мірошников, О.В. Подобій, Л.С. Воловик, Є.І. Ковалевська– К.: НУХТ, 2011. – 105 с.
Рецензент О.М. Полумбрик, д-р. хім. наук
Укладачі: О.В.Грабовська, д-р тех. наук О.М. Мірошников, канд. хім. наук О.В. Подобій, канд. тех. наук Л.С. Воловик, канд. хім. наук Є.І. Ковалевська, канд. хім. наук
Відповідальна за випуск О.В.Грабовська, д-р тех. наук, проф.
2
ВСТУП Предметом дисципліни є вивчення законів протікання хімічних процесів
у часі, законів хімічної рівноваги, будови атомів, молекул та речовин на молекулярному та вивчення дисперсного стану речовини, поверхневих явищ в дисперсних системах, ролі цих явищ у визначенні фізико-хімічних властивостей колоїдних розчинів. Фізична та колоїдна хімія є базою для всіх технологічних дисциплін.
Мета дисципліни – навчити студентів розуміти основи фізико-хімічних процесів, що відбуваються при одержанні харчових продуктів оздоровчого та профілактичного призначення та в технології харчування, а також використовувати класичні та нові фізико-хімічні методи дослідження структури та властивостей речовин, основні положення хімії поверхневих явищ для характеристики технологічних процесів у харчовій промисловості.
Згідно вимог освітньо-професійної програми вищої освіти за професійним спрямуванням “Харчові технології та інженерія” фізична та колоїдна хімія вивчається після неорганічної, аналітичної та органічної хімії і завершує хімічну освіту бакалавра. Останнім визначаються завдання, що стоять перед дисципліною в процесі підготовки фахівців. По-перше, ця наука об’єднує та поглиблює фундаментальні знання основних законів природознавства і сприяє формуванню різноманітного підходу до пояснення явищ природи. Подруге, ця дисципліна є теоретичною основою всіх технологічних виробництв в харчовій промисловості. Внаслідок вивчення фізичної та колоїдної хімії бакалавр отримує цілісне уявлення щодо процесів та явищ, які відбуваються в неживій та живій природі; розуміє можливості сучасних наукових методів пізнання природи, володіє ними для рішення конкретних завдань, що виникають при виконанні професійних функцій.
Викладання цієї дисципліни базується на знаннях, що набули бакалаври з курсів вищої математики, фізики та всього циклу хімічних дисциплін, які вивчаються з використанням сучасних досягнень науки, мають практичну направленість і підтверджуються прикладами із різноманітних технологічних процесів харчової промисловості.
З метою кращого засвоєння теоретичних основ дисципліни слід використовувати різні наочні посібники, технічні засоби навчання, комп’ютерну техніку.
Лабораторні роботи повинні виконуватися при вивченні відповідної теми, що сприяє кращому засвоєнню теоретичного матеріалу і надає можливість студентам познайомитися з необхідними приладами, методикою проведення лабораторних досліджень та самостійно аналізувати системи і виконувати необхідні розрахунки.
Для самостійної підготовки студентів передбачені теоретичні відомості на початку кожної лабораторної роботи та питання для самоперевірки знань та вмінь студентів.
3
Лабораторнаробота№1
ВИЗНАЧЕННЯ ІНТЕГРАЛЬНОЇ ТЕПЛОТИ РОЗЧИНЕННЯ СОЛІ
Мета роботи – навчитися експериментально визначити теплові ефекти хімічних та фізико-хімічних процесів.
Теоретичні відомості
Термохімія як розділ термодинаміки вивчає теплові ефекти хімічних реакцій, фазових перетворень, процесів розчинення, адсорбції, змочування, набухання та ін.
Теоретична основа термохімії – перший закон термодинаміки. Для будьякого елементарного термодинамічного процесу перший закон термодинаміки записується у вигляді:
dU Q A. |
(1.1) |
Це закон збереження і перетворення енергії, який стверджує, що теплота Q, яка надана системі, витрачається на збільшення її внутрішньої енергії U і на виконання системою роботи проти зовнішніх сил А.
Рівняння (1.1) – математичний вираз першого начала термодинаміки. Величина dU – повний диференціал величини енергії. Внутрішня енергія характеризує загальний запас енергії системи, тобто енергію поступального і обертального руху молекул, енергію коливань атомів, що входять до складу молекули, енергію обертання електронів навколо ядер і ядерну енергію. Коли система під дією різних факторів переходить із одного стану в інший, зміна її внутрішньої енергії U не залежить від шляху, яким система перейшла від початкового до кінцевого стану.
Функції, заміна яких не залежить від способу проведення процесу, називаються функціями стану. Внутрішня енергія є функцією стану термодинамічної системи.
Теплота та робота – різні форми передачі енергії, що належать до визначеного процесу, і в загальному вигляді не можуть бути функціями стану, тому в рівнянні (1.1) вони виражені не повним диференціалом, а нескінченно малою кількістю теплоти та роботи.
Якщо процес виконується при постійному об'ємі V=const (ізохорний процес), робота проти зовнішніх сил (робота розширення) відсутня і рівняння
(1) можна записати у вигляді |
|
|
dU Qv , |
Qv U. |
(1.2) |
Оскільки U – функція стану, Qv також є функцією стану.
Якщо процес йде при постійному тиску Ρ=const (ізобарний процес), згідно з (1.3) в системі можливе виконання роботи розширення:
Qp dU PdV. |
(1.3) |
Після інтегрування рівняння (1.3) отримуємо: |
(1.4) |
Qp U P(V2 V1 ) (U P V ) H. |
Величина U+P·V=H називається ентальпією, яка є функцією стану, отже Qр також є функцією стану
Qp H |
(1.5) |
4
Із (1.5) видно, що кількість теплоти, наданої системі при постійному тиску, дорівнює зміні ентальпії даної системи. Як випливає із (1.2) і (1.5), теплота процесу при V=const і Ρ=const залежить тільки від різниці енергії кінцевої і початкового стану системи.
Закон Гесса, що також називається законом постійності сум теплоти реакції, є основним законом термохімії і формулюється так: якщо з даних вихідних речовин можна одержати задані кінцеві продукти різними шляхами, сумарна теплота процесу для всіх шляхів буде одна. Цей закон є цілком правильним лише для двох процесів, що проходять при постійному об'ємі
(Qv= U) і постійному тиску (Qp = Н), при постійній температурі.
Тепловим ефектом реакції називається кількість теплоти, що виділяється чи поглинається при хімічній реакції при сталому об’єму та тиску, а також при однаковій температурі початкових і кінцевих речовин.
Цей закон дозволяє розрахувати теплові ефекти процесів через теплоти утворення, згоряння, розчинення.
Для характеристики теплових ефектів використовують ентальпію ( Н). Ентальпія – це теплота утворення 1 моль сполуки з відповідних простих речовин за стандартних умов (температурі 25 °С (або 298,15 К) і тиску 1 атм –
H298o ).
Розчинення речовини супроводжується виділенням або поглинанням теплоти, що характеризується інтегральним або диференційним тепловим ефектом.
Інтегральною теплотою розчинення ( Нm) називають теплоту розчинення
1 моль речовини з утворенням розчину заданої моляльності (моляльна концентрація характеризується числом молів речовини, розчиненої в 1000 г розчинника).
Диференційна теплота розчинення – це теплота розчинення 1 моль речовини в нескінченно великій кількості розчину постійної концентрації.
Тепловий ефект при розчиненні кристалічної солі ( Нm) визначається двома стадіями. Перша стадія характеризується ендотермічним процесом (E) руйнування кристалічних ґраток солі і віддалення іонів на значну відстань від поверхні кристалу солі. Друга стадія характеризується екзотермічним процесом
( Нh) гідратації (сольватації) іонів. Отже |
|
Нm=Е+ Нh |
(1.6) |
Завдання на виконання роботи
1.Визначити водяний еквівалент калориметра за азотнокислим калієм.
2.Визначити інтегральну теплоту розчинення невідомої солі.
Прилади, лабораторний посуд та реактиви
5
Калориметрична установка, терези, дистильована вода, сіль, термометр.
Калориметр (рис. 1.1) складається із кожуха та склянки, яку розміщують в кожух. Для зменшення випаровування калориметр закривають кришкою, в яку вставляють мішалку, термометр і пробірку з сіллю.
Рис. 1.1. Калориметр
Порядок виконання лабораторної роботи №1.1
ВИЗНАЧЕННЯ ВОДЯНОГО ЕКВІВАЛЕНТУ КАЛОРИМЕТРА
1.В скляну заливають 200 г води.
2.Розраховують кількість KNO3, що припадає на 200 г води, виходячи з розрахунку одержання 0,2—0,3 Μ розчину.
3.Для визначення наважки зважують порожню пробірку, а потім – з сіллю з точністю до 0,01 г.
4.Збирають калориметричну установку як показано на рис.1.1.
5.При безперервному перемішуванні розчину фіксують зміну температури
зточністю до 0,1 °С через кожні 30 с. Для визначення точної зміни температури під час досліду процес розчинення умовно поділяють на три періоди :
1)Попередній, який триває до 5 хв.
2)Головний – процес розчинення солі.
3)Заключний – до 5 хвилин.
Упопередньому періоді визначають інтенсивність теплообміну калориметра з навколишнім середовищем. Для цього при безперервному перемішуванні води вимірюють її температуру через кожні 30 с. Після встановлення рівномірного ходу температури, тобто зміна температури через кожні 30 с буде майже однакова (через 5 хв), вносять сіль.
В головному періоді не припиняють перемішування розчину до повного розчинення солі, фіксуючи зміну температури кожні 30 с. Якщо з яких-небудь причин відлік не зробили, при запису ставиться позначка. Це слід робити для того, щоб не спотворити хід головного періоду.
Заключний період прийнято вважати з моменту досягнення рівноваги розчинення солі, тобто з моменту припинення зниження температури (не менше 5 хвилин).
6
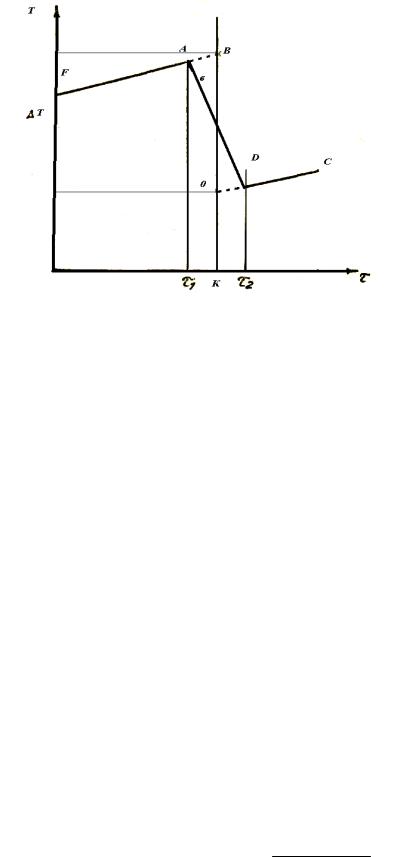
6.Зміну температури розчинення солі визначають графічно. Для цього на міліметровому папері, будують графік, де на осі абсцис відкладають час, а на осі ординат – температуру.
Рис. 1.2. Графічне визначення температурного перепаду в калориметрі.
На рис. 1.2 показано одну з можливих діаграм, де FА – попередній період, AD – головний і DС – заключний. Для визначення Τ продовжують лінію попереднього періоду вправо (ділянка АВ), а лінію заключного періоду вліво ((ділянка ОD) пунктирні лінії). Через середину головного періоду (т. К) проводять пряму, паралельну осі ординат, до перетину з пунктирними лініями.
Відстань ОВ дорівнює зміні температури Τ при розчиненні солі з урахуванням теплообміну між калориметром і навколишнім середовищем.
7. Після розчинення солі за зміною температури розчину в калориметрі визначають кількість теплоти, наданої системі (калориметричний тепловий ефект), який дорівнює :
Q ci mi T (C p H mp H W ) T , |
(1.7) |
де Сp-н– питома теплоємність розчину; mр-н – маса розчину, W– стала
калориметра, або водяний еквівалент; Τ – зміна температури розчину в процесі розчинення.
8. Водяний еквівалент калориметра (W)являє собою теплоємність калориметричної системи, тобто кількість теплоти, необхідної для нагрівання або охолодження всіх частин калориметра на один градус:
n |
|
W ci mi , |
(1.8) |
i 1
де Σm — маса частин калориметра, що беруть участь в теплообміні; cj— питома теплоємність кожної частини калориметра. Отже, водяний еквівалент можна визначити з (1.8) як суму добутків теплоємності всіх частин калориметра на їх мacy крім теплоємності розчину.
Водяний еквівалент можна визначити за рівнянням (1.7), якщо ввести в
калориметр відому кількість теплоти. Калориметричний тепловий ефект для солі KNO3 (QKNO3) обчислюють за відомою інтегральною теплотою розчиненняH= –35,6 кДж. Калориметричний тепловий ефект для солі KNO3 буде:
QKNO3 |
|
mKNO |
H KNO |
(1.8) |
|
3 |
3 |
||||
|
|
|
M KNO3
7

Із рівняння (1.7) та (1.8) визначають водяний еквівалент калориметра, знаючи ΤКNO3 :
W |
QRNO |
cp mKNO |
t |
(1.9) |
3 |
3 |
|
||
|
|
|
t
де cp – питома теплоємність розчину, яка визначається питомою теплоємністю води (при 298 К – 4,18 Дж/г К).
Порядок виконання лабораторної роботи №1.2
ВИЗНАЧЕННЯ ІНТЕГРАЛЬНОЇ ТЕПЛОТИ РОЗЧИНЕННЯ НЕВІДОМОЇ СОЛІ
1.Калориметр звільняють від розчину KNO3, корки висушують, пробірки витирають тампоном з фільтрувального паперу.
2.В пробірку вносять невідому сіль і зважують її.
3.Збирають калориметричну установку і, відповідно до п.п. 5,6,7 лабораторної роботи №1.1 проводять процес розчинення невідомої солі, будують графік
залежності Τ=f( ), визначають стрибок температури Τ та обчислюють калориметричний тепловий ефект.
Аналіз результатів
1. Обчислюють питому теплоту розчинення невідомої солі (теплота розчинення
1 г), Дж/г:
q |
Q |
(1.10) |
|
mc |
|||
|
|
Перевіряють одержаний результат у викладача.
2. Знаючи назву солі і, відповідно, її молярну масу, визначають інтегральну
теплоту розчинення, Нm , кДж/моль |
H m q M |
(1.11) |
|
||
3. Знайдену інтегральну теплоту |
розчинення порівнюють з табличним |
|
значенням і обчислюють відносну похибку експерименту. |
|
|
Питання для самоперевірки
1.Дайте визначення першого закону термодинаміки та наведіть його аналітичний вираз.
2.Дайте визначення внутрішньої енергії системи. Яка функція називається функцією стану?
3.Сформулюйте закон Гесса.
4.Що називається тепловим ефектом хімічної реакції?
5.В яких випадках застосовують закон Гесса для розрахунку теплових ефектів?
6.Які теплові ефекти виникають під час розчинення солі?
7.Що називається теплотою розчинення речовини?
8.Що таке інтегральна і диференційна теплоти розчинення?
9.В чому полягає калориметричний спосіб вимірювання теплоти розчинення?
8
10.Що таке водяний еквівалент калориметра і як його визначають?
11.Чому для визначення Т необхідно накреслити графік зміни температури з часом?
Лабораторна робота № 2 ПОБУДОВА ТА АНАЛІЗ ДІАГРАМ СТАНУ ОБМЕЖЕНО
РОЗЧИННИХ РІДИН
Мета роботи: побудувати за експериментальними даними діаграму взаємної розчинності двохкомпонентних систем з обмеженою розчинністю в рідкому стані і визначити критичну температуру змішування.
Теоретичні відомості
Задача фізико-хімічного аналізу – вивчення залежності будь-якої фізичної властивості речовини від її складу, тобто побудова і вивчання діаграми стану. Користуючись діаграмою стану, можна визначити склад суміші, вимірюючи яку-небудь фізико-хімічну властивість системи (без проведення хімічного аналізу). Діаграми стану також дають можливість виявити наявність хімічних сполук в системі, склад цих сполук, температуру перетворень тощо. Якщо в системі досліджується залежність температури плавлення від складу, одержують діаграму плавкості. Якщо криві будують в координатах електрична провідність – склад, в'язкість – склад або температура змішування двох рідин – склад, отримують відповідно діаграму електричної провідності, в'язкості або розчинення.
Теоретична основа фізико-хімічного аналізу – правило фаз Гіббса.
Фазові перетворення – це процес перетворення одної фази речовини в іншу фазу тієї ж речовини, тобто процеси, що відбуваються без хімічних реакцій.
Правило фаз Гіббса: число ступенів вільності дорівнює кількості компонентів системи мінус число фаз і плюс 2.
С=К–Ф+2 (2.1)
де С – число ступенів вільності (число змінних термодинамічних параметрів в системі), які можна довільно змінювати без зміни числа і виду фаз; К – компоненти системи – незалежні складові, за допомогою яких можна виразити склад любої фази; Ф – фаза (число однорідних частин системи, які мають визначений хімічний склад і термодинамічні властивості, відокремлених від інших фаз поверхнею розділу); 2 – число зовнішніх факторів, які обумовлюють існування системи, наприклад, тиск і температура. Якщо один із цих факторів постійний, замість "2" в рівнянні пишуть "1".
Система з одним ступенем вільності називається моноваріантною. Якщо число ступенів вільності дорівнює нулю, система називається нонваріантною. Таким чином, число ступеня вільності за правилом фаз Гіббса можна виразити як різницю між числом компонентів і числом фаз плюс 2. Число 2 показує, що всі фази системи перебувають в рівновазі за двох заданих параметрів: температури і тиску. В цьому випадку повну об'ємну діаграму стану будують в координатах температура – тиск – склад.
9
Якщо процес відбувається за постійного тиску, будують плоску діаграму стану в координатах температура – склад (Т–N) і правило фаз Гіббса запишеться так: С=К–Ф+1.
Температура, за якої фази перебувають в рівновазі, є основною характеристикою фазового перетворення.
Обмежена взаємна розчинність двох рідин спостерігається у системах зі значним відхиленням від ідеальності. Така розчинність залежить від температури, але її вплив на різні системи неоднаковий. В одних системах взаємна розчинність рідин збільшується з підвищенням температури і при цьому склади двох рівноважних фаз зближуються. За деякої температури, яку називають критичною температурою розчинення
(КТР), склади двох рівноважних фаз стають однаковими і досягається повна гомогенність системи. При обмеженій розчинності двох рідин утворюється двошарова система: верхній і нижній шари мають різний склад і становлять насичений розчин за даної температури однієї рідини в іншій. Між ними існує чітка межа поділу.
Зміна взаємної розчинності двох рідин великою мірою залежить від зміни температури. З ростом температури збільшується кількість молекул
зпідвищеним запасом енергії руху, які здатні здійснити роботу переходу через межу поділу. Отже, збільшується і взаємна розчинність рідин. Таким чином, склад спряжених розчинів буде дедалі зближуватися і за якоїсь температури зрівняється. Ця температура, починаючи з якої і вище рідини необмежено змішуються одна в одній, називається верхньою критичною температурою розчинення.
Системи, що складаються із двох обмежено розчинних рідин, взаємна розчинність яких зростає із підвищенням температури, називаються системами
зверхньою КТР. До них належать система вода–анілін, вода–фенол, вода– нітробензол. Залежність взаємної розчинності рідин від температури при постійному тиску показують на діаграмах стану в координатах температура– склад.
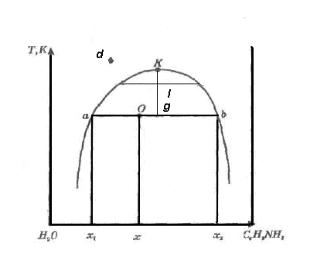
Рис. 2.1 Діаграма взаємної розчинності води й аніліну при Р=сonst.
На рис. 2.1 наведена діаграма стану для системи вода–анілін. На цій діаграмі крива аКв називається
кривою розшарування і розділяє діаграму на дві частини: гомогенну, яка знаходиться вище кривої розшарування, і гетерогенну, яка знаходиться нижче кривої розшарування.
Фігуративні точки в гомогенній області, наприклад точка d, відображають стан однофазної двохваріантної системи (С=2–1+1=2).
10
