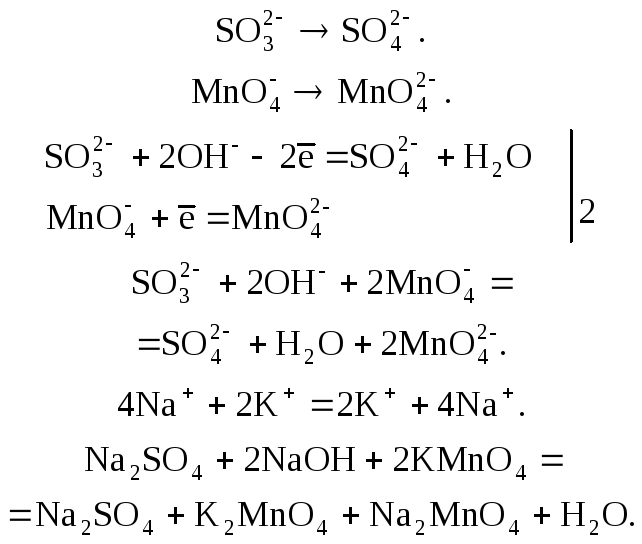- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
2. Расстановка коэффициентов методом полуреакций
В отличие от метода электронного баланса, в этом методе рассматриваются только ОВР, которые протекают в водных растворах.
Нахождение коэффициентов основано на сложении электронно-ионных уравнении для процессов окисления восстановителя (одна полуреакция) и процессов восстановления окислителя (вторая полуреакция) с последующим суммированием уравнений в общее уравнение. В полуреакциях учитывается характер среды, в котором происходит та или иная реакция. Определим последовательность действий при нахождении коэффициентов:
1. Составляем схему процесса.
Для этого после написания схемы реакции в молекулярном виде записываем в ионном виде восстановитель, окислитель и продукты их взаимодействия. Сильные электролиты записываем в ионном виде, а слабые электролиты, осадки и газы – в виде молекул.
2. Записываем электронно-ионные уравнения.
Чтобы уравнять число атомов кислорода и водорода, которое может входить в состав окисляемых и восстанавливаемых ионов и молекул, необходимо включать в электронно-ионные уравнения молекулы воды и ионы водорода, если реакция протекает в кислой среде, и гидроксид-ионы, если реакция протекает в щелочной среде. При этом возможны два варианта.
I вариант
В исходных ионах (молекулах) атомов кислорода О-2 больше, чем в получаемых ионах (молекулах). В данном варианте «лишние» атомы кислорода связываются в кислой среде с протонами с образованием молекул воды, а в нейтральной среде с молекулами воды с образованием гидроксид-ионов:
О-2+2Н+ = Н20 (кислая среда)
О![]() НОН=2ОН–
(нейтральная или щелочная среда).
НОН=2ОН–
(нейтральная или щелочная среда).
II вариант
Если в исходных ионах (молекулах) атомов кислорода меньше, чем в получаемых ионах (молекулах), тогда «недостающие» атомы кислорода берутся в нейтральной и кислой средах из молекул воды, а в щелочной среде из гидроксид-ионов:
Н2О = О-2 + 2Н+ (нейтральная и кислая среда);
2ОН– = О–2 + Н2О (щелочная среда).
3. Составляем суммарное ионное уравнение реакции.
Для этого уравнения каждую полуреакцию умножаем на такой множитель, чтобы число электронов в процессе окисления было равно числу электронов в процессе восстановления. Затем складываем уравнения обеих полуреакций.
4. Составляем суммарное молекулярное уравнение реакции.
Для этого в левой части ионного уравнения подбираем к каждому аниону катион, а к каждому катиону – соответствующий анион. Затем такие же ионы и в той же последовательности записываем в правой части уравнения.
Рассмотрим как методом полуреакций находят коэффициенты при протекании ОВР в кислой, нейтральной и щелочной средах. Сначала – случай, когда количество атомов кислорода в исходных веществах больше, чем в продуктах реакции (пример 5), а потом – когда это количество меньше, примеры 6 и 7.
Пример 5. Расставьте коэффициенты в схеме ОВР между Na2SО3 и КМnО4 в кислой среде:
Na2SО3 + КМnО4 + H2SО4 = Na2SО4 + МnSО4 + K2SО4 + H2О.
Здесь степень окисления изменяется у серы и марганца.
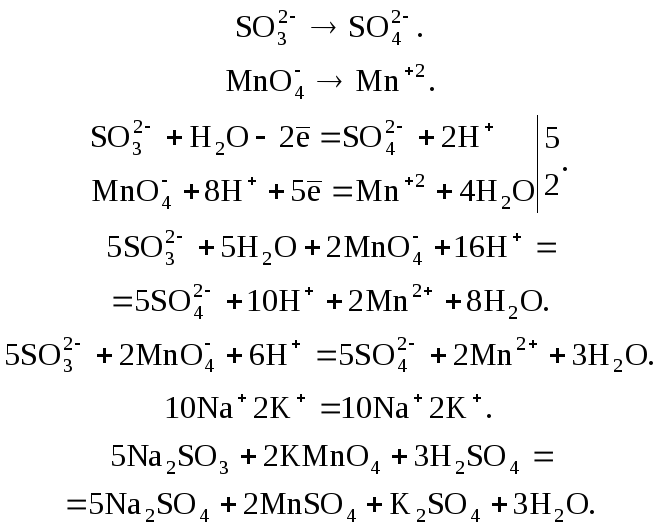
Пример 6. Расставьте коэффициенты в схеме ОВР между Na2SО3 и КМnО4 в нейтральной среде:
Na2SО3 + КМnО4 + H2О = Na2SО4 + МnО2 + KОН.
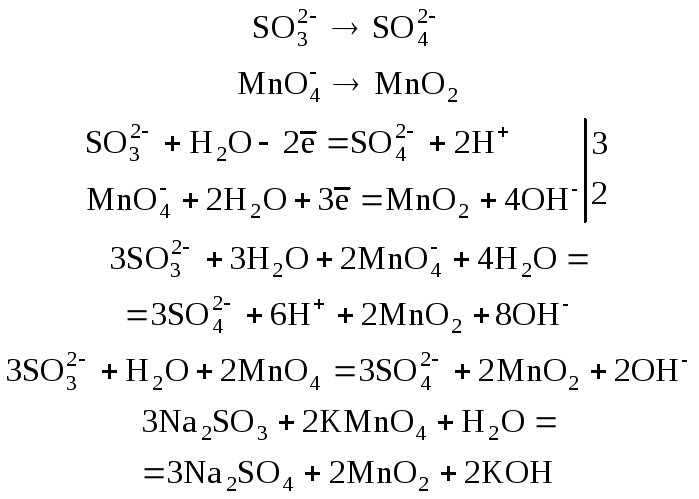
Пример 7. Расставьте коэффициенты в схеме ОВР между сульфитом натрия и перманганатом калия в сильно щелочной среде:
Na2SО3
+
КМnО4
+ NaOH![]() Na2SО4
+ K2МnО4
+ Na2МnО4
+H2O.
Na2SО4
+ K2МnО4
+ Na2МnО4
+H2O.