
- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
Содержание отчета
Название и цель работы.
Используемые реактивы, посуда и оборудование.
Записать в отчет краткие теоретические сведения.
При оформлении первого опыта приведите уравнения химических реакций. Результаты опытов запишите в таблицу 1, рассчитайте скорость реакции для каждого опыта и заполните таблицу 1. Постройте график зависимости скорости реакции от концентрации сульфита натрия.
При оформлении второго опыта приведите уравнение химической реакции. Результаты опытов запишите в таблицу 2 и заполните ее. Постройте график зависимости скорости реакции от температуры, вычислите температурный коэффициент скорости реакции.
Для третьего опыта приведите уравнение химической реакции и математическое выражение основного закона химической кинетики. Запишите наблюдения, сделайте вывод о влиянии площади поверхности реагирующих веществ на скорость реакции, протекающей в гетерогенной среде.
Запишите наблюдения о влиянии компонентов реакции на смещение равновесия, объясните изменение окраски в каждой из пробирок, используя выражение константы химического равновесия для этой реакции. Сделайте выводы о влиянии температуры на смещение химического равновесия.
Контрольные вопросы
Сформулируйте закон действующих масс. Напишите уравнение этого закона для следующих реакций:
а)
![]() ;
;
б)
![]() .
.
Каков физический смысл константы скорости химической реакции? От каких факторов она зависит?
Как изменится скорость химической реакции
 :
:
а) если увеличить
концентрацию
![]() в 2 раза?
в 2 раза?
б) если уменьшить объем системы в 2 раза?
в) если увеличить давление в 2 раза?
Какие реакции называются обратимыми? Каков физический смысл константы равновесия? Как повлияет на смещение равновесия реакции
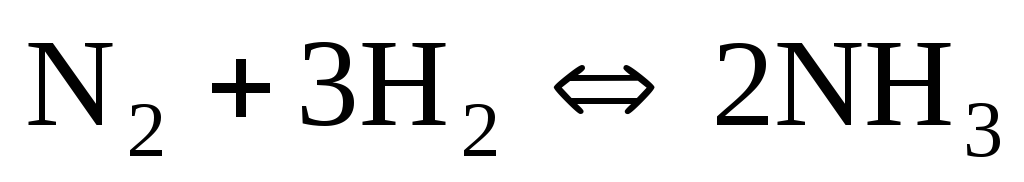
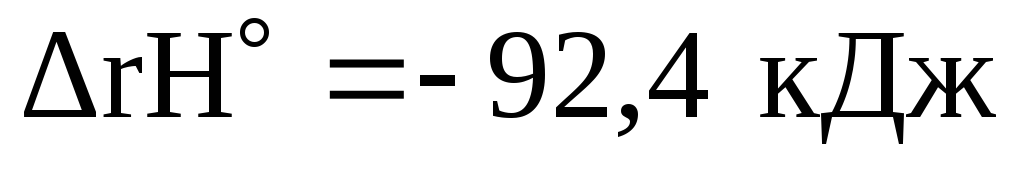 :
:
а) повышение температуры?
б) уменьшение давления?
Лабораторная работа № 2 растворы
Цель работы: приобрести навыки приготовления растворов заданных количественных составов.
Приборы: электронные весы, набор ареометров.
Реактивы:
бихромат калия (![]() );
сульфат натрия кристаллогидрат (
);
сульфат натрия кристаллогидрат (![]() );
раствор серной кислоты (
);
раствор серной кислоты (![]() );
дистиллированная вода.
);
дистиллированная вода.
Посуда: химические стаканы на 100 см3, цилиндры, стеклянные воронки и палочки, мерные колбы на 100 см3, часовые стекла.
Краткие теоретические сведения
Раствором называется однофазная (гомогенная) система переменного состава, состоящая из двух или большего числа компонентов. Растворы бывают жидкими, твердыми, газообразными.
Компонентами, составляющими раствор, являются растворитель и растворенное вещество. Растворителем условно принято считать тот компонент, который не меняет своего агрегатного состояния в процессе образования раствора. При одинаковом агрегатном состоянии обоих компонентов растворителем считают то вещество, которое в нем преобладает.
Растворы обладают признаками как химических соединений, так и механических смесей.
Общее для растворов и механических смесей
Растворы и механические смеси могут иметь переменный состав (у химических соединений состав обычно постоянен).
В растворах и смесях компоненты, их образующие, не утрачивают своих индивидуальных свойств.
