
- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
Химическое равновесие
Все химические реакции можно классифицировать как обратимые и необратимые.
Состояние системы, при котором скорости прямой и обратной реакции равны, называется химическим равновесием.
Кинетическое химическое равновесие является динамическим: одновременно протекают прямая и обратная реакции.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ реакции.
Для любой обратимой реакции в состоянии равновесия выполняется соотношение:
![]() ;
;
![]() ,
,
где
![]() – константа равновесия, которая зависит
от природы реагирующих веществ и
температуры и не зависит от их концентрации
и наличия катализаторов.
– константа равновесия, которая зависит
от природы реагирующих веществ и
температуры и не зависит от их концентрации
и наличия катализаторов.
Константа равновесия химической реакции показывает глубину превращения исходных веществ в продукты реакции. Для обратимых реакций по величине константы равновесия можно определить величину выхода продуктов реакции.
Химическое равновесие зависит от параметров состояния системы и существует при строго определенных значениях концентрации, температуры и давления. При изменении хотя бы одного из параметров равновесие смещается в левую или правую сторону.
Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Увеличение концентрации исходных веществ приводит к смещению равновесия в сторону образования продуктов реакции.
При повышении давления (для газов и паров) равновесие смещается в сторону той реакции, при которой наблюдается уменьшение объема системы (в сторону образования меньшего числа молекул); если реакция протекает без изменения объема, то изменение давления не приводит к смещению химического равновесия.
При повышении
температуры равновесие смещается в
сторону протекания эндотермической
реакции (![]() ),
а при понижении температуры – в сторону
экзотермической реакции (
),
а при понижении температуры – в сторону
экзотермической реакции (![]() ).
Следовательно, направление смещения
равновесия зависит от знака ΔН.
).
Следовательно, направление смещения
равновесия зависит от знака ΔН.
Экспериментальная часть
Опыт 1. Исследование зависимости скорости реакции от концентрации реагирующих веществ.
Зависимость
скорости реакции от концентрации
реагирующих веществ рассмотрим на
примере взаимодействия растворов йодата
калия (![]() )
и сульфита натрия
)
и сульфита натрия![]() в присутствии серной кислоты и крахмала.
в присутствии серной кислоты и крахмала.
При взаимодействии
раствора йодата калия, содержащего
крахмал, сначала образуется йодноватая
![]() и сернистая
и сернистая![]() кислоты, которые реагируют между собой:
кислоты, которые реагируют между собой:
![]() .
.
Эта реакция протекает медленно. Когда вся сернистая кислота израсходуется, йодноватая кислота реагирует с йодоводородной кислотой:
![]() ,
,
а выделяющийся йод в присутствии крахмала окрашивает раствор в синий цвет. Это вторая стадия реакции. Суммарное уравнение реакции имеет вид:
![]() ,
,
или в ионной форме:
![]() .
.
Время протекания реакции с момента сливания растворов до появления синего окрашивания отсчитывайте по секундомеру.
Для проведения опыта используйте следующие реактивы:
раствор А – раствор йодата калия (
 )
концентрации 0,01 моль/дм3,
содержащий серную кислоту концентрации
1,0 моль/дм3;
)
концентрации 0,01 моль/дм3,
содержащий серную кислоту концентрации
1,0 моль/дм3;раствор Б – раствор сульфита натрия
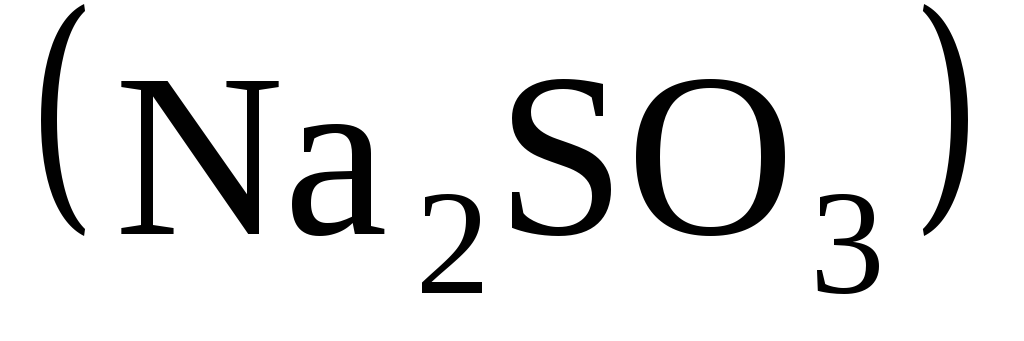 концентрации 0,01 моль/дм3,
содержащий крахмал.
концентрации 0,01 моль/дм3,
содержащий крахмал.
Приготовьте 7 чистых и сухих пробирок, 5 микростаканов и две капельные пипетки.
Концентрация
раствора А остается постоянной, а из
раствора Б приготовьте 5 различных
концентраций. Для этого в 5 пронумерованных
микростаканов налейте из банки по 10 см3
раствора Б. Затем прилейте в микростаканы
необходимое количество дистиллированной
воды. В первый стакан воду не приливайте
(концентрация раствора Б остается той
же), во второй микростакан прилейте
![]() воды, в третий – 10 см3
воды и т.д. в соответствии с данными
таблицы 1.
воды, в третий – 10 см3
воды и т.д. в соответствии с данными
таблицы 1.
Таблица 1 – Зависимость скорости реакции от концентрации реагирующих веществ
|
Номер опыта |
Исходный
раствор Б,
|
Дистиллированная
вода,
|
Концентрация
сульфита натрия,
|
Время
|
Относительная
скорость реакции
|
|
1 |
10 |
– |
0,02 |
|
|
|
2 |
10 |
5 |
0,0133 |
|
|
|
3 |
10 |
10 |
0,01 |
|
|
|
4 |
10 |
15 |
0,008 |
|
|
|
5 |
10 |
20 |
0,0066 |
|
|
В одну из пробирок
внесите с помощью капельной пипетки 20
капель раствора
![]() ,
а в другую – из первого микростакана
внесите 20 капель раствора Б (первый
вариант концентраций) и быстро слейте
жидкость из первой пробирки во вторую,
одновременно включив секундомер.
Отметьте и запишите время полного
изменения раствором окраски (синий
цвет). Такие же опыты проделайте для
других вариантов концентраций раствора
Б.
,
а в другую – из первого микростакана
внесите 20 капель раствора Б (первый
вариант концентраций) и быстро слейте
жидкость из первой пробирки во вторую,
одновременно включив секундомер.
Отметьте и запишите время полного
изменения раствором окраски (синий
цвет). Такие же опыты проделайте для
других вариантов концентраций раствора
Б.
Результат опытов
запишите в таблицу 1. Для каждого варианта
вычислите относительную скорость
реакции
![]() ,
обратно пропорциональную времени
протекания реакции.
,
обратно пропорциональную времени
протекания реакции.
По полученным
данным постройте график зависимости
скорости реакции от концентрации. По
оси абсцисс отложите значения концентраций
раствора сульфита натрия, а по оси
ординат – относительную скорость
![]() .
.
В результате получается параболическая кривая, показывающая степенную зависимость скорости реакции от концентрации. Эта кривая является наглядным подтверждением основного закона химической кинетики.
Опыт 2. Исследование зависимости скорости реакции от температуры.
Для изучения влияния температуры на скорость химической реакции используется реакция окисления щавелевой кислоты перманганатом калия в присутствии серной кислоты:
![]() ,
,
или в ионной форме:
![]() .
.
В кислой среде ион
![]() восстанавливается в ион
восстанавливается в ион![]() ,
в результате чего изменяется цвет
раствора: из красно-фиолетового (цвет
иона
,
в результате чего изменяется цвет
раствора: из красно-фиолетового (цвет
иона![]() )
он становится бледно-розовым (цвет иона
)
он становится бледно-розовым (цвет иона![]() при большой концентрации) или бесцветным
(при малой концентрации).
при большой концентрации) или бесцветным
(при малой концентрации).
Опыт проводите в четырех вариантах при разных температурах, как указано в таблице 2.
Раствор А – раствор
![]() концентрации 0,1 моль/дм3;
раствор Б – раствор
концентрации 0,1 моль/дм3;
раствор Б – раствор
![]() и серной кислоты.
и серной кислоты.
Налейте по 10 капель растворов А и Б в две конические пробирки. Слейте эти растворы в одну пробирку и отсчитывайте время с момента смешения до обесцвечивания раствора, запишите в таблицу 2.
Таблица 2
|
Номер опыта |
Объем раствора А, см3 |
Объем раствора Б, см3 |
Температура опыта, К |
Время
|
Относительная скорость реакции
|
|
1 |
0,5 |
0,5 |
Т* |
|
|
|
2 |
0,5 |
0,5 |
Т+10 |
|
|
|
3 |
0,5 |
0,5 |
Т+20 |
|
|
|
4 |
0,5 |
0,5 |
Т+30 |
|
|
Т* – комнатная температура.
Затем выполняйте второй вариант опыта, для этого надо взять в две конические пробирки по 10 капель раствора А и Б. Нагрейте эти растворы в течение 5-7 минут в термостате, в котором установлена температура, на 10º превышающая комнатную, или в водяной бане, температуру которой определите по термометру, вставленному в одно из отверстий в крышке.
Достаньте пробирку
с раствором
![]() .
Перелейте ее содержимое в пробирку с
раствором щавелевой кислоты. Не вынимая
пробирку из термостата, определите
время завершения реакции.
.
Перелейте ее содержимое в пробирку с
раствором щавелевой кислоты. Не вынимая
пробирку из термостата, определите
время завершения реакции.
Проведите опыты при других значениях температуры. Результаты опытов запишите в таблицу 2. По полученным данным постройте график зависимости скорости реакции от температуры. По оси абсцисс отложите значения температуры в градусах Кельвина, а по оси ординат – скорость реакции.
Опыт 3. Исследование влияния величины поверхности реагирующих веществ на скорость в гетерогенной системе.
Взвесьте на
электронных весах кусочек мрамора
массой примерно 0,1 г и мрамор в виде
порошка такой же массы. В две конические
пробирки налейте по 10 капель разбавленной
соляной кислоты. Внесите одновременно
обе навески мрамора в пробирки с кислотой:
кусочек внесите в одну пробирку, порошок
– в другую. В какой пробирке реакция
протекает быстрее? Заметьте время,
которое потребовалось для полного
растворения мрамора. Вычислите для
обоих случаев относительную скорость
![]() и определите, в каком случае скорость
больше и во сколько раз. Сделайте вывод
о значении поверхности соприкосновения
реагирующих веществ в гетерогенных
процессах. Напишите уравнение реакции
и математическое выражение основного
закона химической кинетики.
и определите, в каком случае скорость
больше и во сколько раз. Сделайте вывод
о значении поверхности соприкосновения
реагирующих веществ в гетерогенных
процессах. Напишите уравнение реакции
и математическое выражение основного
закона химической кинетики.
Опыт 4. Исследование влияния концентрации реагирующих веществ на химическое равновесие.
К 10 каплям раствора
хлорида железа (III)
концентрации 0,01 моль/дм3
прибавьте 10 капель раствора роданида
калия концентрации 0,02 моль/дм3.
В результате получается раствор с
характерной красной окраской, обусловленной
присутствием роданида железа (III)
![]() .
Реакция обратима:
.
Реакция обратима:
![]() .
.
Для ослабления окраски раствора в пробирку добавьте 5-7 см3 дистиллированной воды.
Полученный раствор красного цвета разлейте поровну в четыре конических пробирки. Первую пробирку оставьте для сравнения.
Во вторую добавьте несколько капель насыщенного раствора хлорида железа (III). В третью пробирку добавьте несколько капель насыщенного раствора роданида калия. Перемешайте растворы в пробирках. В четвертую пробирку добавьте сухую соль хлорида калия и энергично перемешайте стеклянной палочкой. Наблюдайте и запишите изменение окраски раствора в каждой пробирке.
Пользуясь выражением для константы химического равновесия:
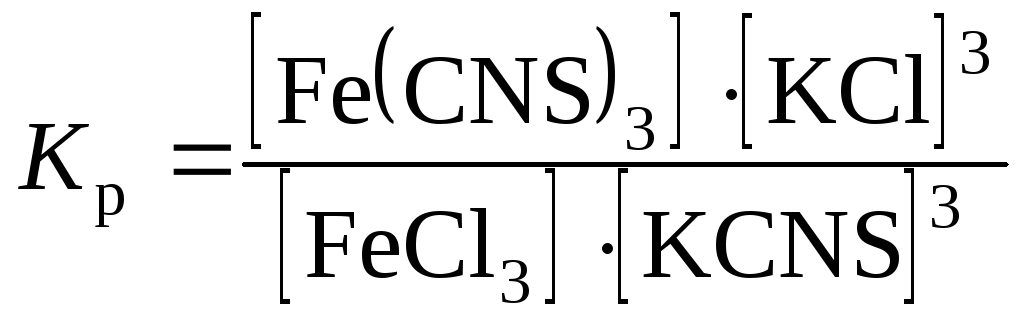 ,
,
объясните изменение окраски растворов во всех пробирках.
Опыт 5. Исследование влияния температуры на химическое равновесие.
Реакция взаимодействия крахмала с йодом является обратимой и протекает с образованием йодокрахмала (соединение синего цвета) и выделением теплоты. Схематично эту реакцию можно изобразить следующим образом:
Йод + крахмал
![]() йодокрахмал
йодокрахмал![]() .
.
В две пробирки налейте по 4-5 см3 раствора крахмала и добавьте 5-10 капель раствора йода концентрации 0,005 моль/дм3 (до появления окраски синего цвета). Нагревая и охлаждая одну из пробирок, наблюдайте за изменением окраски.
Сделайте вывод о влиянии температуры на смещение химического равновесия.
