
- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
Краткие теоретические сведения
Коррозия – это самопроизвольный процесс разрушения металлов под влиянием внешней среды.
Причиной коррозии является более низкая термодинамическая стабильность металлов, чем их соединений (оксидов, гидроксидов, солей).
Как и все самопроизвольные процессы, коррозия протекает с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозийного разрушения металлов выделяется в виде теплоты и бесполезно рассеивается в пространстве. Коррозия металлов – нежелательный процесс. Широко известны такие коррозионные явления, как ржавление железа на воздухе, образование окалины на железе при высокой температуре, разъедание металлов кислотами.
В результате коррозии металлы становятся менее прочными, изменяются размеры изделий, увеличивается работа трения между деталями машины. Безвозвратные мировые потери металлов от коррозии выражаются величиной 20 млн. тонн в год. Но еще большие материальные потери связаны с ремонтом и заменой деталей судов, автомобилей, аппаратуры. Эти затраты во много раз превышают стоимость металла, из которого они изготовлены.
Изучение механизма коррозии и разработка методов защиты металлов от нее имеет большое практическое значение.
По механизму протекания коррозионного процесса, зависящего от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания коррозийного процесса различают:
а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах;
б) жидкостную коррозию – в растворах неэлектролитов (агрессивных органических жидкостях).
Разрушение металлов при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией.
Электрохимическая коррозия в основном характерна для сред, имеющих ионную проводимость. Она может протекать: а) в электролитах – в водных растворах солей, кислот, щелочей, морской воде; б) в атмосфере любого влажного газа; в) в почве.
Радиоэлектронная аппаратура чаще всего подвержена воздействию атмосферы, содержащей влагу, следовательно, электрохимической коррозии. Роль электролита в таких условиях играет водная пленка на поверхности металла, в которой часто растворены электропроводящие примеси.
Как и в гальванических
элементах, при электрохимической
коррозии процесс взаимодействия металла
с окислителем (кислород атмосферы, ионы:
![]() )включает
анодное
растворение металла, катодное
восстановление окислителя, движение
электронов в
металле и ионов
в растворе.
)включает
анодное
растворение металла, катодное
восстановление окислителя, движение
электронов в
металле и ионов
в растворе.
При контакте металла с другим менее активным металлом в кислой среде, например железа с медью в соляной кислоте, возникает гальванический элемент:
(-)Fe|HCl|Cu(+).
Железо окисляется, отдавая электроны атомам меди, а на атомах меди восстанавливаются ионы водорода:
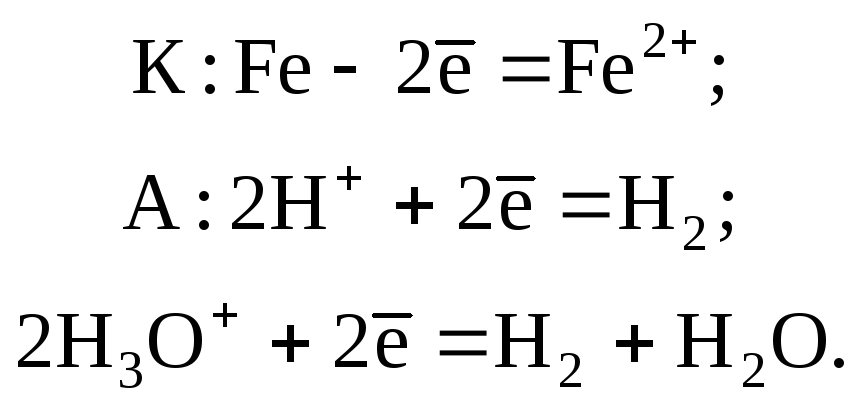
Затем ионы
![]() соединяютсяс
перешедшими
в раствор
ионами
соединяютсяс
перешедшими
в раствор
ионами
![]() :
:
![]()
Гидроксид железа (III) частично отщепляет воду и образует соединение, отвечающее по составу бурой ржавчине.
При соприкосновении металла с электролитом на его поверхности возникает множество микрогальванических элементов. Причиной их образования является наличие примесей у металлов и пленок на поверхности, неоднородность по химическому и фазовому составу сплавов. В таких микрогальванопарах анодами являются частицы металла, а катодами – загрязнения, примеси и вообще металлы, имеющие положительный потенциал.
В микрогальваническом элементе на аноде протекает процесс окисления металлов, а на катоде может наблюдаться ионизация кислорода или восстановление водорода.
Если коррозия протекает в кислой среде, то на катоде восстанавливается водород. Этот процесс называется коррозией с водородной деполяризацией. В наиболее простом случае она может быть представлена уравнениями:
![]()
Если окислителем является кислород, то коррозия протекает с поглощением кислорода или с кислородной деполяризацией и выражается уравнением:
![]()
Коррозия как самостоятельный процесс протекает, если энергия Гиббса реакции ΔG имеет отрицательные значения. А. так как «свободная» энергия реакции непосредственно связана с э.д.с. элемента зависимостью
![]() ,
,
то возможность протекания коррозии можно установить по знаку э.д.с. элемента.
Коррозия возможна, если Е>0. А так как э.д.с. определяется как разность потенциалов окислителя и восстановителя:
![]() ,
,
то это
возможно, когда
![]() .
.
На скорость и характер коррозийных процессов оказывает влияние как природа металла, так и характер коррозийной среды.
Окислители играют двойную роль в коррозийных процессах. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой стороны? – вызывать пассивирование металлов с образованием оксидных или других защитных слоев, которые тормозят процесс коррозии.
Некоторые
ионы, например
![]() ,
наоборот,
активизируют металлы, препятствуя их
пассивированию. Причиной, активизирующей
способности хлорид ионов, является их
высокая адсорбируемость на металле и
высокая растворимость хлоридов металлов.
Ионы
,
наоборот,
активизируют металлы, препятствуя их
пассивированию. Причиной, активизирующей
способности хлорид ионов, является их
высокая адсорбируемость на металле и
высокая растворимость хлоридов металлов.
Ионы
![]() разрушают
оксидные пленки на поверхности металла
и способствуют его растворению. Особенно
большое влияние оказывают ионы
разрушают
оксидные пленки на поверхности металла
и способствуют его растворению. Особенно
большое влияние оказывают ионы
![]() на
коррозию Fe,
Cr,
Al,
Ni
и др.
на
коррозию Fe,
Cr,
Al,
Ni
и др.
Выбор способов защиты от коррозии определяется характером коррозии и условиями ее протекания. Все методы защиты делятся на группы:
а) изменение природы металла (легирование);
б) защитные покрытия;
в) электрохимическая защита;
г) изменение свойств коррозийной среды.
Рассмотрим эти способы защиты.
Легирование – эффективный метод повышения коррозийной стойкости металлов. При легировании вводят компоненты, вызывающие наряду с пассивированием металла, повышение его жаростойкости и жаропрочности. Это такие добавки, как хром, никель, вольфрам и т.п.
Жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах.
Жаропрочность – свойство конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры.
Защитные покрытия бывают металлические и неметаллические.
Металлические покрытия, в свою очередь, разделяются на анодные (металл покрытия более активно, чем защищаемый металл) и катодные (металл покрытия менее активен, чем защищаемый металл).
Более эффективными являются анодные покрытия, так как при нарушении их целостности будет корродировать покрытие, а не защищаемый металл. Например, для железа анодным покрытием будут Zn, Сr и др. Примером катодного покрытия могут служить Sn, Ag, Ni.
Лакокрасочные покрытия относятся к неметаллическим покрытиям. Они должны быть стойкими к высоким температурам, кислотам, щелочам, бензину и другим агрессивным факторам. Лакокрасочные покрытия делятся на две большие группы: лаки и краски (эмали).
Краски (эмали) – смесь нерастворимых частиц пигмента (красителя), взвешенных в однородном органическом связующем. Лаки обычно состоят из смеси смолы или высыхающего масла с летучим растворителем.
К электрохимическому способу защиты металлов от коррозии относят протекторную и катодную защиту.
Протекторная защита наиболее часто используется для предохранения конструкций (подземных трубопроводов, кабелей, корпусов судов), находящихся в среде электролита (морской воде, почве). Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала, который, выполняя роль анода, разрушается.
Сущность катодной защиты заключается в том, что защищаемые изделия подключают к отрицательному полюсу внешнего источника тока. В электронной среде изделие становится катодом, что и предотвращает его разрушение, а анодом служит вспомогательный электрод.
Изменение свойств коррозийной среды. Снизить агрессивность коррозийной среды можно дезаэрацией (удалением) кислорода, изменением рН среды, введением ингибиторов. Ингибиторы – вещества, которые адсорбируясь на коррозийной поверхности, тормозят процессы, тем самым уменьшая скорость коррозии.
