
- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
Общее для растворов и химических соединений
При растворении веществ происходит химическое взаимодействие между растворителем и растворенным веществом, признаками которого являются:
тепловые эффекты;
выделение из растворов кристаллогидратов, т.е. таких соединений, в состав которых входит кристаллизационная вода (например:
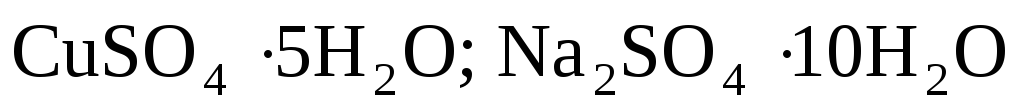 ).
).
Так как жидкие растворы находят самое широкое применение на практике, то в дальнейшем речь будет идти о растворах, в которых растворителем является вода.
Процесс растворения твердого вещества в воде сводится к следующему. От поверхности вещества, соприкасающегося с водой, отрываются частицы, которые благодаря диффузии распределяются по всему объему.
Как было доказано Д. И. Менделеевым, в водных растворах происходит процесс гидратации, т.е. образование гидратов – соединений, состоящих из частиц растворенного вещества и молекул воды. Если на разрушение кристаллической решетки растворяемого вещества расходуется энергии больше, чем ее выделяется при гидратации, то растворение – эндотермический процесс. Если же при гидратации выделяется энергии больше, чем ее расходуется на разрушение кристаллической решетки растворяемого вещества, то растворение – экзотермический процесс.
По мере накопления в растворе молекул растворенного вещества происходит обратное их соединение на поверхности еще нерастворенного вещества, т.е. кристаллизация. И в конце концов наступает равновесное состояние, при котором скорость растворения вещества становится равной скорости его кристаллизации. Раствор в таком состоянии называется насыщенным. При неизменных условиях концентрация такого раствора остается постоянной.
Концентрация насыщенного раствора – мера растворимости вещества при данных условиях.
Раствор, концентрация которого при соприкосновении с твердой фазой может увеличиваться, называется ненасыщенным.
При осторожном и медленном охлаждении или выпаривании насыщенных растворов некоторых веществ избыток растворенного вещества не выделяется. Получается пересыщенный раствор, т.е. раствор, содержащий больше вещества, чем это соответствует его растворимости при данной температуре.
Если в пересыщенный раствор внести кристаллик того вещества, которое находится в растворе, или другого, имеющего такую же кристаллическую структуру, то весь избыток растворенного вещества сразу выкристаллизовывается.
Способы выражения состава раствора
Состав раствора определяется содержанием растворенного в нем вещества и растворителя.
Концентрация – отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы. Известно несколько видов концентрации. Здесь рассмотрим два вида: молярную и массовую.
Молярная концентрация – это концентрация количества вещества, равная отношению количества вещества, содержащегося в растворе, к объему раствора:
![]() ,
,
где
![]() – количество вещества (в моль);
– количество вещества (в моль);![]() – объем раствора (дм3).
– объем раствора (дм3).
Единица измерения молярной концентрации – моль/дм3.
Так как
![]() ,
,
где
![]() – масса вещества (г);
– масса вещества (г);![]() – молярная масса вещества (г/моль),
– молярная масса вещества (г/моль),
то
![]() .
.
Например, молярная концентрация 4,9 г серной кислоты в 250 см3 раствора равна:
![]() .
.
Массовая концентрация (титр) – это отношение массы растворенного вещества к объему раствора:
![]() .
.
Единицей измерения является г/дм3 или г/см3.
Например, массовая
концентрация раствора, 100 см3
которого содержат 5 г
![]() ,
равна:
,
равна:
![]() .
.
![]() .
.
Доля используется для выражения состава растворов (смесей) в тех случаях, когда известно количество (масса, объем) как растворенного вещества (компонента), так и раствора (смеси). Наиболее часто используется понятие массовая доля.
Массовая доля – это отношение массы растворенного вещества к общей массе раствора:
![]() .
.
Массовая доля выражается в долях единицы или в процентах:
![]() .
.
Например, массовая
доля хлорида натрия в растворе,
приготовленном из 5 г
![]() и 195 см3
воды, равна:
и 195 см3
воды, равна:
![]() .
.
Плотность воды равна:
![]() .
.
