
- •27 Декабря 2009, протокол № 5
- •Введение
- •Правила техники безопасности и пожарной безопасности в лаборатории химии Общие требования безопасности
- •Требования безопасности перед началом работ
- •Правила безопасности при выполнении работ
- •Первая помощь при несчастных случаях в лаборатории
- •Требования безопасности по окончании работ
- •Меры пожарной безопасности
- •Лабораторная работа № 1 скорость химических реакций и химическое равновесие
- •Краткие теоретические сведения Скорость химических реакций
- •Химическое равновесие
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 2 растворы
- •Краткие теоретические сведения
- •Общее для растворов и механических смесей
- •Общее для растворов и химических соединений
- •Способы выражения состава раствора
- •Экспериментальная часть
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 3 окислительно-восстановительные реакции
- •Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
- •Основные положения теории окислительно-восстановительных реакций (овр)
- •Классификация овр
- •Методы расстановки коэффициентов в уравнениях овр
- •1. Расстановка коэффициентов
- •2. Расстановка коэффициентов методом полуреакций
- •I вариант
- •II вариант
- •Экспериментальная часть
- •1. Реакции межмолекулярного окисления-восстановления
- •2. Реакции внутримолекулярного окисления-восстановления
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Часть I. Метод протекторной защиты.
- •Часть II. Метод катодной защиты (электрозащита).
- •Содержание отчета
- •Контрольные вопросы
- •Литература
- •Содержание
Лабораторная работа № 3 окислительно-восстановительные реакции
Цель работы: изучить основные типы окислительно-восстановительных реакций и овладеть методикой их проведения.
Реактивы:
раствор сульфата меди (![]() );
железная проволока или гвоздь; раствор
перманганата калия (
);
железная проволока или гвоздь; раствор
перманганата калия (![]() );
сульфит натрия кристаллический (
);
сульфит натрия кристаллический (![]() );
раствор серной кислоты
);
раствор серной кислоты![]() концентрации 1 моль/дм3;
раствор щелочи (
концентрации 1 моль/дм3;
раствор щелочи (![]() )
концентрации 1 моль/дм3;
раствор бихромата калия (
)
концентрации 1 моль/дм3;
раствор бихромата калия (![]() );
сульфат железа (II)
кристаллический (
);
сульфат железа (II)
кристаллический (![]() );
раствор иодида калия (
);
раствор иодида калия (![]() );
раствор пероксида водорода (
);
раствор пероксида водорода (![]() );
раствор нитрита натрия (
);
раствор нитрита натрия (![]() );
этанол (
);
этанол (![]() );
концентрированная серная кислота (
);
концентрированная серная кислота (![]() );
перманганат калия кристаллический (
);
перманганат калия кристаллический (![]() );
дистиллированная вода.
);
дистиллированная вода.
Оборудование: штативы и держатели для пробирок.
Посуда: химические пробирки, стеклянные стаканы на 50 см3, стеклянные палочки, спиртовки, пипетки, шпатели, фарфоровые чашки, промывалки.
Краткие теоретические сведения Основные понятия, связанные с реакциями окисления-восстановления
Из всего многообразия химических процессов можно выделить две большие группы реакций: реакции обмена и окислительно-восстановительные.
Реакции обмена протекают между ионами. Они не сопровождаются изменением степени окисления атомов элементов, входящих в состав реагирующих веществ, например:
![]()
Окислительно-восстановительными называются реакции, в которых происходит передача всех или части валентных электронов от одних атомов, молекул или ионов к другим атомам, молекулам или ионам, что вызывает изменение степени окисления.
Для изучения окислительно-восстановительных реакций (ОВР) нужно знать, что называется электроотрицательностью, валентностью и степенью окисления.
Электроотрицательность элемента – условная величина, характеризующая способность его атомов в химических соединениях притягивать к себе электроны от атомов-партнеров.
Валентность элемента – способность атомов образовывать химические связи. Количественно валентность определяется числом химических связей, которыми данный атом связан с другими атомами. Она не учитывает электроотрицательность атомов, связанных с данным атомом, и не имеет знаков (+) или (–), так как характеризует только число связей.
Степень окисления – это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
В основу расчета
степени окисления атомов в соединении
положен принцип, согласно которому
алгебраическая сумма степеней окисления
атомов в соединении равна нулю, а в
сложном ионе (типа
![]() ,
,![]() и т.п.) – заряду иона.
и т.п.) – заряду иона.
При расчетах надо знать несколько основных положений:
Металлы во всех сложных соединениях имеют только положительные степени окисления.
Неметаллы могут проявлять как положительные, так и отрицательные степени окисления.
Степень окисления простых веществ равна нулю
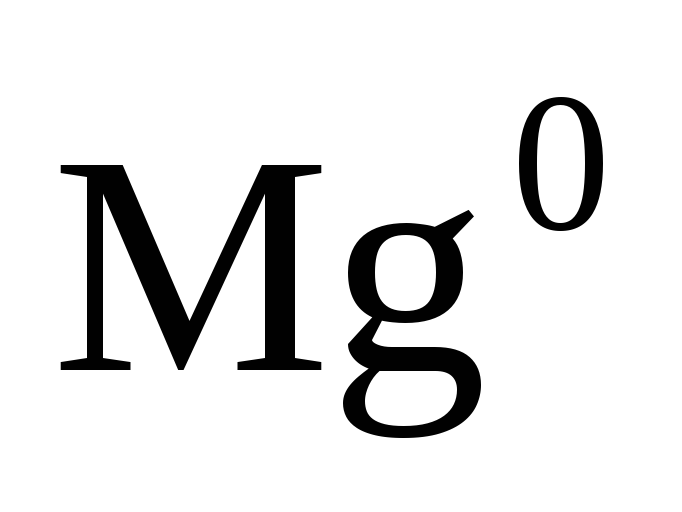 ,
,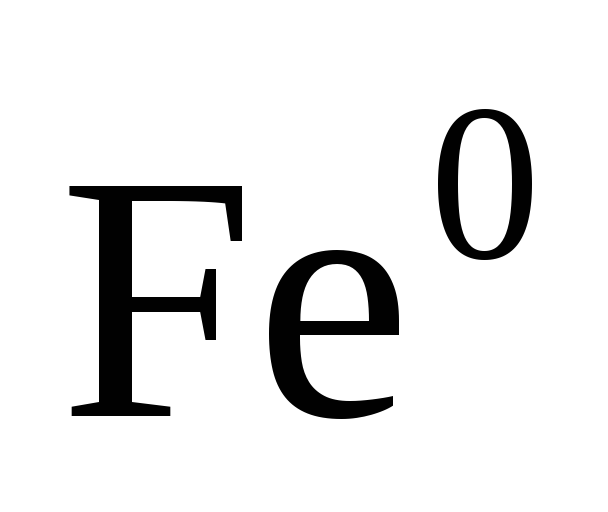 ,
,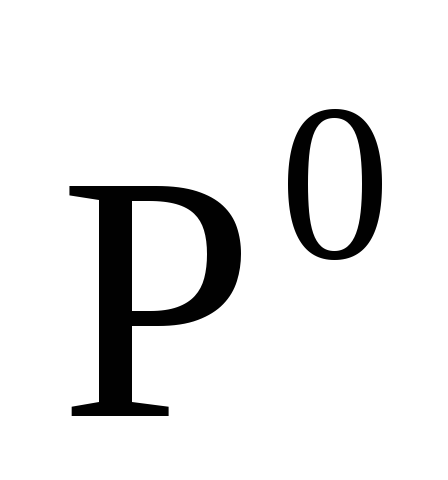 ,
,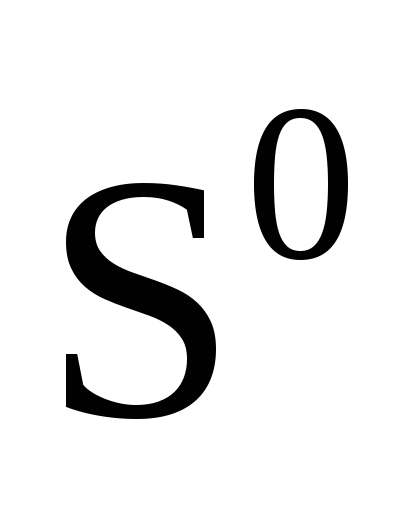 ,
,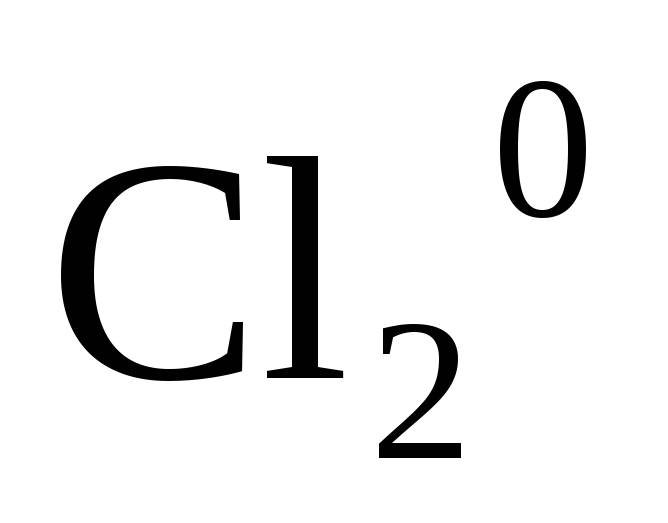 ,
,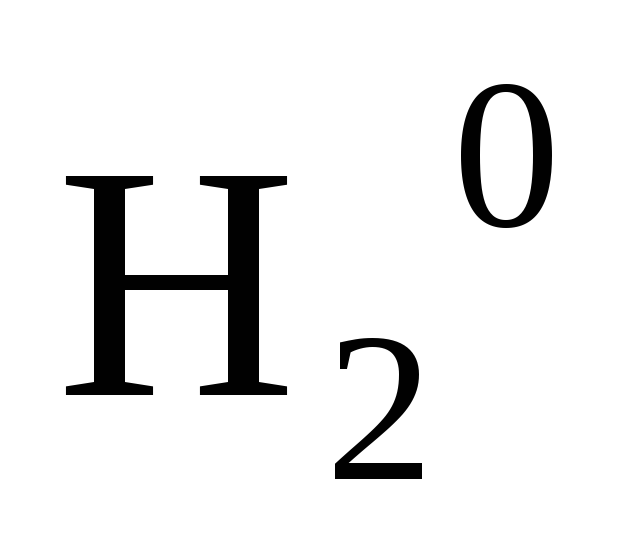 ,
,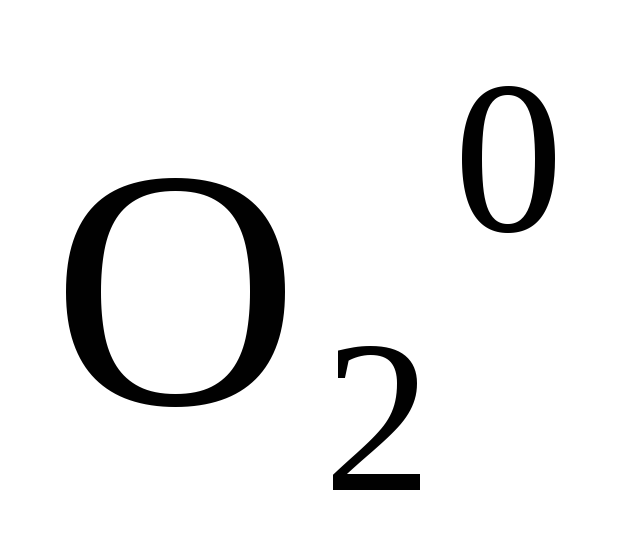 .
.Атомы кислорода в соединениях проявляют главным образом степень окисления (–2), за исключением фторокислорода
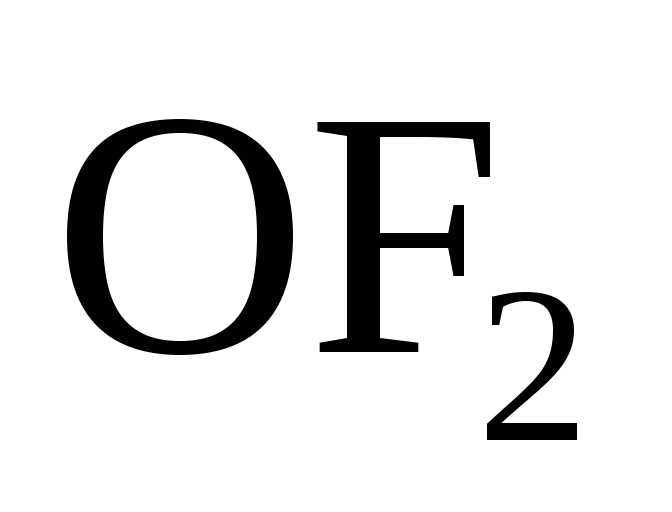 ,
в котором степень окисления кислорода
(+2) и пероксидов, где степень окисления
кислорода (–1). Например:
,
в котором степень окисления кислорода
(+2) и пероксидов, где степень окисления
кислорода (–1). Например: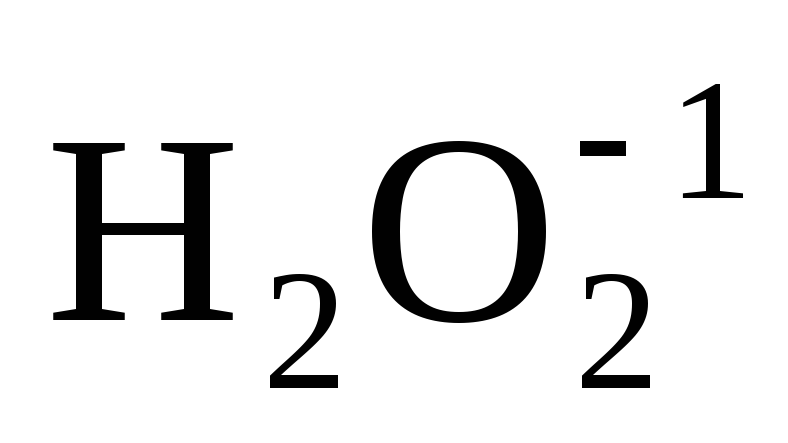 ;
;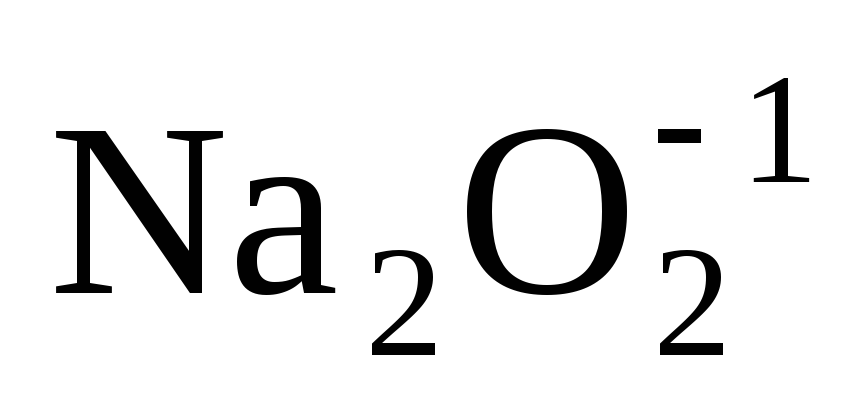 .
Для водорода характерна степень
окисления (+1). Исключение составляют
гидриды металлов, в которых степень
окисления водорода равна (–1). Например:
.
Для водорода характерна степень
окисления (+1). Исключение составляют
гидриды металлов, в которых степень
окисления водорода равна (–1). Например: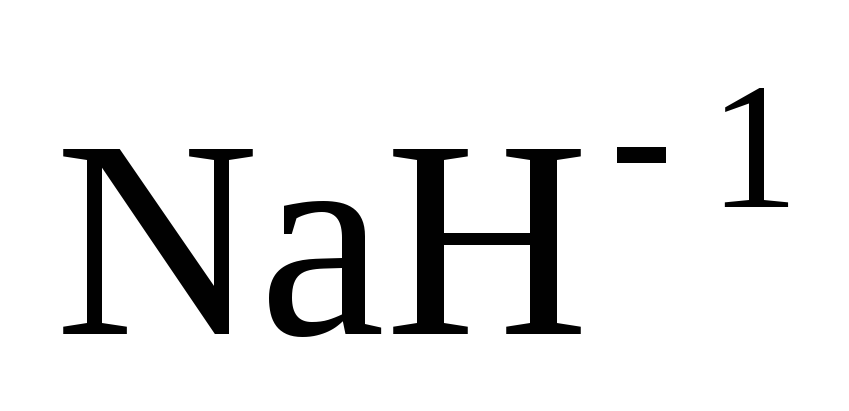 ;
;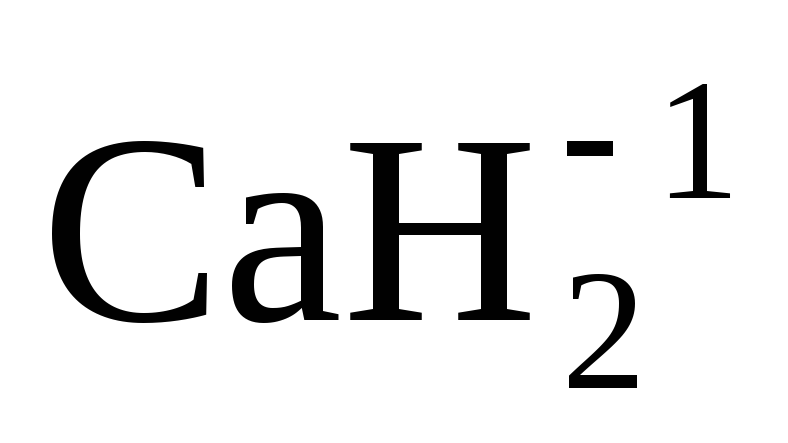 .
.Если молекула образована за счет ковалентной связи, то степень окисления более электроотрицательного атома обозначается знаком (–), а менее электроотрицательного атома – знаком (+). Например:
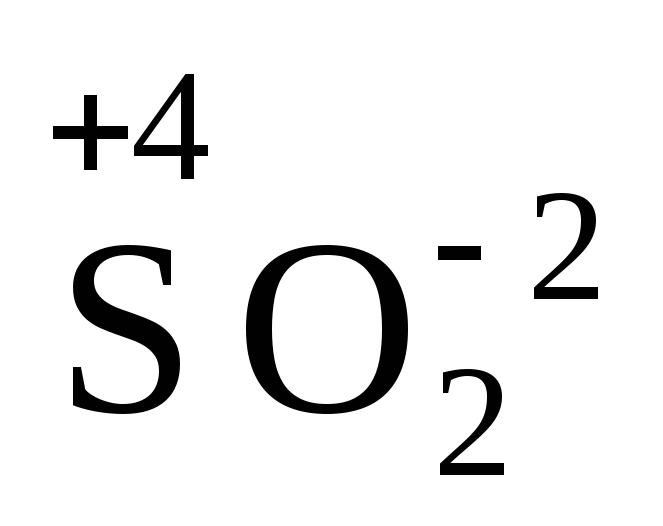 .
.Степень окисления одного из элементов в частице сложного вещества можно определить по степени окисления других элементов:
![]()
![]()
![]()
![]()
![]()
![]()
Элементы, проявляющие постоянную степень окисления:
а) щелочные металлы: (Li, Na, К, Rb, Cs) – (+1);
б) металлы II А и II В групп – (+2);
в) алюминий – (+3);
г) фтор – (- 1).
Для всех элементов положительная степень их окисления не может превышать величины, равный номеру группы периодической системы, в которой находится данный элемент: (S+6, Mn+7, N+5).
Ранее процессами окисления называли все процессы, которые сопровождаются присоединением кислорода. Процесс потери кислорода от его соединения с металлами называли восстановлением, например:
СuО+Н2![]() Сu+Н2О.
Сu+Н2О.
В дальнейшем окислением стали называть и отщепление водорода от молекул:
2Н2S
+ О2
![]() 2S+2Н2О,
2S+2Н2О,
а также реакции, протекающие в водных растворах и сопровождающиеся повышением степени окисления элементов:
2Fе+2С12+ С12=2Fе+3 С13.
Обратные
превращения Fe(III)![]() Fe(II)
стали называть восстановлением.
Fe(II)
стали называть восстановлением.
Таким образом, термин окисление можно трактовать трояко:
а) как присоединение кислорода к какому-нибудь веществу;
б) как выделение водорода из вещества;
в) как потерю электронов каким-нибудь веществом.
Термин восстановление также можно объяснить трояко:
а) как выделение кислорода из какого-нибудь вещества;
б) как присоединение водорода к веществу;
в) как присоединение электронов каким-нибудь веществом.
