
БХ-методичка
.pdf( Е2 - Е1 ) 1000.
В норме содержание β-липопротеинов составляет 350-550 условных единиц оптической плотности, что отвечает 3,0 - 4,5 г/л (300-450 мг%).
Тема 21. Бэта-окисление жирных кислот. Исследование обмена жирных кислот и кетоновых тел.
Актуальность темы.
Свободные жирные кислоты в плазму крови поступают после гидролиза триглицеридов жировой ткани и являются главными энергетическими субстратами для клеток. Определение жирных кислот в сыворотке крови имеет диагностическое значение. Гиперлипацидэмия наблюдается при сахарном диабете, при гиперсекреции адреналина и глюкокортикоидов, при нефрозах, голодании. Гиполипацидэмия отмечается при гипотиреозе, повышенной секреции инсулина.
Кетоновые тела: ацетоуксусная кислота, β-гидроксимасляная кислота синтезируются в печени и выполняют энергетическую функцию. В норме они образуются в небольших количествах и окисляются в тканях до оксида углерода и воды. Моча здорового человека дает отрицательную реакцию на кетоновые тела. При сахарном диабете, базедовой болезни, голодании происходит усиленный распад жиров (и белков), в связи с чем в крови накапливаются кетоновые тела, обусловливая смещение pH крови в кислую сторону (ацидоз). Это приводит к развитию интоксикации организма (кетоз).
Цель и начальный уровень знаний-умений.
Общая цель: изучить процесс β-окисления жирных кислот и пути использования ацетил-КоА в организме, а также биосинтез кетоновых тел и последствия кетоза.
Конкретные цели:
1.Трактовать биохимические закономерности метаболизма жирных кислот.
2.Объяснять биохимические основы возникновения и развития нарушений обмена липидов.
Исходный уровень знаний-умений: уметь писать строение жирных кислот, кетоновых тел.
Ориентировочная карта для самостоятельного изучения студентами учебной литературы при подготовке к занятию.
Содержание |
и |
Указания к учебным действиям |
|
|
последовательность действий |
|
|
|
|
1. |
Практическое значение |
1.1. Определение кетоновых тел в моче. |
||
определения кетоновых тел |
в |
|
|
|
моче. |
|
|
|
|
2. |
Окисление жирных кислот. |
2.1. Окисление жирных кислот (β-окисление) |
||
|
|
|
а) активация жирных кислот; |
|
|
|
|
б) роль карнитина в транспорте |
жирных кислот в |
|
|
|
митохондрии; |
|
|
|
|
в) последовательность ферментативних реакций. |
|
|
|
|
2.2. Энергетика β-окисление жирных кислот. |
|
|
|
|
2.3. Окисление глицерола. |
|
3. |
Обмен кетоновых тел. |
|
3.1. Кетоновые тела. Реакции |
биосинтеза и |
41

утилизации кетоновых тел, их физиологичное значение.
3.2.Метаболизм кетоновых тел в условиях патологии. Механизмы избыточного роста содержания кетоновых тел при сахарном диабете и голодании.
3.3.Последствия кетоза.
Задание для индивидуальной самостоятельной работы студентов.
Создать схемы:
1.Транспорт и депонирование липидов.
2.Подготовить реферативный доклад „Причины и последствия кетоза”, „Ацетонемический синдром у детей” (для педиатров).
Алгоритм лабораторной работы.
1. Выявление ацетона (кетоновых тел) в моче (реакциями с нитропрусидом натрия и хлоридом железа). Выявление кетоновых тел в моче экспресс-методом. Значение выявления кетоновых тел в крови и моче для медицины. Определение кетоновых тел в моче.
Принцип метода: ацетон и ацетоуксусная кислота при взаимодействии с нитpопpуссидом натрия (Na2[Fe (CN)6NO]) в щелочной среде образуют продукты реакции оранжевого цвета. При подкислении ледяной ( 100% ) уксусной кислотой эти продукты приобретают вишневый цвет.
Ход работы.
В центpифужную пробирку наливают 0,5 мл исследуемой мочи, потом 0,5 мл 10% раствора щелочи ( NaOH ) и 0,5 мл раствора нитpопpуссида натрия. При
перемешивании развивается |
оранжевая |
расцветка. |
Добавление 0,5 |
мл ледяной |
уксусной кислоты вызывает |
вишневую окраску. |
|
|
|
В крови концентрация кетоновых тел равняется |
|
|
||
0,034-0,43 ммоль/л ( 1-2 мг% ). |
|
|
|
|
В норме в моче кетоновые тела |
не обнаруживаются. Они появляются при |
|||
сахарном и стероидном диабете, при |
голодании, |
при недостатке |
углеводов в |
|
питании. |
|
|
|
|
2. Выявление ацетона йодоформной реакцией. Написать эту реакцию.
Тема 22. Биосинтез жирных кислот. Обмен сложных липидов.
Актуальность темы.
В отличие от простых жиров и жирных кислот, которые используются как энергетический материал, сложные липиды выполняют пластические функции и являются главными компонентами биологических мембран клеток. Нарушение обмена сложных липидов является основой развития таких заболеваний как стеатоз печени, атеросклероз (уменьшение антиатерогенных α-липопротеинов плазмы крови).
Генетически обусловленные нарушения синтеза лизосомальных ферментов распада сложных липидов приводит к развитию сфинголипидозов.
42
Цель и исходный уровень знаний.
Общая цель: уметь использовать знание обмена сложных липидов и регуляторных свойств эйкозаноидов для понимания патогенеза заболеваний. Уметь определять фосфолипиды в сыворотке крови.
Конкретные цели:
1.Трактовать биохимические закономерности внутриклеточного метаболизма липидов: биосинтез жирных кислот, фосфолипидов.
2.Трактовать биохимические закономерности регуляции биосинтеза жирных кислот и сложных липидов.
3.Объяснить биохимические основы возникновения и развития нарушений липидного обмена: ожирение, стеатогепатит.
Исходный уровень знаний-умений: уметь писать строение наиболее распространенных в биологических системах жирных кислот.
Ориентировочная карта для самостоятельного изучения студентами учебной литературы при подготовке к занятию.
Содержание |
|
и |
Указания к учебным действиям |
|
|||
последовательность действий |
|
|
|
|
|
||
1. Практическое |
изучение |
1.1. |
Определение |
фосфолипидов в |
|||
метода |
определения |
сыворотке крови. |
|
|
|
||
фосфолипидов |
в |
сыворотке |
|
|
|
|
|
крови. |
|
|
|
|
|
|
|
2. Биосинтез жирных кислот. |
2.1. Биосинтез высших жирных кислот, |
||||||
|
|
|
метаболические источники. |
|
|||
|
|
|
2.2. Биосинтез насыщенных жирных кислот |
||||
|
|
|
(пальмитата). |
|
|
|
|
|
|
|
2.3. Синтез малонил-КоА. |
|
|||
|
|
|
2.4. |
Особенности |
строения |
синтетазы |
|
|
|
|
жирных |
кислот, |
ацилтранспортирующего |
||
|
|
|
белка. Источники НАДФН для биосинтеза |
||||
|
|
|
жирных кислот. |
|
|
|
|
|
|
|
2.5. Регуляция биосинтеза жирных кислот. |
||||
|
|
|
2.6. Элонгация |
насыщенных |
жирных |
||
|
|
|
кислот. |
|
|
|
|
|
|
|
2.7. Образование |
|
моно- |
и |
|
|
|
|
полиненасыщенных |
жирных |
кислот. |
||
|
|
|
Физиологичное значение. |
|
|||
3. Обмен сложных липидов. |
3.1. |
Биологическая роль |
сложных |
||||
|
|
|
липидов. |
|
|
|
|
|
|
|
3.2. Биосинтез фосфатидилхолина. |
||||
|
|
|
3.3. |
Какие |
липотропные |
факторы |
|
|
|
|
(незаменимые |
компоненты |
еды) |
||
|
|
|
необходимы |
для |
синтеза |
||
|
|
|
фосфатидилхолина? |
|
|
||
|
|
|
3.4. |
Нарушение |
обмена |
сложных |
|
|
|
|
липидов – стеатоз печени. |
|
|||
|
|
|
|
43 |
|
|
|

4.Генетические аномалии 2.1. Сфинголипидозы:
обмена сфинголипидов. |
А) Болезнь Нимана-Пика. |
|
Б) Болезнь Тея-Сакса. |
|
В) Болезнь Гоше. |
Индивидуальная самостоятельная работа студента:
1.Создать схему биосинтеза лецитина (2 пути).
2.Подготовить реферативный доклад: „Биохимические механизмы развития стеатогепатита”.
Алгоритм лабораторной работы.
Количественное определение фосфолипидов в сыворотке крови.
Принцип метода: фосфолипиды осаждают трихлоруксусной кислотой вместе с белками крови. Осадок минерализируется (переводят органические соединения в неорганические) и в растворе минерализата с помощью цветной реакции определяют неорганический фосфат.
Ход работы.
В одну мерную центрифужную пробирку отмеряют 5 мл раствора минерализата; во вторую – 5 мл стандарта неорганического фосфата. Потом в обе пробирки добавляют по 1 мл раствора молибдата аммония, одну каплю раствора восстановителя и воды до 10 мл. Содержание пробирок тщательным образом перемешивают и оставляют на 20 минут. Потом определяют оптическую плотность (экстинкцию) растворов на ФЭК при красном светофильтре (λ= 640-690 нм) в 10 мм кювете.
По величинам экстинкций составляют пропорцию и рассчитывают содержание неорганического фосфата в минерализате сыворотки. Результат умножают на 25 (исходя из того, что содержание неорганического фосфата в фосфолипидах составляет 4%).
Тема 23. Биосинтез и биотрансформация холестерола. Исследование нарушений липидного обмена: стеаторея, атеросклероз, ожирение.
Актуальность темы.
Наиболее распространенные заболевания человечества – сердечно-сосудистые болезни и их тяжелые осложнения – ишемическая болезнь сердца (ИБС), ишемическая болезнь мозга и нижних конечностей связанны с нарушением обмена холестерола и развитием атеросклероза. Ожирение – эпидемия 21-го века. Его патогенетическую основу составляет нарушение обмена триацилглицеролов.
Сахарный диабет сопровождается развитием микро- и макроангиопатий, последние обусловленные расстройством обмена холестерола.
Знания метаболизма липидов необходимы для усвоения этиологии, патогенеза, факторов риска атеросклероза и его метаболической и фармакологической коррекции.
Цель и исходный уровень знаний.
Общая цель: изучение метаболизма и биотрансформации холестерола необходимо для глубокого анализа разных форм патологии липидного обмена,
44
которые составляют молекулярную основу наиболее распространенных заболеваний человечества.
Конкретные цели:
1.Трактовать биохимические закономерности регуляции биосинтеза холестерола и его биотрансформации: этерификация, образования желчных кислот, стероидных гормонов, витамина D3.
2.Анализировать изменения в системе циркуляторних транспортных липидов при патологии обмена липидов (атеросклероз, ожирение, сахарный диабет).
3.Объяснять биохимические основы развития патологии обмена липидов: генетических и приобретенных (атеросклероз, ожирение, сахарный диабет).
Исходный уровень знаний-умений: знать строение и функции липидов, гормоны желез внутренней секреции.
Ориентировочная карта для самостоятельного изучения студентами учебной литературы при подготовке к занятию.
Содержание |
и |
Указания к учебным действиям |
|
|||||||
последовательность действий |
|
|
|
|
|
|
|
|||
1. |
Практическое |
изучение |
1.1. |
Определение |
|
|
содержания |
|||
определения |
холестерола |
вхолестерола в сыворотке крови. |
|
|
||||||
сыворотке крови по Ильку. |
|
|
|
|
|
|
|
|||
2. Биосинтез холестерола. |
2.1. Биологическая роль холестерола. |
|
||||||||
|
|
|
|
2.2. |
Циркуляторный |
|
транспорт |
|||
|
|
|
|
холестерола. |
|
Норма |
|
|
содержания |
|
|
|
|
|
холестерола в сыворотке крови. Транспорт |
||||||
|
|
|
|
холестерола, |
|
изменения |
|
в |
системе |
|
|
|
|
|
липопротеинов |
при |
патологии, |
их |
|||
|
|
|
|
функциональное значение. |
|
|
|
|
||
|
|
|
|
2.3. Схема реакций синтеза холестерола. |
||||||
|
|
|
|
Ключевая реакция биосинтеза. |
|
|
|
|||
|
|
|
|
2.4. Регуляция синтеза холестерола. |
|
|||||
3. |
Пути |
биотрансформации |
3.1. |
Механизм |
|
этерификации |
||||
холестерола. |
|
|
холестерола. |
|
|
|
|
|
|
|
|
|
|
|
3.2. Биосинтез желчных кислот из |
||||||
|
|
|
|
холестерола. |
|
|
|
|
|
|
|
|
|
|
3.3. Биосинтез стероидных гормонов из |
||||||
|
|
|
|
холестерола. |
|
|
|
|
|
|
|
|
|
|
3.4. Образование витамина D3 |
из |
|||||
|
|
|
|
холестерола. |
|
|
|
|
|
|
4. |
Патология |
липидного |
4.1. Механизмы развития атеросклероза. |
|||||||
обмена. |
|
|
4.2. Механизмы развития ожирения. |
|
||||||
|
|
|
|
4.3. Нарушение липидного обмена при |
||||||
|
|
|
|
сахарном диабете (макроангиопатий, кетоз), |
||||||
|
|
|
|
механизмы их развития. |
|
|
|
|
||
|
|
|
|
4.4. Стеаторея, механизм развития. |
|
|||||
Задание для индивидуальной самостоятельной работы студентов.
1.Создание схемы в электронном варианте по теме “Биосинтез холестерола и его регуляция”, “Транспорт липидов”.
2.Оценка по биохимическим показателям нарушений липидного обмена при патологических состояниях.
45

Алгоритм лабораторной работы.
Количественное определение холестерола в крови по Ильку.
Принцип метода: Холестерол при взаимодействии с уксусным ангидридом в присутствии концентрированных серной и уксусной кислот образует продукты реакции сине-зеленого цвета. Интенсивность окраски прямо пропорциональна количеству холестерола.
Ход работы.
Пробирки и микропипетки должны быть сухими. В две центpифужные мерные пробирки наливают по 2 мл реактива Илька (Осторожно, концентрированные кислоты!!!); потом в одну из них отмеряют 0,1 мл стандартного раствора холестерола, а во вторую - 0,1 мл исследуемой сыворотки. Содержание пробирок осторожно стряхивают для перемешивания и оставляют на 20 минут. Потом растворы фотометриpуют на ФЭК при красном светофильтре (λ = 630-690 нм). По величинам оптической плотности (экстинкции) стандарта и сыворотки составляют пропорцию и рассчитывают концентрацию холестерола в исследуемой сыворотке.
В норме концентрация холестерола (общего) в сыворотке взрослого человека составляет 3,1 – 5,2 ммоль/л (120-250 мг%). Эфиpосвязанный холестерол сыворотки составляет 2/3 общего холестерола.
Тема 24. Исследование превращений аминокислот (трансаминирование, дезаминирование, декарбоксилирование).
Актуальность темы.
Впроцессе декарбоксилирования аминокислот в тканях образуются активные соединения – биогенные амины (ГАМК, дофамин, гистамин, серотонин, норадреналин, адреналин), и амины – эндогенные токсины (путресцин, кадаверин) при гниении белков в кишечнике.
Впроцессе дезаминирования аминокислот образуются кетокислоты, которые могут использоваться в процессе трансаминирования для синтеза заменимых аминокислот.
Аланинаминотрансфераза (АлАТ) является гепатоспецифическим ферментом, аспартатаминотрансфераза (АсАТ) является кардиоспецифическим ферментом. Эти ферменты используются для энзимодиагностики заболеваний печени и миокарда.
Цель и исходный уровень знаний.
Общая цель:
1.Усвоить принцип метода и оценку клинического значения определения активности АлАТ и АсАТ.
2.Воспроизвести в эксперименте процесс переаминирования с использованием глутаминовой и пировиноградной кислот.
Конкретные цели:
1.Трактовать биохимические закономерности внутриклеточного метаболизма аминокислот: процессы тpансаминирования, дезаминирования, декаpбоксилирования, объяснять биологическое действие образуемых биогенных аминов: серотонина, гистамина, гамма-аминомасляной кислоты.
2.Написать уравнение реакции переаминирования глутаминовой и пировиноградной кислот.
46
Исходный уровень знаний-умений: уметь писать формулы 20 аминокислот. Применять метод хроматографии для выявления аминокислот.
Ориентировочная карта для самостоятельного изучения студентами учебной литературы при подготовке к занятию.
Содержание |
и |
Указания к учебным действиям |
|
|
|||||
последовательность действий |
|
|
|
|
|
|
|
||
1. |
Практическое |
изучение |
1.1. |
Определение |
|
активности |
|||
определения |
активности |
аминотрансфераз в сыворотке крови. |
|
||||||
аминотрансфераз в |
сыворотке |
|
|
|
|
|
|
|
|
крови. |
|
|
|
|
|
|
|
|
|
2. |
Пул |
свободных |
2.1. |
Пути |
поступления |
свободных |
|||
аминокислот в организме. |
аминокислот в ткани. |
|
|
|
|
||||
|
|
|
2.2. |
Пути |
использования |
свободных |
|||
|
|
|
аминокислот в тканях. |
|
|
|
|||
3. |
Общие пути превращения |
3.1. |
Трансаминирования |
аминокислот: |
|||||
аминокислот. |
|
реакции и их биохимическое значение. |
|
||||||
|
|
|
3.2. |
Написать |
уравнение |
реакций |
|||
|
|
|
переаминирования |
глутаминовой |
и |
||||
|
|
|
пировиноградной кислот. |
|
|
|
|||
|
|
|
3.3. |
|
Механизм |
|
действия |
||
|
|
|
аминотрансфераз. |
|
|
|
|
||
|
|
|
3.4. |
Прямое |
и |
|
непрямое |
||
|
|
|
дезаминирование |
свободных |
|
L- |
|||
|
|
|
аминокислот в тканях. |
|
|
|
|||
|
|
|
3.5. |
Декарбоксилирование |
L- |
||||
|
|
|
аминокислот в организме человека. |
||||||
|
|
|
Физиологичное |
значение |
образованных |
||||
|
|
|
продуктов. |
|
|
|
|
|
|
|
|
|
3.6. Окисление биогенных аминов. |
|
|||||
Задание для индивидуальной самостоятельной работы студентов.
1.Строить схемы и писать биохимические реакции превращения аминокислот в метаболических процессах дезаминирования, трансаминирования и декарбоксилирования.
2.Анализировать и трактовать молекулярные механизмы регуляции обмена аминокислот и отдельных метаболических путей.
3.Подготовить реферативное сообщение: ”Клиническое значение определения аминотрансфераз”.
Алгоритм лабораторной работы.
1. Воспроизвести в эксперименте процесс трансаминирования, используя глутаминовую и пировиноградную кислоты.
Принцип метода: заключается в том, что в процессе ферментативного переноса аминогруппы с глутаминовой кислоты на кетокислоту (ПВК) образуется аланин. О том, что проходит переаминирование, заключают по появлению аланина на хромотограме.
Ход работы: в две пробирки отмеряют по 0,5 мл раствора глутаминовой кислоты, 0,5 мл раствора ПВК, 1 мл раствора углекислого калия и 0,25 мл раствора монобромуксусной кислоты.
В 1 пробирку (опыт) добавляют 0,5 мл свежей мышечной кашки, во вторую пробирку - мышечную кашку, которая предварительно прокипячена на протяжении 1-2 минут. Обе пробирки ставят в термостат при t = 37оС на 15 минут. Потом в каждую
47
добавляют по 0,25 мл уксусной кислоты и кипятят 2-3 минуты до полного осаждения белков. Содержимое пробирок фильтруют.
Фильтраты хроматографируют. С этой целью на линии старта двух полосок фильтровальной бумаги (опыт и контроль) наносят по капле фильтратов из пробирок, каждый раз подсушивая на воздухе. Полоски бумаги опускают в пробирки, на дне которых находится фенол, насыщенный водой. Пробирки в штативе помещают в термостат на 1 час при 35-40оС. После этого полоски бумаги вынимают, отмечают линию фронта (финиш) растворителя, подсушивают 10-15 минут при 100оС, а затем проявляют раствором нингидрина. Снова подсушивают.
Для каждого определенного пятна вычисляют коэффициент Rf по формуле:
Rf = 1/h
где, 1- это расстояние от старта к центру пятна,
h- расстояние от старта к финишу ( расстояние, которое прошел растворитель).
На основе полученных данных делают вывод, хроматограму подклевывают к протоколу.
Rf аминокислот (для фенола):
Аспарагиновая к-та |
– 0,07 |
Аргинин |
– 0,41 |
Глутаминовая к-та |
– 0,16 |
Тирозин |
– 0,52 |
Цистеин |
– 0,19 |
Аланин |
– 0,55 |
Глицин (гликокол) |
– 0,30 |
Фенилаланин |
– 0,78 |
Метионин |
– 0,39 |
Лейцин |
– 0,79 |
2. Определение активности аминотрансфераз.
Принцип метода. Аминотрансферазы – ферменты которые содержат в качестве коферментов фосфопиридоксамин, катализируют обратный перенос аминогрупп с α-аминокислот на α-кетокислоты. Определение концентраци α-кетокислот, которые образуются при трансаминирование лежит в основе динитрофенилгидразинового метода определения активности трансаминаз.
Ход работы. Определение аспартатаминотрансферазы (АсАТ). В пробирку вносят 0,5 мл субстратно-буферной смеси для определения АсАТ, выдерживают в термостате при t =37оС в течении 5 минут, добавляют 0,1 мл сыворотки и инкубируют при t =37оС 60 минут. Потом добавляют 0,5 мл раствора динитрофенилгидразина и выдерживают в течении 20 минут при комнатной температуре. Добавляют 5 мл 0,4 М раствору NaOH, перемешивают и оставляют на 10 минут.
Измеряют оптическую плотность проб, которая исследуются при λ = 560 нм.
Определение активности аланинаминотрансферазы (АлАТ). В пробирку вносят 0,5 мл субстратно-буферной смеси для определения АлАТ, выдерживают в термостате при t =37оС в течении 5 минут, добавляют 0,1 мл сыворотки и инкубируют при t =37оС 30 минут. Потом добавляют 0,5 мл раствора динитрофенилгидрозина и выдерживают в течении 20 минут при комнатной температуре. Добавляют 5 мл 0,4 М раствору NaOH, перемешивают и оставляют на 10 минут. Измеряют оптическую плотность проб, которые исследуются. Контрольные пробы обрабатывают так, как опытные, но сыворотку добавляют после инкубации проб.
Расчет активности ферментов проводят по калибровочному графику. При построении калибровочного графика на оси ординат откладывают значения оптической плотности, а на оси абсцисс содержание ПВК.
Физиологические уровни: для АсАТ – 0,1-0,5, для АлАТ – 0,1-0,7 мкмоль ПВК на 1 мл сыворотки за 1 час инкубации при t =37оС.
48
Тема 25. Биосинтез глутатиона и креатина.
Актуальность темы.
Креатинин – это конечный продукт обмена креатинфосфата тканей. Повышенная экскреция с мочой креатинина наблюдается у больных с лихорадкой, острыми инфекциями, при сахарном диабете. Креатинин – азотистый шлак, но благодаря азотовыделительной функции почек кровь от него очищается. При патологии почек, что сопровождается нарушением азотовыделительной функции, а также при острой сердечной недостаточности, креатинин накапливается в крови, а выделение его с мочой снижается. Поэтому количественное определение креатинина в крови и моче является одним из обязательных анализов при заболеваниях почек. Креатинфосфат применяют в клинике для лечения больных с сердечно-сосудистой недостаточностью.
Цель и исходный уровень знаний.
Общая цель.
Усвоить метод количественного определения креатинина в моче, уметь оценить результаты анализа. Знать цветную реакцию на креатин с пикриновой кислотой, уметь рассчитывать результаты анализа.
Конкретные цели:
1.Объяснять биохимические механизмы образования креатина и креатинина.
2.Анализировать клиническое значение нарушений обмена креатина и креатинина.
3.Трактовать роль глутатиона в обмене органических пероксидов.
Исходный уровень знаний-умений: уметь писать строение аминокислот – предшественников синтеза креатина и глутатиона.
Ориентировочная карта для самостоятельного изучения студентами учебной литературы при подготовке к занятию.
Содержание |
и |
Указания к учебным действиям |
|
||||
последовательность действий |
|
|
|
|
|
||
1. Практическое |
значение |
1.1. Определение креатинина в моче. |
|||||
определения креатинина в моче. |
|
|
|
|
|
||
2. Обмен креатина. |
|
2.1. |
Биологическая |
|
роль |
||
|
|
|
креатинфосфата. |
|
|
|
|
|
|
|
2.2. Биосинтез креатина. |
|
|
||
|
|
|
2.2.1. |
Предшественники |
биосинтеза |
||
|
|
|
креатина. |
|
|
|
|
|
|
|
2.2.2. |
Особенности второго |
этапа |
||
|
|
|
биосинтеза креатина – трансметилирование |
||||
|
|
|
гликоциамина (гуанидинацетата). Источники |
||||
|
|
|
СН3–групп. |
|
|
|
|
|
|
|
2.3. |
Реакция |
фосфорилирования |
||
|
|
|
креатина. |
|
|
|
|
3. |
Клинико-биохимическое |
3.1. Клиническое значение определения |
|||||
значение |
нарушений |
обмена |
содержания креатина и креатинина в крови |
||||
креатина. |
|
|
и моче. |
|
|
|
|
|
|
|
3.2. Клиническое значение определения |
||||
|
|
|
креатинфосфокиназы. |
|
Изоформы |
||
|
|
|
креатинфосфокиназы. |
|
|
|
|
4. Глутатион. |
|
4.1. |
Предшественники |
биосинтеза |
|||
|
|
|
глутатиона. |
|
|
|
|
|
|
|
4.2. |
Роль глутатиона |
в |
обмене |
|
49
органических пероксидов.
Задание для индивидуальной самостоятельной работы студентов.
Подготовить реферат на тему:
1.Современные биохимические методы исследования функции почек.
2.Биологическая роль системы глутатиона в антиоксидантной защите.
Алгоритм лабораторной работы.
Количественное определение креатинина в моче.
Принцип метода: креатинин при взаимодействии с пикриновой кислотой в щелочной среде образует окрашенные соединения, интенсивность окраски которых пропорциональна концентрации креатинина в моче.
Экскреция креатинина: ♂ - 1,0-2,0 г/сут
♀ - 0,8-1,8 г/сут
Ход работы:
В колбу объемом 100 мл наливают 1 мл мочи, 1 мл NaOH, 1,5 мл раствора пикриновой кислоты, перемешивают и оставляют на 10 минут. Потом доводят объем до 100 мл дист. водой. Параллельно выполняют контроль: 1 мл Н2О, 1 мл NaOH, 1,5 мл пикриновой кислоты, перемешивают и доводят объем до 100 мл дист. водой.
Фотометрируют против контроля на ФЭК с зеленым светофильтром в кювете на 5 мм. С помощью калибровочного графика определяют количество креатинина в 1 мл моче и перечисляют его количество в моче за сутки (1500-2000).
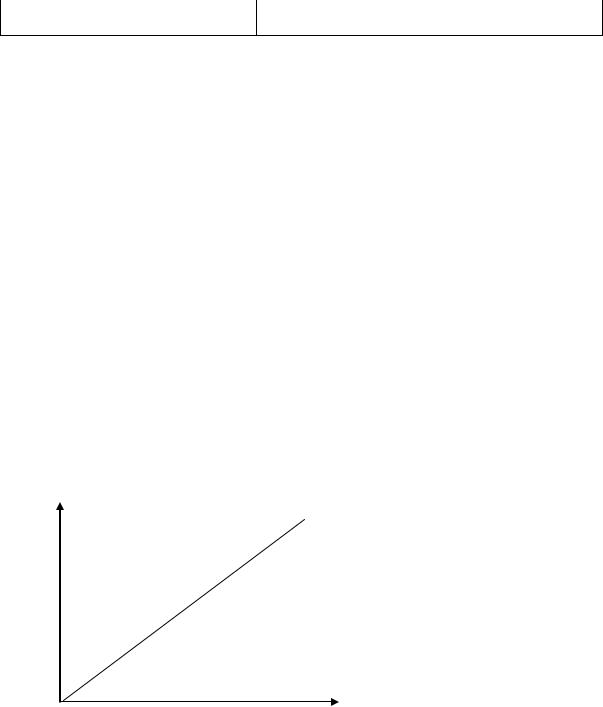
Калибровочный график количественного определения креатинина в 1 мл моче.
Е
0,25
0,20
0,15
0,10
0,5 1,0 1,5 2,0 |
С, мг/мл |
Тема 26. Исследование процессов детоксикации аммиака и биосинтеза мочевины.
Актуальность темы.
Понимание биохимических процессов, которые лежат в основе обезвреживания аммиака, а также правильная трактовка изменения концентрации мочевины в крови и моче, крайне необходимы практикующему врачу для правильной постановки диагноза, оценки состояния больного и динамического наблюдения за эффективностью назначенного лечения. Измерение содержания мочевины является важным показателем конечного этапа белкового обмена. В норме с мочой выделяется в
50
