
- •Химическая сборка макромолекул в процессах поликонденсации
- •Глава 1 отличительные признаки поликонденсации
- •Отличительные признаки поликонденсации
- •Классификация процессов синтеза полимеров
- •Определение процессов полимеризации и поликонденсации
- •Химическая сборка макромолекул в процессах поликонденсации
- •Влияние изменения реакционной способности функциональных групп на зависимости степени превращения мономера и степени полимеризации от глубины протекания процесса. Реакционная способность мономеров.
- •Особенности взаимодействия бифункциональных мономеров.
- •Оценка реакционной способности мономеров.
- •Реакционная способность олигомеров.
- •Экспериментальное определение характера химической сборки полимерной цепт.
- •Моделирование поликонденсации.
- •Стадии формирования олигомерной цепи органосилоксанов. Механизм и кинетика гомофункциональной конденсации органосиланолов.
- •Зависимость скорости гмфкr2Si(oh)2от концентрации реагентов. Порядок реакции по реагентам Порядок реакции по силанолу
- •Порядок по катализатору
- •Индукционные и стерические эффекты
- •Термодинамические параметры активации гмфк силанолов
- •Обратимость в гмфк силанолов
- •Влияние среды на скорость гмфк силанолов.
- •Поликонденсация кремнийорганических мономеров. Лабораторная работа № 1. Поликонденсация метилфенилсиландиола в диоксане в присутствии катализатора –hCl.
- •Порядок работы.
- •Проведение эксперимента.
- •Задание
- •Литература
Химическая сборка макромолекул в процессах поликонденсации
Стадия образования макромолекулы
Образование макромолекул при поликонденсации происходит путем взаимодействия между собой реакционных центров мономеров, олиго- и полимерных молекул. В начале процесса молекулыбифункционального мономера взаимодействуют как друг с другом с образованием Тетрамеров, так и с мономером с образованием тримеров. Тетрамеры и тримеры взаимодействуют друг с другом и с другимиn-мерами, образуя все более и более высокомолекулярныепродукты (см. рис. 1.3). Такой характер процесса определяет рядособенностей стадии образования макромолекул при поликонденсации.
Основные особенности процесса
Бимолекулярность. Отличительной особенностью реакций, составляющих стадию роста, является их бимолекулярность—второй порядок по реакционным центрам. Это означает, что образование межзвенных связей протекает путем взаимодействия любых двух (принадлежащих любым n-мерам) реакционных центров.
Вероятностный (статистический) характер. При поликонденсации в реакционной системе практически в любой момент времени протекает одновременно множество реакций, различающихся по степени поликонденсации (размеру) участвующих в них молекул.
Хотя эти реакции различны по «размеру» участвующих в них молекул, все они совершенно идентичны с точки зрения химической кинетики. Это только различные доли (акты) одной и той же химически реагирующей системы. Поэтому при одинаковой реакционной способности всех реагентов поликонденсационного синтеза (подчинению их правилу Флори) реакции между каждым реагентом неразличимы между собой, т. е. в ходе поликонденсации отсутствует какое-либо преимущественное направление процесса. Все это дает право говорить о вероятностном (статистическом) характере поликонденсации.
При полимеризации из огромного множества реакций система «отбирает» для построения макромолекулы лишь реакции n-мера с
18
мономером Такой «отбор» проводится путем применения в первую очередь мономеров определенного строения, а также использования специальных добавок (инициатор, катализатор).
В ряде случаев некоторая часть реагентов системы может различаться по реакционной способности (например, мономеры и олигомеры). Однако и в этом случае число неразличимых между собой реакций остается достаточно большим; меняется лишь соотношение между ними.
Кроме одинаковой реакционной способности реагентов процесса статистический (вероятностный) характер поликонденсации обусловлен кинетической независимостью множества протекающих в системе реакций, т. е. реакции не оказывают существенного влияния на кинетические параметры друг друга—каждая реакция протекает в реакционной системе так, как если бы другие реакции в ней отсутствовали.
Вероятностный характер поликонденсации является одной из главных причин получения полимеров с широким молекулярно-массовым распределением (подробнее см. ниже).
Из вероятностной природы поликонденсации вытекает и возможность внутримолекулярной циклизации (реакции концевых функциональных групп л-мера между собой): внутримолекулярная циклизация является не побочной реакцией при поликонденсации, а ее непременной составной частью.
«Поблочный» характер образования макромолекулы также является важной особенностью поликонденсации. По отношению ко всему множеству реакций, составляющих процесс поликонденсации, доля реакции n-мер + мономер мала, особенно на глубоких стадиях процесса, когда количество мономера в реакционной системе становится малым. Поэтому можно считать, что при поликонденсации макромолекулы наращиваются не постепенно, за счет многократного присоединения молекул мономера, а как бы «рывками», из «кусков» (блоков), размер которых по мере протекания процесса увеличивается. Вследствие такого характера процесса некоторые авторы называют поликонденсацию ступенчатым процессом. Эта специфика процесса положена в основу схемы простейшего процесса поликонденсации (поликонденсации дубликацией), широко используемой как для объяснения наблюдаемых закономерностей процесса, так и для вывода простейших уравнений.
19
Изменение числа молекул и реакционных центров в системе. Увеличение молекулярной массы полимера при поликонденсации происходит за счет уменьшения числа молекул в системе. Эта особенность поликонденсации показана на рис. 1.3. Кривая АВ соответствует изменению количества молекул в системе mи их степени поликонденсацииnпо ходу поликонденсации. Она описывает течение идеальной поликонденсации, которой отвечает равенствоmп =mо. Реальный процесс поликонденсации изображается, например, кривой АБ, лежащей ниже кривой АВ. За счет протекания побочных реакций данному количеству молекул в реальных системах будет соответствовать меньшая степень поликонденсации, чем определяемая кривой АВ.
С этим связана еще одна, уже отмечавшаяся ранее [5] особенность поликонденсации: в ходе процесса резко уменьшается количество реакционных (активных) центров.
Таким образом, при поликонденсации количество молекул реагентов в системе (в том числе активных макромолекул) определяется глубиной процесса и особенностями реакций образования макромолекул.
В отличие от поликонденсации идеальный процесс полимеризации протекает при постоянном количестве полимерных молекул в системе. Это количество не связано с реакциями роста макромолекул, а определяется другими (в первом приближении независимыми от роста) реакциями (инициированием и т. д.), при этом количество активных центров (концов растущей цепи) остается постоянным, поскольку вследствие цепного характера процесса исчезновение каждого активного центра в акте роста сопровождается появлением другого, идентичного ему активного центра.
В связи с данной особенностью поликонденсации большое значение для исследования процессов имеет определение количества молекул продуктов (олиго- и полимера) в реакционной системе. Наиболее просто и надежно это можно определить по количеству концевых групп макромолекул. При этом необходимо учитывать резкую убыль (исчезновение) молекул мономера на сравнительно ранних стадиях процесса.
Связь молекулярной массы полимера с глубиной превращения
Поскольку при поликонденсации нарастание молекулярной массы полимера происходит за счет взаимодействия между собой
20
реакционных центров молекул всех реагентов системы (моно-, олиго- н n-меров) и сопровождается соответствующим уменьшением числа молекул реагентов, то можно достаточно легко установить связь между молекулярной массой образующегося продукта и глубиной превращения реакционных центров *.
Для полного описания процесса следует ввести еще следующие понятия: х.—глубина процесса по реакционным центрам; ХМ— конверсия (глубина процесса по мономеру).
Величина xравна количеству прореагировавших реакционных центров независимо от того, кому они принадлежали (мономеру или олигомерам), и выражается долей от их исходного общего количества:
![]()
где No— исходное количество реакционных центров;N-/— количество реакционных центров, оставшихся в системе к дачному моменту времени. Для бифункциональных мономеровNo= 2Мо (где Мо—исходное количество молекул мономера). Величина Хм равна количеству вступившего в реакцию мономера, она выражается долей от его исходного количества:
![]()
где М—количество мономера к данному моменту времени
Очень важно соотношение между х и ХМ, поскольку одному и тому же значению х могут соответствовать разные значенияХМ. На рис. 2.1 показано, что при одной и той же общей глубине превращения х = 0,5 в случае Б глубина превращения по мономеру равна 1,0, в случае В—0,75. Из рисунка видно также, что в обоих случаях образовавшиеся продукты значительно различаются по длине цепи. В реальных системах существует различие соотношений между х иХМ. Основные варианты этих соотношений показаны на рис. 2.2.
Если ХМ= 2х, то убыль функциональных групп в системе происходит за счет убыли обеих функциональных групп мономера. Этому отвечает случай дубликации молекул мономера друг с другом. Это типично поликонденсационный процесс.
21
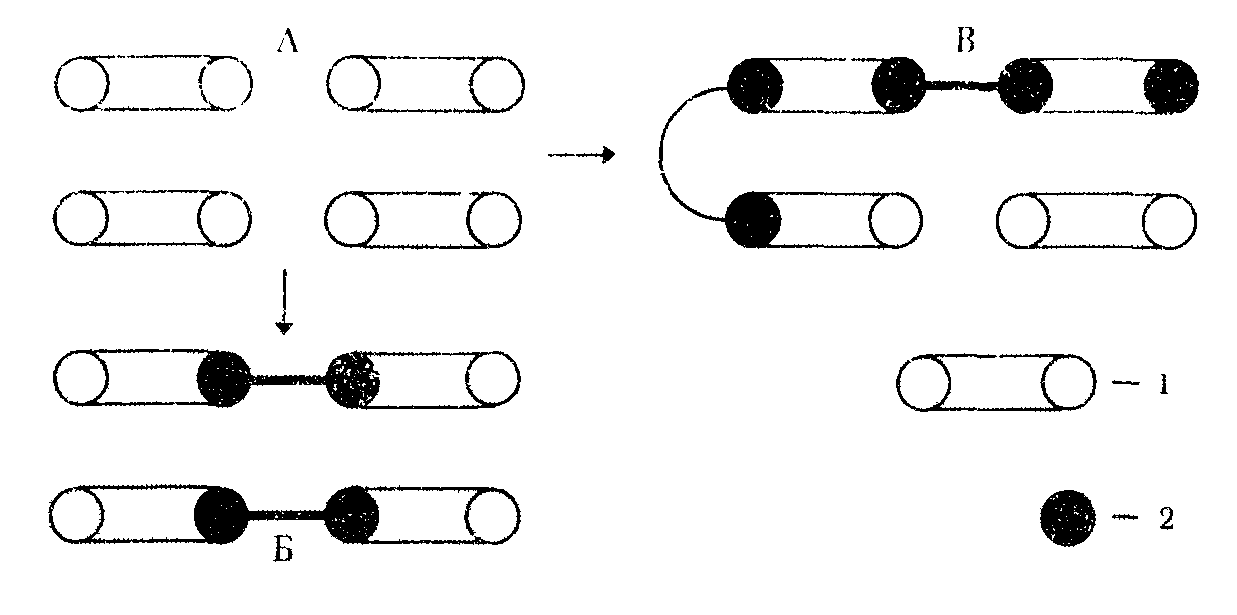
Рис. 2.1, Соотношение между глубиной превращения реакционных центров – Хи глубиной превращения по мономеру ХМ: 1—исходное состояние; Б —х= 0.5;ХМ= 1,0; В –х= 0,5;ХМ= 0.75; 1 — молекула мономера с двумя реакционными центрами; 2—прореагировавший реакционный центр.
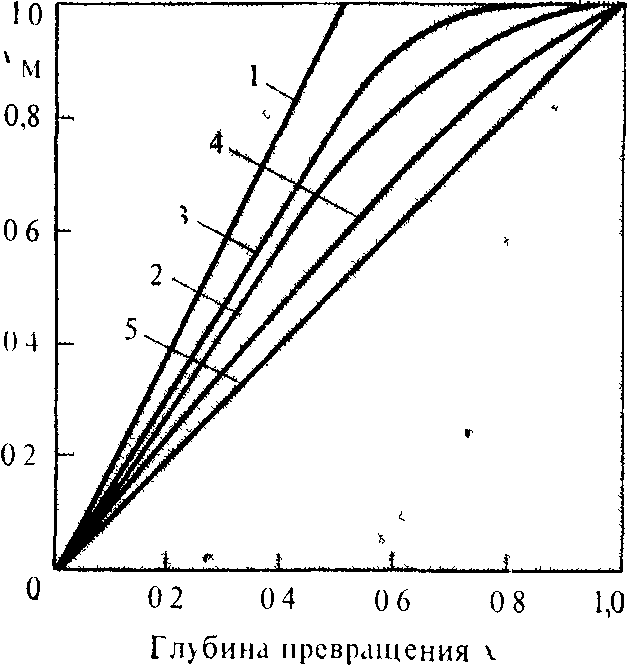
РИС 2 2 Взаимосвязь между глубиной превращения по мономеру – ХМ„ и глубиной превращения по функциональным группам х для различных процессов: 1—поликонденсация удвоением; 2—поликонденсация по Флори, 3 — поликонденсация мономеров с зависимыми функциональными группами (k1/k2>l), 4—поликонденсация мономеров с зависимыми функциональными группами (k1/k2< 1), 5 —полимеризация.
22
Если ХМ= х, то убыль функциональных групп в системе происходит за счет убыли одной функциональной группы мономера, т.е. рост цепи макромолекулы происходит путем последовательного присоединения молекул мономера к полимерной цепи; при этом реакционная способность функциональных групп олигомеров при реакции друг с другом гораздо ниже, чем при реакции с мономером. Этому случаю соответствует полимеризационный процесс (кривая 5).
Случаю, отвечающему наиболее вероятностному варианту поликонденсации, т. е. равной реакционной способности всех функциональных групп в системе, включая мономер, соответствует кривая 2. Другие случаи поликонденсации описываются кривыми 3 и 4: кривая 3 соответствует коэффициенту взаимозависимости k1/k2>l, кривая 4 — ситуации, когдаk1/k2< 1. (О коэффициенте взаимозависимости см. ниже.)
Совершенно очевидно, что учет суммарной степени превращения х и по мономеру л:м является лишь первым шагом к детальному рассмотрению поликонденсационных процессов, так как достаточно полно описывает лишь начальную стадию. Аналогичное рассуждение можно провести для любой глубины процесса, считая конечный продукт на i-том этапе мономером дляi+1) этапа. Для этого потребовалось бы ввести понятие глубины превращения по всемn-мерам. Однако решение практических задач при этом становится возможным лишь при использовании ЭВМ.
Для того чтобы связать общую глубину превращения реакционных центров с молекулярной массой образовавшегося к данному моменту продукта, необходимо знать, каким продуктам принадлежат непрореагировавшие реакционные центры (концевые группы). Очевидно, что для реальных систем с большим количеством молекул это сделать довольно трудно. Поэтому для вывода уравнения, связывающего молекулярную массу (степень поликонденсации) полимера с глубиной превращения, пользуются упрощенной моделью поликонденсации (так называемая поликонденсация дубликацией или удвоением). При этом вводятся следующие упрощения:
процесса поликонденсации условно разбивается на несколько этапов;
предполагается, что на каждом этапе реагируют друг с другом лишь одинаковые (по степени поликонденсации) продукты;
23
результатом каждого этапа является получение продукта с удвоенной степенью поликонденсации (удвоение, дубликация);
образовавшиеся продукты с удвоенной степенью поликонденсации на данном этапе не реагируют, а «ждут» следующего этапа. .
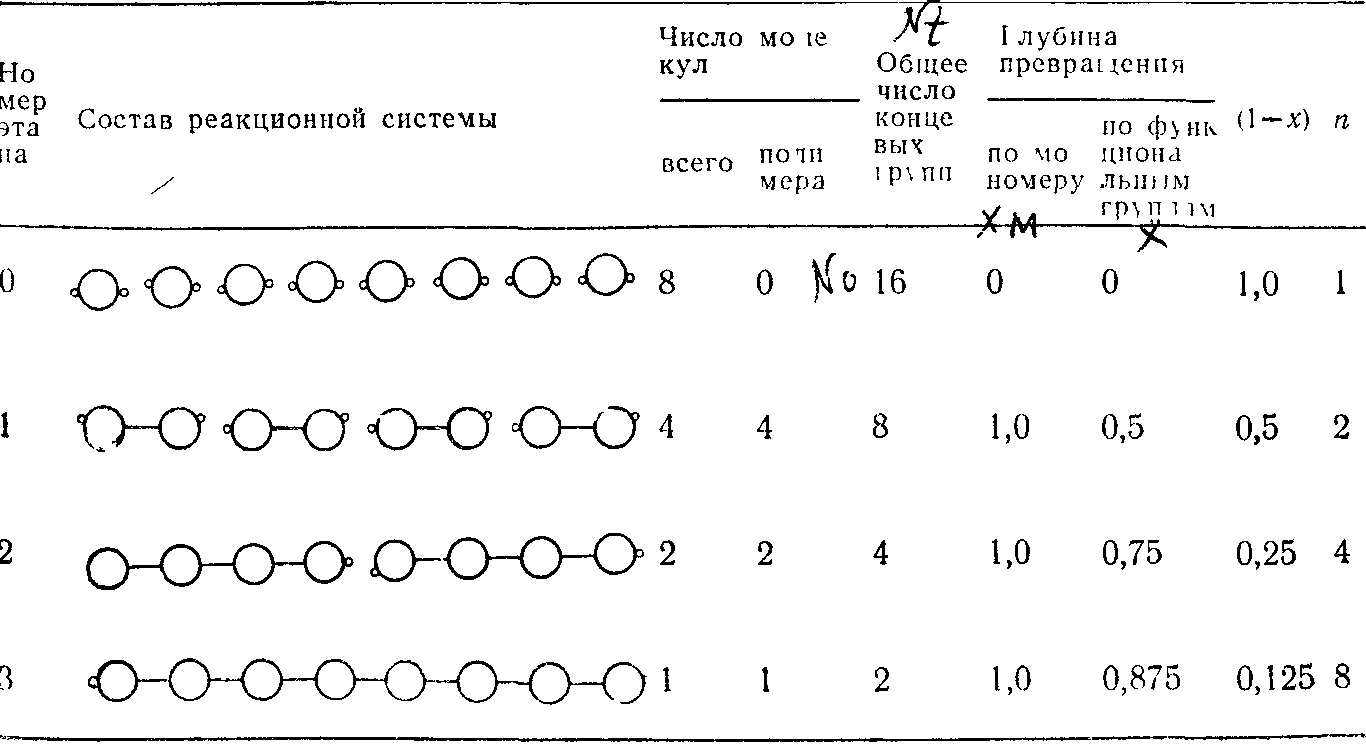
Нереальность такой модели достаточно очевидна, тем не менее на ее основе получены результаты, довольно хорошо описывающие простейшие случаи поликонденсации. Протекание процесса поликонденсации путем удвоения наглядно показано в табл. 2.1 и на рис. 2.6. На первом этапе происходит исчезновение мономера (/г==1) и образование димера (л ==2); на втором—убыль димера соответствует появлению тетрамера и т. д
Из рис. 2.6 сразу видна искусственность приема удвоения (дубликации): не учитывается образование промежуточных продуктов нечетных степеней поликонденсации и, пожалуй, самое главное, появление продуктов на предыдущих этапах; октамер (n== 8) появляется лишь на третьем этапе (на самом деле в некоторых количествах он может образоваться и на втором и даже на первом этапе). Для любого процесса образования полимера будет справедливо следующее выражение для степени поликонденсации:
![]()
Число образовавшихся линейных макромолекул равно числу концевых групп, деленному на два. Для глубины превращения более 0,5 количество концевых групп равно количеству непрореагировавших функциональных групп, т.е. No(l—х). Следовательно:
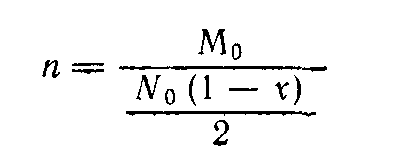
или, поскольку для бифункциональных мономеров No== 2Mo, то
n= 1/(1-x) (2.1)
Можно использовать и другую форму этого уравнения, являющуюся более удобной и рациональной:
![]() (2.2)
(2.2)
Это уравнение выводится непосредственно из данных табл. 2.1, из которых видно, что степень поликонденсации изменяется в
24
зависимости от номера этапа по закону возрастающей геометрической прогрессии со знаменателем 2, величина (1—х) зависит от номера этапа по закону убывающей прогрессии со знаменателем 1/2. Совместно решение этих уравнений дает уравнение 2.1
![]()
РИС 2 3. Зависимость
числа молекул в системе от глубины
процесса.
РИС 2.4 Зависимость
степени поликонденсации (1) и обратной
степени поликонденсации (3) от глубины
превращения.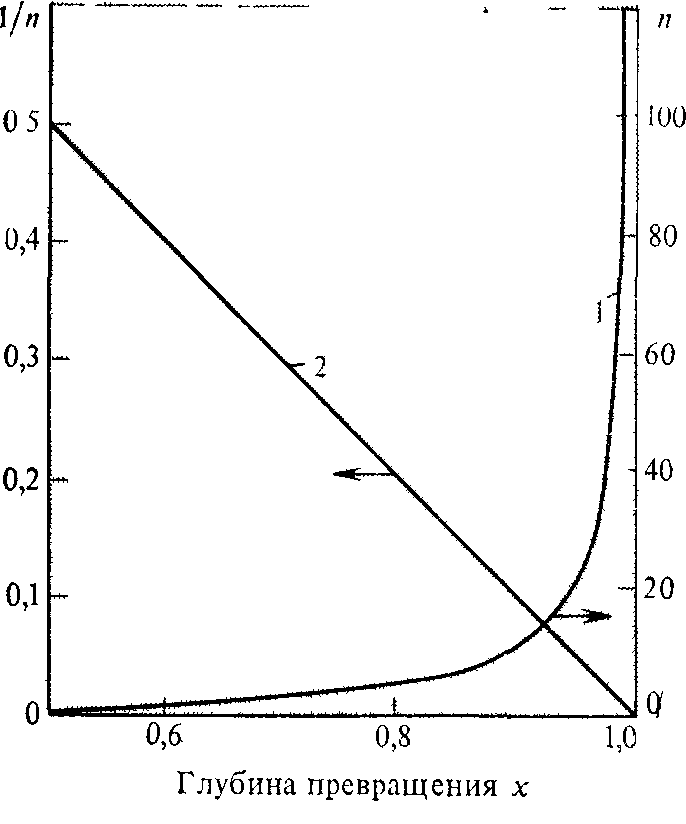
Зависимость nотx, рассчитанная по уравнениям 2.1 и 2.2 приведена на рис. 2.4. Из рисунка 2.4 видно, что для процессов поликонденсации характерно резкое возрастание степени поликонден-
25
сации полимера с увеличением глубины процесса, что было качественно получено нами ранее (см. рис.1.3).
Очень важно, что в координатах обратная степень поликонденсации—глубина превращения (1/n—х) зависимость, выражаемая уравнением (2.1), становится линейной (прямая 2 на рис. 2.4). На основе этой зависимости достаточно просто получать аналитические выражения для других закономерностей поликонденсации.
ТАБЛИЦА 2 1
Поликонденсация дубликацией (удвоением)
По поводу уравнения (2.1) следует сделать несколько пояснений. Степень поликонденсации, определяемая уравнением (2.1), вследствие вероятностного характера процесса является средней величиной, причем для начальных стадий процесса она может равняться единице. Однако уравнение (2.1) не учитывает, по каким причинам в данный момент времени (чаще всего в конце процесса) глубина поликонденсации оказалась равной х. Поскольку величина х лежит между крайними значениями (0 и 1), то данное значение х может быть как следствием развития процесса от 0 до х (определяется кинетикой), так и следствием того, что в данных условиях
26
процесс не может быть осуществлен до х == 1,0. Это может произойти по достижении термодинамического равновесия, из-за взаимодействия функциональных групп с монофункциональными соединениями, прекращения процесса, например, вследствие высокой вязкости среды и т. д.
Уравнение (2.1) пригодно для описания как поликонденсации мономеров (типов а—а и b—b), так и поликонденсации сомономеров при их эквимольных количествах в исходной смеси. На первой стадии сомономеры типа а—а взаимодействуют с образованием димера, строение которого аналогично строению мономера типа а—b, например
![]()
Дальнейшая поликонденсация сомономеров полностью аналогична поликонденсации мономеров типа а—b.
Поскольку в уравнение (2.1) не входит время, то его можно применять для многих процессов поликонденсации независимо от их скорости и других кинетических особенностей.
В уравнение (2.1) не входит содержание исходного мономера (функциональных групп), оно учитывается величиной х. При синтезе линейных полимеров глубина превращения никогда не будет равна 1,0, так как даже при образовании одной макромолекулы из всего мономера в системе останутся непрореагировавшими две функциональные группы, принадлежащие концам этой макромолекулы, т. е. предельное значение х равно:
![]()
Завершая анализ уравнения (2.1), следует вновь подчеркнуть, что метод удвоения, положенный в основу его вывода, является искусственным приемом описания поликонденсации, позволяющий, однако, учесть специфику процесса. Ценность этого приема состоит в том, что он не учитывает химическую природу процесса. Поэтому изложенные выше выводы могут быть плодотворно использованы при рассмотрении самых различных процессов поликонденсации: ионных, радикальных и т.д.
27
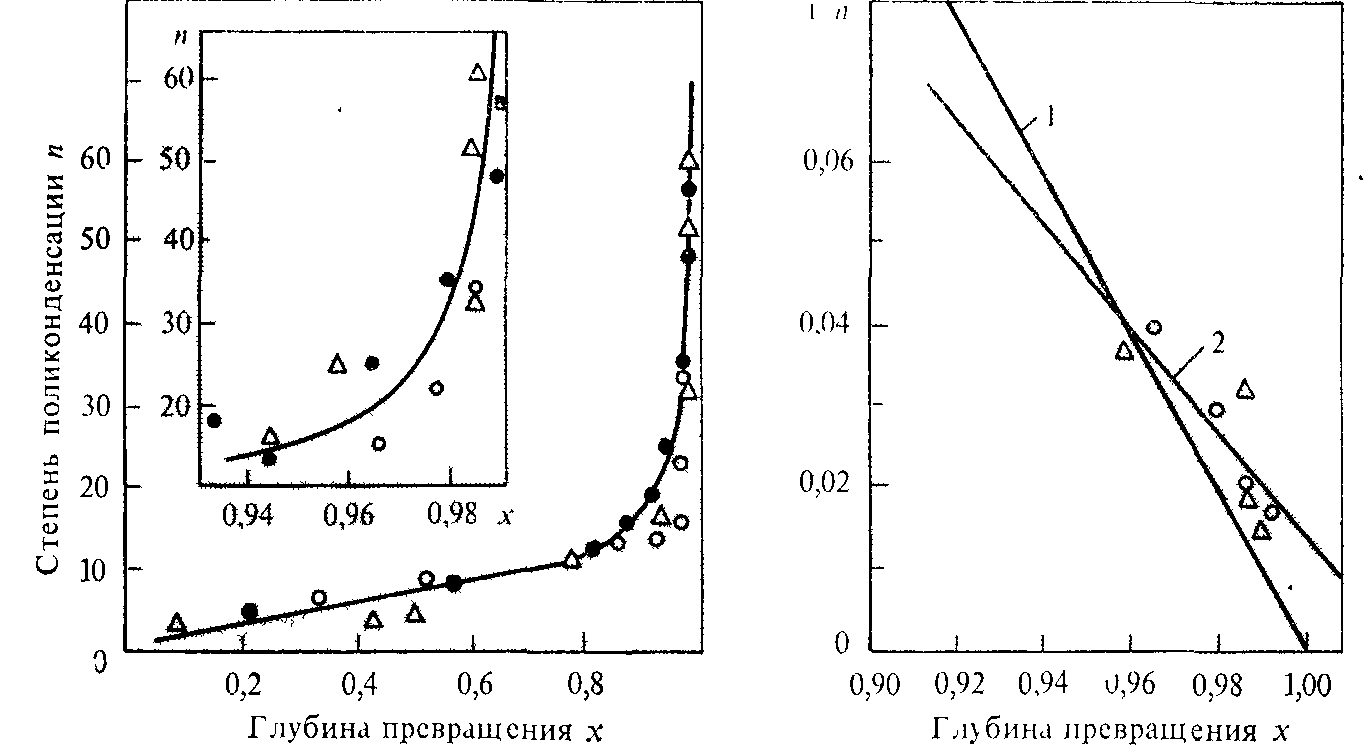
РИС. 2.5. Зависимость степени поликонденсации от глубины процесса при взаимодействии 4,4'–диoкcндифeнилпpoпaнa и дифеяилкарбоната в расплаве: —182°С;—198;—21(i°C
РИС. 2.6. Зависимость обратной степени поликонденсации от глубины превращения функциональных групп при синтезе поликарбонатов в расплаве[по G]: 1 — прямая рассчитана по уравнению (2.1); 2 —прямая рассчитана по уравнению (25) при Х,=:0,68 и С=-0,33;—182°С;—198°С (экспериментальные точки).
Несмотря на приближения, допущенные при выводе уравнения (2.1), его следует считать основным уравнением поликонденсационных процессов, так как оно верно передает самую суть процесса.
Экспериментальная зависимость nот х для процесса поликонденсации поликарбоната в расплаве приведена на рис. 2.5. Из рисунка видно, что степень поликонденсации полимера возрастает с глубиной процесса, и особенно резко при глубине, близкой к 1,0 (100%). Сравнение экспериментальных данных с данными, рассчитанными по уравнению (2.1) и (2.5), приведено на рис. 2.6. В наиболее важной области (х = 0,9—1,0) указанное уравнение до
28
статочно хорошо описывает экспериментальные данные. Отсюда вытекают важнейшие требования к проведению технологического процесса поликонденсации. В большинстве случаев бывает необходимо применять такие технологические приемы и такую аппаратуру, которые обеспечили бы протекание поликонденсации на большую глубину. Из обычных приемов следует отметить следующие: увеличение продолжительности процесса, повышение температуры процесса, обеспечение полного удаления низкомолекулярного продукта реакции, использование катализаторов, мономеров с повышенной активностью функциональных групп.
Как уравнение (2.1), так и сам метод удвоения не позволяют учитывать различия в реакционной способности мономеров, олигомеров и полимеров. Между тем это различие может вызвать существенное отклонение от статистического (вероятностного) характера процесса и привести к изменению его закономерностей.
