
- •Глава 3
- •3.2.2. Закон постоянства состава
- •3.2.3. Закон кратных отношений
- •3.2.4. Закон простых объемных отношений
- •1 Моль 1 моль 2 моль
- •3.2.5. Закон Авогадро
- •3.2.6. Закон эквивалентов (в. Рихтер, 1793 г.)
- •Эквиваленты и молярные массы эквивалентов.
- •Эквиваленты простых и сложных веществ
- •V1иV2объемы реагирующих газообразных веществ,
- •3.3.Вопросы для самоконтроля
- •3.4. Тесты для самоконтроля по теме «Эквивалент» Вариант 1
- •Вариант 2
- •1) Увеличится в 2 раза 2) уменьшится в 2 раза 3) не изменится.
- •1) 14, 2) 28, 3) 28 Г/моль, 4) 42.
- •Вариант 3
- •1) 3,0, 2) Можно определять только опытным путем, 3) 2,44.
- •3.5. Методика решения типовых задач
- •3.5.1. Вычисления по уравнениям химических реакций.
- •1 Моль кон образует 1 моль кСl,
- •4 Моль кон образуют х моль kCl,
- •3.5.2. Нормальное условие для газового состояния вещества
- •3.5.3. Закон Авогадро. Нахождение объемов газообразных веществ.
- •1 Л хлора имеет массу х г,
- •1 Г хлора занимает объем х л,
- •3.5.4. Хический эквивалент. Закон эквивалентов.
- •3.6. Вопросы и упражнения для самоподготовки
- •3.6.1. Вычисления по уравнениям реакций
- •3.6.2. Расчеты для реакций с участием газообразных веществ
- •3.7. Ответы на вопросы тестов для самоконтроля по теме «Эквивалент» Вариант 1
- •Вариант 2
- •Вариант № 3
Глава 3
Законы стехиометрии.
3.1. Разделы теоретического курса для повторения.
Стехиометрия. Важнейшие стехиометрические законы. Закон сохранения массы вещества. Закон постоянства состава. Качественный и количественный состав вещества. Закон кратных отношений. Закон простых объемных отношений. Молярные объемы газов и паров. Закон Авогадро. Число Авогадро. Относительная плотность газов. Эквивалент, молярная масса эквивалента, молярный объем эквивалента. Закон эквивалентов.
3.2. Теоретическая часть.
Стехиометрия раздел химии, в котором рассматриваются количественные, массовые или объемные отношения между реагирующими веществами.
Основу стехиометрии составляют следующие стехиометрические законы:
1) закон сохранения массы веществ,
2) закон постоянства состава,
3) закон кратных отношений,
4) закон простых объемных отношений,
5) закон Авогадро,
6) закон эквивалентов.
3.2.1. Закон сохранения массы веществ.
Закон сохранения массы веществбыл сформулирован и экспериментально подтвержден М. В. Ломоносовым в 1748 году.
В настоящее время он формулируется следующим образом:
общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, получающихся в результате реакции.
С точки зрения атомно-молекулярного учения, этот закон объясняется следующим образом: масса веществ является суммой масс составляющих их атомов. Так как при химических реакциях сами атомы не меняются и не меняется их общее количество, то сохраняется постоянной и соответствующая им общая масса.
Например:
СаO+ СО2= СаСО3
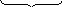 56 г 44 г 100 г
56 г 44 г 100 г
100 г
Cu(OH)2=CuO+ Н2О
98 г 80г 18г
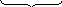 98 г
98 г
Закон сохранения массы вещества является частным случаем более общего закона природы закона сохранения материи и движения:
материя вечна, она не исчезает и не возникает из ничего, а только переходит из одной формы в другую.
Закон сохранения массы вещества служит основой для осуществления реакций между различными веществами. Исходя из него, можно производить разнообразные расчеты по уравнениям химических реакций.
3.2.2. Закон постоянства состава
Обобщив многочисленные экспериментальные данные, французский ученый Ж. Л. Пруст сформулировал в 1808 годузакон постоянства состава:
всякое чистое вещество молекулярной структуры, независимо от способов его получения, имеет постоянный качественный и количественный состав.
В настоящее время известен целый ряд веществ, например оксидов, сульфидов, нитридов (соединений металлов с азотом), карбидов (соединений металлов с углеродом), силицидов (соединений металлов с кремнием) и других кристаллических неорганических соединений, которые имеют немолекулярную структуру, их состав зависит от условий получения. Так, оксид титана (II) в действительности имеет состав от ТiO0,7до ТiO1,3. Такого типа вещества немолекулярной структуры закону постоянства состава не подчиняются.
3.2.3. Закон кратных отношений
В 1803 году английский ученый Джон Дальтон установил закон кратных отношений:
если два элемента образуют друг с другом несколько химических соединений, массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Способность элементов вступать в соединения лишь определенными порциями свидетельствует о дискретном строении вещества. Например, азот и кислород дают 5 оксидов:
N2O,NO,N2O3,NO2,N2O5.
Количества кислорода в них, приходящиеся на одно и то же количество азота, относятся как целые числа –
1 : 2 : 3 : 4 : 5.
Это объясняется тем, что одинаковое количество атомов азота в молекулах разных оксидов связано с различным числом атомов кислорода.
