
- •Предисловие
- •Часть первая общие свойства пиротехнических составов и их компонентов
- •Глава I
- •Общее понятие о пиротехнических средствах и составах
- •§ 1.Классификация
- •§ 2.Горение составов
- •§ 3. Требования, предъявляемые к пиротехническим средствам и составам
- •§ 4. Назначение компонентов
- •§5. Возможные высокоэкзотермические реакции
- •§ 6. Способность к горению различных веществ и смесей
- •Глава II окислители
- •§ 1. Выбор окислителей
- •§ 2. Свойства окислителей
- •§ 3. Гигроскопичность
- •§ 4. Технические требования
- •Глава III горючие
- •§ 1.Выбор и классификация
- •§ 2. Высококалорийные горючие
- •Количество тепла в ккал, выделяющееся при сгорании 1 см3 некоторых горючих (q4)
- •§ 3. Технические требования к порошкам металлов
- •§ 4. Производство порошков металлов
- •§ 5. Неорганические горючие средней калорийности
- •§ 6. Органические горючие
- •Глава IV связующие - органические полимеры
- •§ 1. Роль связующих. Испытание прочности звездок
- •§ 2. Факторы, влияющие на прочность
- •Зависимость прочности изделия от давления прессования (испытывались высоты)шашки диаметром 20 мм и такой же высоты)
- •§ 3. Классификация связующих их свойства
- •Некоторые свойства органических горючих веществ
- •Глава V принципы расчета пиротехнических составов
- •§ 1. Двойные смеси
- •§2. Тройные и многокомпонентные смеси
- •§ 3. Составы с отрицательным кислородным балансом
- •§ 4. Металлохлоридные составы
- •§ 5. Составы с фторным балансом
- •Глава VI теплота горения, газообразные продукты и температура горения составов
- •§ 1. Вычисление теплоты горения
- •Теплота горения пиротехнических составов (без учета догорания за счет кислорода воздуха)
- •§ 2. Экспериментальное определение
- •§ 3. Связь между назначением составов и теплотой их горения
- •§ 4. Газообразные продукты горения
- •§ 5. Определение температуры горения
- •§ 6. Экспериментальное определение
- •Tипы оптических пирометров
- •§ 7. Связь между назначением состава и температурой горения
- •Глава VII чувствительность составов
- •§ 1. Определение чувствительности к тепловым воздействиям
- •Определение чувствительности к лучу огня
- •Дополнительные испытания
- •§ 2. Определение чувствительности к механическим воздействиям
- •Определение чувствительности к удару
- •§ 3. Факторы, влияющие на чувствительность составов к начальному импульсу
- •Глава VIII горение составов
- •§ 1. Механизм горения
- •§ 2. Факторы, влияющие на скорость горения
- •Каталитические добавки
- •Физические факторы
- •Глава IX взрывчатые свойства составов
- •Взрывчатые свойства двойных смесей:
- •Расширение в блоке Трауцля в см3 в зависимости от начального импульса; количество состава 20 г
- •Глава X физическая и химическая стойкость составов
- •§ 1. Физические изменения
- •§ 2. Химические изменения
- •Составы, содержащие порошки магния или алюминия и неорганические окислители
- •Составы, не содержащие порошков металлов
- •§ 3. Методы определения гигроскопичности и химической стойкости
- •§ 4. Допустимые сроки хранения
- •Специальные свойства отдельных видов пиротехнических составов
- •Глава XI осветительные составы
- •§ 1. Осветительные составы и средства
- •Классификация осветительных средств и составов
- •§ 2. Краткие сведения об устройстве осветительных средств Средства артиллерии
- •Основные характеристики американских саб (скорость снижения факелов 2,5—3,0 м/с)
- •Общевойсковые средства
- •§ 3. Световые характеристики осветительных составов и средств
- •§ 4. Тепловое и люминесцентное излучение
- •§ 5. Специальные требования к осветителным составам; двойные смеси
- •Термохимические характеристики двойных смесей
- •Световые показатели двойных смесей с различными окислителями (диаметр звездок 24 мм, оболочка картонная)
- •Светотехнические характеристики двойных смесей нитрата бария с алюминиевой пудрой
- •§ 6. Многокомпонентные осветительные составы
- •Самоотвёрждающиеся составы
- •Самоотвёрждающиеся составы на основе полимерных горючих-связующих (патенты сша 3.369.964, 1968; 3.462.325, 1969; 2.984.558, 1961)
- •§ 7. Факторы, влияющие на эффективность осветительных составов и средств
- •§ 8. Краткие сведения о пиротехнических ик-излучателях
- •Характеристики пиротехнических ик-излучателей
- •Энергетические характеристики пиротехнических источников ик-излучения
- •Энергетические величины и единицы
- •§ 9. Фотометрирование и радиометрирование пламен пиротехнических составов
- •Глава XII фотоосветительные составы
- •§ 1. Ночное воздушное фотографирование
- •§ 2. Фотоматериалы
- •§ 3. Фотоавиабомбы
- •§ 4. Фото патроны
- •Основные характеристики фотоосветительных патронов
- •§ 5. Фотосоставы. Факторы, влияющие на светотехнические характеристики вспышек и свойства фотосоставов
- •Светотехнические характеристики фотосмесей, содержащих кс104 и металлические горючие в стехиометрических соотношениях (ст) и с перегрузкой горючим (п) в количестве h'/ol против стехиометрии [119]
- •§ 6. Методы определения характеристик фотовспышек
- •§ 7. Световые имитаторы, фотозаряды-маркеры
- •Глава XIII трассирующие составы
- •§ 1. Трассирующие средства
- •Назначение трассеров и требования к ним
- •Классификация трассирующих средств
- •§ 2. Краткие сведения об устройстве трассеров Трассирующие пули
- •Артиллерийские снаряды
- •Снаряды с самоликвидацией через трассер
- •Трассеры к управляемым реактивным снарядам (pc) и авиабомбам. Специальные виды трассеров
- •§ 3. Трассирующие составы
- •§ 4. Воспламенительные составы для трассеров
- •§ 5. Факторы, влияющие на эффективность трассирующих составов и трассеров
- •§ 6. Видимость трассы и расчет необходимой силы света пламени
- •§ 7. Испытания трассеров
- •Глава XIV составы сигнальных огней
- •§ 1. Системы сигнализации. Требования, предъявляемые к составам
- •§ 2. Характер излучения пламени
- •§ 3.Разработка рецептов составов и основные требования к их компонентам
- •§ 4. Составы желтого огня
- •§ 5. Составы красного огня
- •§ 6. Составы зеленого огня
- •§ 7. Составы синего и белого огня
- •§ 8. Методы испытания
- •Глава XV зажигательные составы
- •§ 1. Зажигательные средства и зажигательные составы. Основные требования к составам
- •§ 2. Классификация зажигательных средств и составов Зажигательные средства
- •Зажигательные составы
- •§ 3. Составы с порошками металлов и окислителями — солями и применение их в малокалиберных снарядах
- •Воспламенение и горение жидких топлив
- •§ 4. Термитно-зажигательные составы
- •§ 5. Сплав «электрон» и его применение
- •§ 6. Смеси на основе нефтепродуктов напалм
- •§ 7. Фосфор и его соединения
- •§ 8. Галоидные соединения фтора
- •§ 9. Прочие зажигательные вещества и смеси
- •§ 10. Методы испытания зажигательных составов
- •Глава XVI составы маскирующих дымов
- •§ 1. Общие сведения об аэрозолях
- •§ 2. Способы получения аэрозолей.
- •§ 3. Составы маскирующих дымов и предъявляемые к ним требования
- •Глава XVII составы цветных дымов
- •§ 1. Цветные облака и способы их получения
- •§ 2.Красители
- •§ 3. Составы цветных дымов
- •Глава XVIII твердые пиротехнические топлива
- •§ 1. Классификация и энергетические характеристики
- •§ 2. Эксплуатационные требования
- •§ 3. Окислители
- •§ 4. Органические и металлические горючие
- •Глава XIX безгазовые составы
- •Глава XX воспламенительные составы. Газогенераторные составы. Прочие виды составов
- •§ 1. Воспламенительные составы и предъявляемые к ним требования
- •§ 2. Воспламенительные составыдля ракетных двигателей
- •§ 3. Газогенераторные составы
- •Высокоазотные газогенераторные составы по данным [117] в процентах
- •§ 4. Прочие виды составов
- •Глава XXI применение пиротехнических составов в народном хозяйстве
- •§ 1. Составы для получения химикатов
- •§ 2. Использование энергии пиротехнических составов
- •§ 3. Спичечные составы
- •§ 4. Фейерверочные составы
- •Глава XXII основы технологии и оборудование пиротехнического производства
- •§ 1. Подготовка компонентов
- •Техническая характеристика шкафа
- •§ 2. Приготовление составов
- •§ 3.Уплотнение составов
- •§ 4. Снаряжение и сборка изделий
- •Приложения
- •Список литературы
- •Оглавление
Количество тепла в ккал, выделяющееся при сгорании 1 см3 некоторых горючих (q4)
|
Символ |
Q4 |
Символ |
Q4 |
Символ |
Q4 |
Символ |
Q4 |
|
Be |
29 |
Zr |
18 |
Nb |
21 |
Та |
23 |
|
Al |
20 |
B |
33 |
Мо |
19 |
Zn |
9 |
|
Mg |
10 |
Si |
18 |
Fe |
14 |
W |
21 |
|
Ca |
6 |
P белый |
11 |
Mn |
12 |
Ni |
9 |
|
Ti |
20 |
|
|
Се |
11 |
|
|
Примечание. 1 ккал=4,186 кДж.
По объемной калорийности первое место занимает бор (при расчете использована плотность 2,3 г/см3), а тяжелые металлы Zr,Nb, Мо, Та и W имеют объемную калорийность, сравнимую с алюминием и значительно большую, чем у магния.
Объемная калорийность смесей горючее — окислитель, конечно, гораздо меньше, чем объемная калорийность горючих в отдельности. Из всех стехиометрических смесей наибольшую калорийность имеет смесь Be—LiC104 (см. приложение 3).
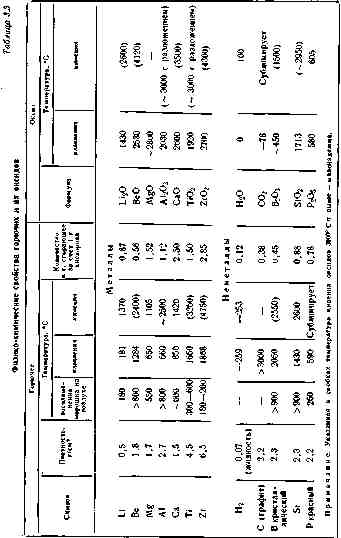
В табл. 3.3 приведены физико-химические свойства горючих и их оксидов.
Температура воспламенения порошков металлов в очень большой степени зависит от размеров и формы частиц, а также качества покрывающей эти частицы оксидной пленки. Чем выше дисперсность порошка металла, тем ниже температура воспламенения.
Так, температура воспламенения порошка титана может варьировать в пределах 300-600° С, а некоторые образчики мелкодисперсного порошка циркония могут воспламеняться при комнатной температуре.
Увлажненный порошок циркония горит интенсивнее, чем сухой (система 2Н2О+Zr способна к горению и взрыву), а тушение горящего циркония допустимо только засыпкой порошкообразными СаF2 или СаО, так как Н20, ССl2, СО2 и даже СаСОз энергично реагируют с цирконием.
Известно, что при работе с тонкодисперсным порошком циркония (2-5 мкм) имели место несчастные случаи.
Отмечено, что температура воспламенения тонкодисперсного порошка циркония около 85° С. Он перевозится и, поскольку возможно, обрабатывается под водой.
Грубые фракции Zr-порошков имеют температуру воспламенения порядка 180—200° С.
Zr-порошок с размером частиц 10 мкм и более расценивается как малоопасный в обращении.
Наибольшего количества кислорода для окисления требуют водород и затем углерод при сгорании в СО2 (см. табл. 3.3). Отсюда следует, что составы, горючими в которых являются органические вещества, должны содержать в себе много окислителя и соответственно мало горючего.
Одним из основных факторов, определяющих химическую устойчивость металлов, является их стандартный электродный потенциал. Эти данные указаны в табл. 2.4.
Возможность окисления металлов газообразным кислородом при наличии трудноиспаряющегося оксида определяется качеством покрывающей металл оксидной пленки.
Согласно общеизвестному правилу Пиллинга и Бэдворса, если объем образующегося оксида меньше объема замещаемого им металла, то пленка оксида имеет рыхлую, ячеистую структуру и не может надежно защитить металл от дальнейшего окисления.
Если же отношение объема оксида к объему металла больше единицы, то образующаяся пленка имеет компактную, сплошную структуру, надежно изолирует металл от воздействия газообразного кислорода и, следовательно, препятствует дальнейшему окислению металла.
Коэффициент а Пиллинга и Бэдворса (см. табл. 3.4) вычисляется по формуле
MokDme
------------------
DokAmen...............=a
где Mok и Dok—молекулярный вес и плотность оксида;
Ame и Dme— атомный вес и плотность металла;
п —число атомов металла в формуле оксида.
Таблица 3.4 Отношение объема оксида к объему металла (а)
|
Na |
0,55 |
А1 |
1,45 |
Си |
1,70 |
|
К |
0,45 |
Pb |
1,31 |
Ti |
1,73 |
|
Li |
0,58 |
Cd |
1,32 |
Fe |
2,06 |
|
Sr |
0,69 |
Sn |
1,33 |
Mn |
2,07 |
|
Ва |
0,78 |
Zr |
1,45 |
Co |
2,10 |
|
Са |
0,64 |
Zn |
1,59 |
Cr |
3,92 |
|
Mg |
0,81 |
Ni |
1,68 |
Si |
2,04 |
Как видно из табл. 3.4, для легких металлов: щелочных, щелочноземельных и магния а<1, для тяжелых металлов и алюминия а>1.
Значение а определяет поведение металлов при высокотемпературной коррозии: если а<1, то металл легко и быстро коррозирует.
Именно малое значение а для магния является одной из причин, определяющих большую скорость горения магниевых составов.
Вместе с тем известно, что при очень больших значениях а оксидный слой получает значительные внутренние напряжения, растрескивается и теряет защитные свойства, поэтому наибольшими защитными свойствами обладают оксидные пленки, для которых а не очень значительно превышает 1.
Наиболее важны для пиротехников свойства двух металлов: магния и алюминия.
Магний. Теплота плавления и кипения его равны соответственно 2,1 и 30,5 ккал (8,8 и 128 кДж) г-атом (температуру плавления и кипения см. в табл. 3.3). Атомная теплоемкость для твердого и жидкого магния меняется с изменением температуры в пределах от 5,9 до 8,1 кал/г-атом (от 24 до 34 Дж/г-атом). Теплопроводность при 20° С 0,37 кал/(см-с-град) 1,55 Дж/(смХ Хс-гоал). Давление насыщенного паша в мм DT- сг- 1 ппи
662°'С, 20 при 750° С, 100 при 909° С (соответственно 130, 2600 и 13000Н/М2).
Химически магний весьма активен, но примерно до 350° С от окисления его в известной мере защищает оксидная пленка. При нагревании до более высокой температуры окисление магния ускоряется. Магний в виде крупных кусков и пластинок воспламеняется на воздухе при 600—650° С, порошкообразный — при температуре около 550C.При сгорании на воздухе магний образует оксид магния MgO и частично нитрид Mg3N2.
Известно, что добавление к воздуху 1 % по объему SiF4или ВFз достаточно, чтобы потушить пламя горящего магния.
Оксид магния (MgO) — легкий белый порошок (плотность 3,6 г/см3); сильно прокаленный оксид магния теряет способность соединяться с водой и растворяться в кислотах.
Летучесть MgO заметна при температуре около 2000° С; температура его плавления — около 2800° С. Большинство приводимых в литературе значений для температуры кипения MgO лежит в пределах 3000—3600° С. Следует полагать, что температура кипения MgO 'во всяком случае не ниже, чем 3100° С.. Скрытая теплота сублимации MgO оценивается величиной 150ккал/моль (627 кДж/моль).
Нитрид магния Mg3N2 — твердое вещество серо-зеленого цвета, легко разлагаемое водой: соединение магния с азотом сопровождается значительно меньшим выделением тепла, чем соединение его с кислородом.
Алюминий. Теплота плавления и кипения его равны соответственно 2,5 и 69,6 ккал/г-атом (10,5 и 293 кДж/г-атом). Атомная теплоемкость изменяется с .изменением температуры от 0 до 1000° в пределах от 6,0 до 7,4 ккал/(г-атом-град) или от 25,1 до 30,9 Дж/(г-атом-град). Давление жара в мм рт. ст. (в скобках Н/м2): 2-Ю-5 (0,003) при 660° С; 1 (130) при 1284° С; 20 (2600) при 1555° С и 100 (13000) при 1749° С. Теплопроводность при 20° С—0,52 кал/(см-с-град), или 2,17 Дж/(см-с-град).
Алюминий химически активен, но в обычных условиях (в том числе и в порошкообразном состоянии) окислению его препятствует тонкая, но прочная оксидная пленка. При накаливании порошкообразный алюминий энергично сгорает на воздухе. При температуре красного каления он активно соединяется с серой, образуя AlaSs. При 800° С алюминий соединяется с азотом, образуя нитрид A1N - белые кристаллы с температурой плавления 2200° С (при давлении азота 0,4 МН/м2).
В своих соединениях алюминий трехвалентен, но при высоких температурах существуют соединения и одновалентного алюминия.
Оксид алюминия - белый порошок, имеющий плотность: корунд (а-А12О3) 3,96, глинозем (у-Аl2О3) 3,42 г/см3. Зависимость молярной теплоемкости в.интервале 100-1400° С от температуры для А120з выражается формулой: Ср = 23,9 + 0,0067t.
Температура плавления Al2O3 2050° С. При высокой температуре (выше 2000° С) Аl2Oз в значительной степени диссоциирует с отщеплением кислорода, образуя низшие окислы — А1O, и в восстановительной атмосфере Аl2О, так что указываемая в справочниках температура кипения Аl2Оз является весьма условной.
Сплавы металлов. Из них следует особо указать на магниевоалюминиевые сплавы на рис. 3. 2.
Интерметаллическое соединение Mg4Al3 (54 вес. % магния) имеет теплоту образования + 49 ккал/моль (205 кДж/моль); плотность его 2,15, температура плавления 463°С. Этот сплав выгодно отличается от соответствующих смесей магния с алюминием меньшей способностью к коррозии.

Рис. 3.2. Диаграмма состояния сплавов магний — алюминий обладает большой хрупкостью, что дает возможность легко осуществить процесс его измельчения.
В США для снаряжения фотобомб используется сплав Mg— А1 70/30,
Сплавы магния с алюминием, содержащие 85—90 % магния, получили название «электрон».
