
- •Предисловие
- •Часть первая общие свойства пиротехнических составов и их компонентов
- •Глава I
- •Общее понятие о пиротехнических средствах и составах
- •§ 1.Классификация
- •§ 2.Горение составов
- •§ 3. Требования, предъявляемые к пиротехническим средствам и составам
- •§ 4. Назначение компонентов
- •§5. Возможные высокоэкзотермические реакции
- •§ 6. Способность к горению различных веществ и смесей
- •Глава II окислители
- •§ 1. Выбор окислителей
- •§ 2. Свойства окислителей
- •§ 3. Гигроскопичность
- •§ 4. Технические требования
- •Глава III горючие
- •§ 1.Выбор и классификация
- •§ 2. Высококалорийные горючие
- •Количество тепла в ккал, выделяющееся при сгорании 1 см3 некоторых горючих (q4)
- •§ 3. Технические требования к порошкам металлов
- •§ 4. Производство порошков металлов
- •§ 5. Неорганические горючие средней калорийности
- •§ 6. Органические горючие
- •Глава IV связующие - органические полимеры
- •§ 1. Роль связующих. Испытание прочности звездок
- •§ 2. Факторы, влияющие на прочность
- •Зависимость прочности изделия от давления прессования (испытывались высоты)шашки диаметром 20 мм и такой же высоты)
- •§ 3. Классификация связующих их свойства
- •Некоторые свойства органических горючих веществ
- •Глава V принципы расчета пиротехнических составов
- •§ 1. Двойные смеси
- •§2. Тройные и многокомпонентные смеси
- •§ 3. Составы с отрицательным кислородным балансом
- •§ 4. Металлохлоридные составы
- •§ 5. Составы с фторным балансом
- •Глава VI теплота горения, газообразные продукты и температура горения составов
- •§ 1. Вычисление теплоты горения
- •Теплота горения пиротехнических составов (без учета догорания за счет кислорода воздуха)
- •§ 2. Экспериментальное определение
- •§ 3. Связь между назначением составов и теплотой их горения
- •§ 4. Газообразные продукты горения
- •§ 5. Определение температуры горения
- •§ 6. Экспериментальное определение
- •Tипы оптических пирометров
- •§ 7. Связь между назначением состава и температурой горения
- •Глава VII чувствительность составов
- •§ 1. Определение чувствительности к тепловым воздействиям
- •Определение чувствительности к лучу огня
- •Дополнительные испытания
- •§ 2. Определение чувствительности к механическим воздействиям
- •Определение чувствительности к удару
- •§ 3. Факторы, влияющие на чувствительность составов к начальному импульсу
- •Глава VIII горение составов
- •§ 1. Механизм горения
- •§ 2. Факторы, влияющие на скорость горения
- •Каталитические добавки
- •Физические факторы
- •Глава IX взрывчатые свойства составов
- •Взрывчатые свойства двойных смесей:
- •Расширение в блоке Трауцля в см3 в зависимости от начального импульса; количество состава 20 г
- •Глава X физическая и химическая стойкость составов
- •§ 1. Физические изменения
- •§ 2. Химические изменения
- •Составы, содержащие порошки магния или алюминия и неорганические окислители
- •Составы, не содержащие порошков металлов
- •§ 3. Методы определения гигроскопичности и химической стойкости
- •§ 4. Допустимые сроки хранения
- •Специальные свойства отдельных видов пиротехнических составов
- •Глава XI осветительные составы
- •§ 1. Осветительные составы и средства
- •Классификация осветительных средств и составов
- •§ 2. Краткие сведения об устройстве осветительных средств Средства артиллерии
- •Основные характеристики американских саб (скорость снижения факелов 2,5—3,0 м/с)
- •Общевойсковые средства
- •§ 3. Световые характеристики осветительных составов и средств
- •§ 4. Тепловое и люминесцентное излучение
- •§ 5. Специальные требования к осветителным составам; двойные смеси
- •Термохимические характеристики двойных смесей
- •Световые показатели двойных смесей с различными окислителями (диаметр звездок 24 мм, оболочка картонная)
- •Светотехнические характеристики двойных смесей нитрата бария с алюминиевой пудрой
- •§ 6. Многокомпонентные осветительные составы
- •Самоотвёрждающиеся составы
- •Самоотвёрждающиеся составы на основе полимерных горючих-связующих (патенты сша 3.369.964, 1968; 3.462.325, 1969; 2.984.558, 1961)
- •§ 7. Факторы, влияющие на эффективность осветительных составов и средств
- •§ 8. Краткие сведения о пиротехнических ик-излучателях
- •Характеристики пиротехнических ик-излучателей
- •Энергетические характеристики пиротехнических источников ик-излучения
- •Энергетические величины и единицы
- •§ 9. Фотометрирование и радиометрирование пламен пиротехнических составов
- •Глава XII фотоосветительные составы
- •§ 1. Ночное воздушное фотографирование
- •§ 2. Фотоматериалы
- •§ 3. Фотоавиабомбы
- •§ 4. Фото патроны
- •Основные характеристики фотоосветительных патронов
- •§ 5. Фотосоставы. Факторы, влияющие на светотехнические характеристики вспышек и свойства фотосоставов
- •Светотехнические характеристики фотосмесей, содержащих кс104 и металлические горючие в стехиометрических соотношениях (ст) и с перегрузкой горючим (п) в количестве h'/ol против стехиометрии [119]
- •§ 6. Методы определения характеристик фотовспышек
- •§ 7. Световые имитаторы, фотозаряды-маркеры
- •Глава XIII трассирующие составы
- •§ 1. Трассирующие средства
- •Назначение трассеров и требования к ним
- •Классификация трассирующих средств
- •§ 2. Краткие сведения об устройстве трассеров Трассирующие пули
- •Артиллерийские снаряды
- •Снаряды с самоликвидацией через трассер
- •Трассеры к управляемым реактивным снарядам (pc) и авиабомбам. Специальные виды трассеров
- •§ 3. Трассирующие составы
- •§ 4. Воспламенительные составы для трассеров
- •§ 5. Факторы, влияющие на эффективность трассирующих составов и трассеров
- •§ 6. Видимость трассы и расчет необходимой силы света пламени
- •§ 7. Испытания трассеров
- •Глава XIV составы сигнальных огней
- •§ 1. Системы сигнализации. Требования, предъявляемые к составам
- •§ 2. Характер излучения пламени
- •§ 3.Разработка рецептов составов и основные требования к их компонентам
- •§ 4. Составы желтого огня
- •§ 5. Составы красного огня
- •§ 6. Составы зеленого огня
- •§ 7. Составы синего и белого огня
- •§ 8. Методы испытания
- •Глава XV зажигательные составы
- •§ 1. Зажигательные средства и зажигательные составы. Основные требования к составам
- •§ 2. Классификация зажигательных средств и составов Зажигательные средства
- •Зажигательные составы
- •§ 3. Составы с порошками металлов и окислителями — солями и применение их в малокалиберных снарядах
- •Воспламенение и горение жидких топлив
- •§ 4. Термитно-зажигательные составы
- •§ 5. Сплав «электрон» и его применение
- •§ 6. Смеси на основе нефтепродуктов напалм
- •§ 7. Фосфор и его соединения
- •§ 8. Галоидные соединения фтора
- •§ 9. Прочие зажигательные вещества и смеси
- •§ 10. Методы испытания зажигательных составов
- •Глава XVI составы маскирующих дымов
- •§ 1. Общие сведения об аэрозолях
- •§ 2. Способы получения аэрозолей.
- •§ 3. Составы маскирующих дымов и предъявляемые к ним требования
- •Глава XVII составы цветных дымов
- •§ 1. Цветные облака и способы их получения
- •§ 2.Красители
- •§ 3. Составы цветных дымов
- •Глава XVIII твердые пиротехнические топлива
- •§ 1. Классификация и энергетические характеристики
- •§ 2. Эксплуатационные требования
- •§ 3. Окислители
- •§ 4. Органические и металлические горючие
- •Глава XIX безгазовые составы
- •Глава XX воспламенительные составы. Газогенераторные составы. Прочие виды составов
- •§ 1. Воспламенительные составы и предъявляемые к ним требования
- •§ 2. Воспламенительные составыдля ракетных двигателей
- •§ 3. Газогенераторные составы
- •Высокоазотные газогенераторные составы по данным [117] в процентах
- •§ 4. Прочие виды составов
- •Глава XXI применение пиротехнических составов в народном хозяйстве
- •§ 1. Составы для получения химикатов
- •§ 2. Использование энергии пиротехнических составов
- •§ 3. Спичечные составы
- •§ 4. Фейерверочные составы
- •Глава XXII основы технологии и оборудование пиротехнического производства
- •§ 1. Подготовка компонентов
- •Техническая характеристика шкафа
- •§ 2. Приготовление составов
- •§ 3.Уплотнение составов
- •§ 4. Снаряжение и сборка изделий
- •Приложения
- •Список литературы
- •Оглавление
§ 3. Окислители
Выбором окислителя в большой степени определяются свойства топлива. В качестве окислителей используют вещества, дающие в смеси с горючими высококалорийные амеси, при горении которых образуются газы с малым молекулярным весом. Кроме того, в них должно содержаться большое количество кислорода, чтобы содержание окислителя в топливе было минимальным. Для твердых пиротехнических топлив находят практическое применение нитраты и перхлораты калия, натрия, лития и аммония. Некоторые свойства этих окислителей приведены в табл. 18.3.
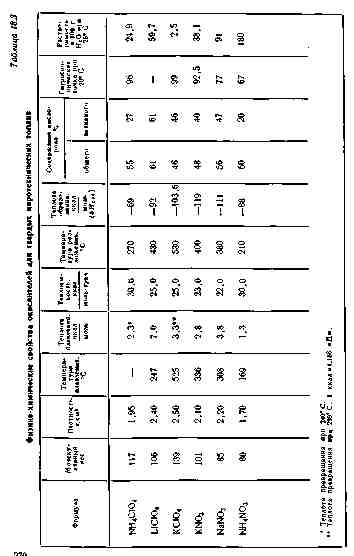
Высокое содержание свободного кислорода и высокая плотность окислителя осоиенно важны для литьевых топлив, так как позволяют ввести в топливо больше органического связующего и обеспечить хорошую технологичность.
Наиболее дешевым и изготовляемым в массовых масштабах является нитрат аммония. При разложении нитрата аммония в зависимости от условий, в которых протекает этот процесс, могут получаться различные продукты реакции. Ниже приводятся только два из многих возможных уравнений разложения нитрата аммония:
0,5NO2+2H2O+0,75N2+23ккал
NH4N02=
N2+2H2O+0,5O2+27 ккал
Экспериментально установлена способность к горению NН4гNOз при повышенном давлении, а при наличии катализатора — и при атмосферном давлении.
Установлено, что на термическое разложение нитрата аммония сильное каталитическое воздействие оказывают соединения хрома (VI): хромат калия или бихромат аммония, а также трехокись хрома; в меньшей степени влияет хлорид меди (II). Горение нитрата аммония с каталитическими добавками изучалось Тэйлором, а также автором книги [98]. Соединения хрома, сильно увеличивающие при 200° С скорость термического разложения МН4NОз, при добавке их в количестве 5—10% к нитрату аммония делают его способным к горению при нормальных условиях. Нитрат аммония при комнатной температуре не чувствителен к трению в фарфоровой ступке и мало чувствителен к удару. Взрыв в нем возбуждается трудно, температура взрыва около 1000 С;
скорость детонации от 10ОО до 1500 м/с.
Все проверенные твердые топлива с нитратом аммония не дают достаточно высокого значения удельной тяги. Поэтому ему обычно предпочитают .более дорогой и более опасный в обращении перхлорат аммония. Однако топлива на нитрате, аммония имеют низкую температуру горения, что дает возможность использовать их в газогенераторах.
Свойства перхлората аммония описаны в монографии , а также в [133].
Как индивидуальное вещество перхлорат аммония обладает взрывчатыми свойствами: температура взрыва около 1200° С, скорость детзнадии колеблется в пределах 2500—3500 м/с [32]. Термическое разложение NH4C1O4 с различными каталитическими добавками изучалось во многих работах [133; 99].
Приближенно термическое разложение перхлората аммония можно выразить уравнением
10NHClO4=60,+4N20+2NOCl+2Cl2+HCl0,+ +ЗНС1+18Н20пар,
причем тепла выделяется 256 ккал/кг (1080 кДж/кг).
Сильно ускоряют термическое разложение NH4C104 соединения меди (окислы и хлориды), а также двуокись марганца.
Скорость горения топлив на основе перхлората аммония составляет 0,4—2 см/с (при р=70бар). Эти топлива имеют невысокий показатель степени v в уравнениии=Ар-и отличаются сравнительно низким температурным коэффициентом скорости горения.
Разложение таких окислителей как перхлораты лития и калия является .весьма слабоэкзотермическим процессом.
Суммарные реакции их разложения могут быть выражены уравнениями
LiClO4=LiCl+2O2+5,9 ккал (24,6 кДж),
КСlO4 = КСl+2O2+0,6 ккал (2,5 кДж).
Скорость последней реакции возрастает в присутствии гало-генидов калия в порядке
KCl<KBr<KJ.
При разложении окислителей КС104 и LiC104 образуются хлориды, представляющие собой сравнительно высококипящие соединения.
Топлива на основе КС104 имеют довольно низкий удельный импульс (180—220 с). Хотя эти топлива имеют высокую плотность (1,7—2 г/см3) и высокую скорость горения от 3 до 6 .мм/с (при р=70бар), горение их при да.влениях ниже 70 кгс/см2 неустойчиво.
В качестве окислителей для ТРТ предлагались также перхлорат нитрония NO3C104 и нитрозил перхлорат но эти соединения слишком гигроскопичны и при наличии влаги гидроли-зуются с образованием свободных кислот.
