
- •Теоретические основы гетерогенного катализа
- •Элементарные стадии в гетерогенном катализе.
- •Кинетика и механизмы гетерогенно-каталитических реакций.
- •Значение адсорбции в гетерогенном катализе.
- •Кинетическое описание гетерогенно-каталитических реакций.
- •Механизмы гетерогенно-каталитических газофазных реакций. Связь механизма реакции с кинетикой.
- •Основные структуры хемосорбированных частиц.
- •Основные концепции теории гетерогенного катализа.
- •Классификация гетерогенных катализаторов.
- •Энергетический подход и каталитическая активность.
- •Стерический фактор и каталитическая активность.
-
Кинетическое описание гетерогенно-каталитических реакций.
Кинетическое описание процесса необходимо для расчета химического реактора.
В гетерогенно-каталитических процессах скорость реакции чаще всего выражают, как изменение количества вещества в единицу времени отнесенное к единице массы катализатора (m, кг.):
r = - (1/m)(dnA/d) = k.f(Ci), (моль/кг.с) (5.19)
Конкретный вид правой части кинетического уравнения (5.19) зависит от механизма реакции и области протекания процесса.
-
Механизмы гетерогенно-каталитических газофазных реакций. Связь механизма реакции с кинетикой.
Рассмотрим два наиболее распространенных механизма, применяемых для описания гетерогенно-каталитических газофазных реакций протекающих по схеме:
АГ + ВГ СГ (5.20)
подстрочный символ "г" означает вещество, находящееся в газовой фазе.
Механизм Лэнгмюра-Хиншельвуда.
Данный механизм, был предложен в 1921 г. Он основан на следующих предположениях:
-
Оба реагента адсорбируются без диссоциации на разных активных центрах.
-
Хемосорбированные на соседних центрах реагенты взаимодействуют с образованием адсорбированного продукта С.
-
Образовавшийся продукт десорбируется.
Последовательность стадий в механизме Лэнгмюра-Хиншельвуда описывается следующими уравнениями (символ "*" относится к адсорбированному веществу):
АГ А*
ВГ В*
А* + В* С*
С* СГ
Схематично механизм изображен на Рисунке 5.5.
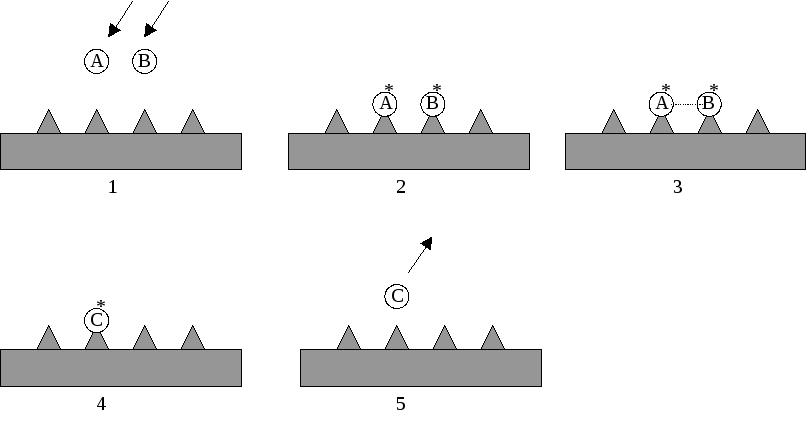
Рис. 5.5. Схема механизма Лэнгмюра-Хиншельвуда.
Любая из указанных стадий может быть лимитирующей. Рассмотрим случай лимитирования собственно химической реакции на поверхности. В этом варианте кинетическое уравнение, учитывая выражения (5.15) и (5.16) будет выглядеть так:
rЭФ = dРС/d = kАВ = (kKАРАKВРВ)/(1 + KАРА + KВРВ)2 (5.21)
Можно выделить ряд частных случаев наблюдаемых кинетических закономерностей для реакций, протекающих по механизму Лэнгмюра-Хиншельвуда:
-
Когда Оба реагента слабо адсорбируются, т.е. (KА и KВ) << 1, уравнение (5.21) принимает вид: rЭФ = kKАKВPАPВ = k’PАPВ, и реакция имеет первые порядки по реагентам.
-
Когда реагент А слабо сорбируется, а В - сильно, т.е. KА << 1 << KВ, уравнение (5.21) принимает вид: rЭФ = kKАРА/(KВРВ) = k’РА/РВ, и реакция имеет первый порядок по А и минус первый по В.
Рассмотрим теперь влияние парциального давления реагента А при постоянном парциальном давлении В (рВ = const):
-
При низких РА, когда KАРА << (1 + KВРВ), уравнение (5.21) принимает вид:
rЭФ = kKАРАKВРВ/(1 + KВРВ) k’РА,
то есть скорость реакции прямо пропорциональна РА.
-
Скорость достигнет максимума при А = В, или KАРА = KВРВ.
-
При высоких РА, когда KАРА >> (1 + KВРВ), уравнение (5.21) принимает вид:
rЭФ = kKВРВ/KАРА k’/РА,
т.е. скорость изменяется обратно пропорционально РА.
Рисунок 5.6 иллюстрирует рассмотренные три случая.

Рис. 5.6. Предельные случаи зависимости скорости бимолекулярной реакции, протекающей по механизму Лэнгмюра-Хиншельвуда, от парциального давления одного из реагентов.
Статистическое объяснение зависимости, изображенной на Рисунке 5.6, заключается в следующем: При низких давлениях А степень заполнения поверхности реагентом А (А) низка, и все хемосорбированные молекулы А могут реагировать с хемосорбированными молекулами В. Скорость реакции растет до максимального значения (при А = В). При дальнейшем росте давления А поверхность все более блокируется компонентом А и вероятность расположения хемосорбированных молекул А и В на соседних центрах уменьшается, а вследствии этого снижается скорость реакции.
Механизм Лэнгмюра-Хиншельвуда наблюдается для многих промышленных реакций. Примеры некоторых процессов приведены в таблице 5.3.
Таблица 5.3.
Примеры промышленных процессов, протекающих по механизму Лэнгмюра-Хиншельвуда.
|
Процесс |
Катали-затор |
Уравнение реакции |
|
Окисление СО |
Pt |
2СО + О2 2СО2 |
|
Синтез метанола |
ZnO |
СО + 2Н2 СН3ОН |
|
Гидрирование этилена |
Cu |
С2Н4 + Н2 С2Н6 |
|
Восстановление N2O |
Pt, Au |
N2O + Н2 N2 + Н2O |
|
Окисление этилена до ацетальдегида |
Pd |
С2Н4 + 0,5О2 СН3СНО |
Механизм Элий-Ридила
Механизм Элий-Ридила был предложен в 1943 г. Данный механизм основан на следующих предположениях:
-
Один реагент хемосорбируется;
-
Затем он реагирует со вторым реагентом из газовой фазы (без адсорбции второго реагента) с образованием адсорбированного продукта;
-
Далее продукт десорбируется.
Последовательность стадий соответствует следующим химическим уравнениям:
АГ А*
А* + ВГ С*
С* СГ
Схематично механизм Элий-Ридила изображен на Рисунке 5.7.

Рис. 5.7. Схема механизма Элий-Ридила.
В данном механизме кинетика реакции определяется степенью насыщения поверхности реагентом А и парциальным давлением реагента В в газовой фазе. Исходя из уравнения изотермы Лэнгмюра, получаем:
rЭФ = dPС/d = kАPВ = (kKАPАPВ)/(1 + KАPА) (5.22)
Зависимость наблюдаемой скорости реакции от давления А при постоянном давлении В изображена на Рисунке 5.8. Вид зависимости аналогичен виду изотермы адсорбции реагента А, и скорость реакции достигает предельной постоянной величины при высоких значениях PА.

Рис. 5.8. Зависимость наблюдаемой скорости реакции (rЭФ) от парциального давления одного из компонентов для бимолекулярной газофазной реакции, протекающей по механизму Элий-Ридила.
Примеры некоторых промышленно важных реакций, протекающих по механизму Элий-Ридила приведены в таблице 5.4.
Таблица 5.4.
Примеры реакций, протекающих по механизму Элий-Ридила.
|
Процесс |
Катализатор |
Уравнение реакции |
|
Окисление этилена до этиленоксида |
Ag |
С2Н4 (Г) + 0,5О2* С2Н4О |
|
Восстановление СО2 водородом |
Ni |
СО2(Г) + Н2* Н2O + СО
|
|
Окисление аммиака |
Pt |
NН3(Г) + 3/2О2* N2 + 3Н2O |
|
Гидрирование циклогексена |
Ni |
С6Н10 (Г) + Н2* С6Н12 |
|
Селективное гидрирование ацетилена |
Ni или Fe |
С2Н2(Г) + Н2* С2Н4
|
* - адсорбированный реагент.
Рассмотренные выше два механизма наиболее простые. В литературе описаны сотни более сложных механизмов гетерогенно-каталитических реакций и соответствующие им кинетические уравнения. Таким образом, знание механизма реакции необходимо для вывода кинетического уравнения. А знание кинетики реакции, в свою очередь, необходимо для расчета промышленного реактора.
