
- •Теоретические основы гетерогенного катализа
- •Элементарные стадии в гетерогенном катализе.
- •Кинетика и механизмы гетерогенно-каталитических реакций.
- •Значение адсорбции в гетерогенном катализе.
- •Кинетическое описание гетерогенно-каталитических реакций.
- •Механизмы гетерогенно-каталитических газофазных реакций. Связь механизма реакции с кинетикой.
- •Основные структуры хемосорбированных частиц.
- •Основные концепции теории гетерогенного катализа.
- •Классификация гетерогенных катализаторов.
- •Энергетический подход и каталитическая активность.
- •Стерический фактор и каталитическая активность.
-
Стерический фактор и каталитическая активность.
Стерический или геометрический фактор - один из важнейших параметров, влияющих на хемосорбцию, а, следовательно, и на каталитическую эффективность. Стерический фактор проявляется в геометрическом соответствии расположения атомов в молекуле адсорбата и атомов на поверхности катализатора.
Еще в 1929 г. Баландин А.А. выдвинул мультиплетную теорию, объясняющую каталитическую активность на базе геоиетрического строения молекулы реагента и кристаллической решетки катализатора.
Суть мультиплетной теории состоит в следующем. При катализе происходит наложение (хемосорбция) группы атомов молекулы субстрата (называемых индексной группой) на группу активных атомов (центров) поверхности катализатора (называемых мультиплет) с образованием промежуточного мультиплетного комплекса.
Например, при гидрировании двойной связи в олефинах происходит хемосорбция с образованием промежуточного мультиплетного комплекса на поверхности металла:
 (5.27)
(5.27)
В данном случае индексной группой является этиленовая группа С=С , мультиплетом - пара активных центров М-М. Изучая скорость гидрирования коричной кислоты на металлах, был обнаружен максимум скорости на Rh для следующего ряда металлов: Ni, Rh, Pd, Pt, Ru, Os. Согласно мультиплетной теории Баландина, объяснение этому факту следующее: В образующемся мультиплетном комплексе угол М-С-С должен быть близок к тетраэдрическому (109о), в этом случае наиболее легко идет образование гидрированной молекулы. Учитывая, что длина С=С связи 1,54 Ао, и зная межатомные расстояния в испытуемых катализаторах, простым геометрическим расчетом можно убедиться, что в случае Rh угол в трапеции МССМ наиболее близок к тетраэдрическому.
Примером решающего значения геометрического фактора на протекание каталитических служат ферментативно-каталитические реакции, протекающие по так называемому механизму "ключ-замок" ("key-keyhole"). Суть его в том, что реакция протекает лишь при строгом геометрическом соответствии реагента и катализатора (фермента). Такие реакции протекают со 100%-ной селективностью. К сожалению для промышленных гетерогенных катализаторов такая селективность не достижима.
Кристаллическое строение и каталитическая активность металлов.
Уже из рассмотренных примеров становится очевидно, что геометрическое расположение активных центров на поверхности катализаторов значительно влияет на каталитическую эффективность. Наиболее ярко это влияние наблюдается у металлов, поэтому рассмотрим более подробно именно этот класс катализаторов.
Расположение атомов металла на поверхности зависит от структуры кристаллической решетки. Для большинства металлов характерны три типа кристаллических решеток (Рис. 5.23):
-
гранецентрированная кубическая (гцк)
-
объемно-центрированная кубическая (оцк)
-
гексагональная плотноупакованная (гпу).

|
гранецентрированная кубическая (гцк) к.ч. = 12 (Ag, Co, Fe, Ni, Pd, Pt, Rh)
|
объемно-центрированная кубическая (оцк) к.ч. = 8 (Na, Nb, V, W)
|
гексагональная плотноупакованная (гпу) к.ч. = 12 (Re,Ru)
|
Рис. 5.23. Строение элементарных ячеек кристаллических решеток металлов.
В гексагональной плотноупакованной (ГПУ) структуре каждый атом металла окружен 12-ю другими атомами, т.е. координационное число равно 12. В гранецентрированной кубической (ГЦК) координационное число также равно 12. В объемноцентрированной кубической (ОЦК) - 8.
Строение поверхности катализаторов, естественно, отличается от строения в его объеме, поскольку на поверхности кристаллическая решетка обрывается, образуя кристаллографические плоскости.
Для обозначения кристаллографических плоскостей используют индексы Миллера. Индексы Миллера для кристаллографической плоскости показывают, какие и сколько кристаллографических осей элементарной кристаллической решетки пересекает данная плоскость. Численно они равны обратным значениям длин отсекаемых отрезков, выраженных целыми относительными числами. На Рисунке 5.24 изображены кристаллографические плоскости для кубической кристаллической структуры.


1 2 3
Рис. 5.24. Примеры кристаллографических плоскостей в кубической структуре. Указаны соотношения длин отсекаемых отрезков и индексы Миллера.
Например, кристаллографическая плоскость, совпадающая с верхней гранью кубической элементарной ячейки пересекает только одну кристаллографическую ось "с". Обозначим длину отсекаемого отрезка - с. Оси "а" и "b" данная плоскость не пересекает, т.е. длины соответствующих отсекаемых отрезков (а и b) формально равны . Тогда, длины отсекаемых отрезков соотносятся как:
::с (5.28)
а обратные значения длин отрезков соотносятся как:
(1/):(1/):(1/с) = 0:0:(1/с) (5.29)
Чтобы выразить данное соотношение в целых числах, поделим все соотносящиеся величины на (1/с) и получим:
0:0:1 (5.29)
Следовательно, рассмотренная кристаллографическая плоскость имеет обозначения в индексах Миллера (001). Они отражают тот факт, что плоскость пересекает только кристаллографическую ось "с" и параллельна осям "а" и "b".
Соответственно, кристаллографическая плоскость пересекающая только ось "а" имеет индекс (100), а пересекающая только ось "b" имеет индекс (010) (Рис. 5.24 (1)).
Рассмотрим кристаллографическую плоскость проходящую через противоположные ребра кубической ячейки и пересекающую только оси "а" и "b" на одинаковых расстояниях (Рис. 5.24 (2)). Поскольку отсекаемые отрезки имеют одинаковую длину, то индекс данной плоскости - (110).
Плоскость, проходящая через вершины куба, лежащие на кристаллографических осях (Рис. 5.24 (1)), соответственно, имеет индекс (111). Плоскость, проходящая через две вершины куба, лежащие на кристаллографических осях "а" и "b" и через середину ребра, совпадающего с осью "с" (Рис. 5.24 (3)), отсекает отрезки, длины которых соотносятся как:
1:1:(1/2)
следовательно, обратные значения длин соотносятся как:
1:1:2
т.е. индекс данной кристаллографической плоскости - (112).
Таким образом становится очевидным, что расположение атомов (а следовательно, активных центров) на поверхности катализатора зависит от структуры кристаллической решетки катализатора и индексов кристаллографических плоскостей, которыми решетка обрывается на поверхности катализатора.
Во взаимодействии с субстратом участвуют не только атомы первого слоя поверхности, но и атомы второго слоя (правда, в меньшей степени), и, даже, атомы третьего слоя (в еще меньшей степени). Это определяется доступностью соответствующих слоев, которая зависит структуры решетки и индекса поверхности (Рис. 5.25). Как видно из рисунка для плоскостей (100) гцк легко доступными для хемосорбции являются только атомы первого слоя. Для остальных, представленных на рисунке плоскостей атомы второго слоя также доступны для взаимодействия с субстратом. А для плоскости (210) гцк потенциальной доступностью обладают и атомы третьего слоя. Поэтому, очевидно, что реакционная способность поверхностей, образованных плоскостями с различными индексами, будет различна.

Рис. 5.25. Примеры расположения атомов первых трех поверхностных слоев для различных кристаллографических плоскостей.
В объеме катализатора атомы кристаллической решетки координационно насыщены. Атомы на поверхности катализатора координационно не насыщенны и имеют свободные валентности. Этим и объясняется их каталитическая активность. В зависимости от индекса кристаллографической плоскости, которая образует поверхность катализатора, атомы имеют различное количество свободных валентностей и, следовательно, обладают различной каталитической активностью. На Рисунке 5.26 изображены три кристаллографические плоскости металлического Ni, расположение атомов в объеме и на поверхности, а также соответствующие координационные числа и свободные валентности. Видно, что наименее координационно насыщенными являются атомы на плоскости (110). Очевидно, что потенциально они обладают наибольшей активностью в хемосорбции. Но каталитическая активность будет определяться не только этим фактором, но и геометрией расположения поверхностных атомов и геометрией молекулы адсорбата.


|
гцк элементарная ячейка |
(100) |
(110) |
(111) |




|
Количество соседних атомов 12 |
8 |
7 |
9 |
|
Количество свободных валентностей 0
|
4
|
5
|
3
|
|
Расположение атомов на поверхности |
|
|
|
Рис. 5.26. Количество окружающих атомов и свободных валентностей на различных кристаллографических плоскостях никеля в гкц кристаллической решетке.
Влияние типа упаковки и межатомного расстояния на каталитическую активность металлов иллюстрируется следующим примером. Было установлено, что только металлы имеющие плотнейшую упаковку (т.е. координационное число - 12, что достигается только у металлов с ГЦК и ГПУ решетками) и межатомные расстояния в диапазоне 0,248-0,277 нм катализируют реакцию дегидрирования циклогексана до бензола (Таблица 5,8). Это связано с тем, что при дегидрировании до бензола хемосорбированная промежуточная частица должна располагаться на поверхности катализатора строго определенным образом, кек изображено на Рисунке 5.27. Такое расположение возможно только для охарактеризованных выше металлов.
Таблица 5.8.
Структура кристаллической решетки и межатомное расстояние (нм) для некоторых металлов.
|
Тип кристаллической решетки |
|||||
|
оцк |
гцк |
гпу |
|||
|
Ta W Mo V -Cr -Fe |
0.286 0.272 0.272 0.260 0.246 0.248 |
Ce Ag Au Al Pt* Pd* Ir* Rh* Cu* -Co* Ni* |
0.366 0.288 0.288 0.286 0.276 0.274 0.270 0.268 0.256 0.252 0.248 |
Mg Zr Cd Ti Os* Zn* Ru* -Co* Be |
0.320 0.312 0.298 0.292 0.270 0.266 0.266 0.252 0.224 |
* - Металлы, катализирующие дегидрирование циклогексана.

Рис. 5.27. Расположение хемосорбированной частицы на поверхности металлов с плотнейшей упаковкой при дегидрировании циклогексана до бензола.
Как было показано выше, в зависимости от кристаллографической плоскости, поверхностные атомы на ней располагаются определенным геометрическим образом (Рис. 5.25 и 5.26), поэтому различные кристаллографические поверхности даже одного и того же катализатора обладают различной каталитической активностью. Ярким примером служит активность металлического железа в реакции синтеза аммиака из азота и водорода. Установлено, что активность граней (110), (100) и (111) монокристалла металлического железа, имеющего ОЦК упаковку, в реакции гидрирования азота до аммиака соотносятся как 1:13:430. Наименьшую активность проявляет плоскость (110) на которой атомы железа наиболее удалены друг от друга, а наивысшую - плоскость (111) состоящая из наиболее близко расположенных атомов железа.
Очевидно, что реальная поверхность промышленного катализатора состоит из множества малых кристаллитов, расположенных хаотически и имеющих набор различных кристаллографических плоскостей.
Кроме этого, поверхность реального катализатора имеет целый ряд структурных дефектов (Рис. 5.28), таких как: терраса, излом, ступень (одно- и многоатомная), адсорбированный атом, вакансия.

Рис. 5.28. Структура поверхности в реальном катализаторе.
Террасы представляют собой протяженные участки, образованные одной кристаллографической плоскостью. Если терраса образована низкоиндексной плоскостью ((100), (110), (111)), то она проявляет все свойства этой плоскости. Но высокоиндексные плоскости могут образовывать более сложные многоступенчатые поверхности. Так, например, поверхность платины (557) представляет собой террасы (111), соединенные моноатомными ступенями (001).
В ходе каталитической реакции структурные дефекты могут непрерывно исчезать и возникать. В результате этого наблюдается некоторая усредненная активность катализатора.
Таким образом, в конечном итоге характер взаимодействия реагентов с поверхностными атомами катализатора определяется:
-
типом кристаллической решетки;
-
индексом кристаллографической плоскости, образующей поверхность, где расположен атом;
-
структурой поверхности (плоская терраса, излом, вакансия, ступень и пр.)
Рассмотрим влияние стерического фактора на примере реакции гидрирования этилена на Ni. Молекула этилена ассоциативно хемосорбируется на поверхности Ni, с разрывом -связи и образованием двух -связей с соседними атомами Ni (Рис. 5.29).

Рис. 5.29. Хемосорбция молекулы этилена на поверхности металлического никеля.
Оказалось, что поверхность (111) Ni намного менее активна в реакции гидрирования этилена, чем поверхности (100) и (110). Объяснение этому явлению можно дать с точки зрения влияния стерических факторов.
Экспериментально установлено (методом ДМЭ (LEED)), что межатомные расстояния Ni-Ni на различных кристаллографических плоскостях составляют 0,25 и 0,35 нм, а длина связи С-С у хемосорбированного этилена 0,182 нм.
Таблица 5.9.
Адсорбция и гидрирование этилена на разных кристаллографических плоскостях Ni.
|
Расстояние Ni-Ni |
Плоскость |
Угол Ni-С-С |
Связь Ni-С |
Каталитическая активность |
|
0,25 нм |
(111) |
105о |
Прочная, стабильная |
Низкая |
|
0,35 нм |
(100); (110) |
123о |
Слабее |
Высокая |
По длинам межатомных расстояний в поверхностном комплексе можно вычислить угол связи Ni-С-С, который составляет 105о для плоскости (111) и 123о для плоскостей (100) и (110). Угол 105о по величине очень близок к тетраэдрическому (109о), поэтому связь в комплексе на плоскости (111) прочная и стабильная, и дальнейшая реакция протекает медленно.
А на плоскостях (100) и (110) геометрическая ситуация менее выгодна. Хемосорбция менее прочная, молекула этилена более вытянута и более легко вступает в реакцию гидрирования. Суммарные данные приведены в Таблице 5.9.
Аналогичный подход может быть распространен и на другие металлы. На Рисунке 5.30 приведена диаграмма влияния межатомного расстояния на поверхности (100) у металлов: Ta, Ni, Rh, Pd, Pt, Fe, W - на каталитическую активность в реакции гидрирования этилена.
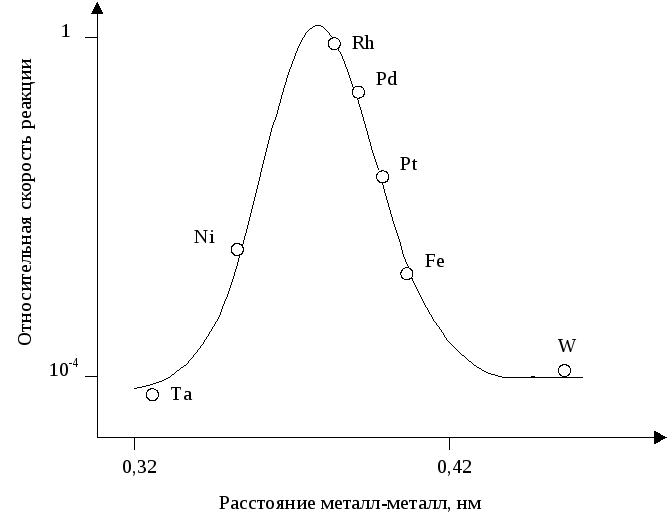
Рис. 5.30. Относительная скорость гидрирования этилена, как функция межатомного расстояния на плоскости (100) переходных металлов.
Максимальную активность проявляет Rh у которого межатомное расстояние равно 0,375 нм (больше, чем у никеля, поэтому хемосорбированная молекула этилена более активирована и легче вступает в реакцию). При дальнейшем увеличении расстояния двухцентровая ассоциативная хемосорбция становится все слабее, что приводит к снижению концентрации активированных молекул на поверхности (а следовательно, и скорости реакции), вплоть до полной невозможности образовывать двухцентровой комплекс.
При уменьшении расстояния металл-металл хемосорбция становится все более прочной, комплекс более стабильный и менее реакционно способный.
Однако, ошибочным будет утверждение, что на каталитическую активность в рассмотренной модельной реакции влияет только геометрический фактор. Безусловно, необходимо учитывать и влияние энергетического фактора (теплота адсорбции). Но в данном, конкретном случае вклад геометрического фактора является определяющим.
Структурно-чувствительные и структурно-нечувствительные реакции. Дисперсность металлов.
Помимо взаимного расположения атомов катализатора на кристаллографических плоскостях, большое влияние также оказывает место расположения атомов на дефектах поверхности катализатора.
Так, например, при гидрогенолизе циклогексана до н-гексана на платине, атомы на изломах имеют активность на порядок выше, чем атомы на ступенях, а наименее активны - атомы на террасах. Таким образом по активности поверхностные атомы платины можно разделить на три группы:
-
Высоко координационно-насыщенные атомы на террасах: низкая активность;
-
Атомы на ступенях: более активны, катализируют разрыв С-Н и Н-Н связей;
-
Сильно координационно-ненасыщенные атомы на изломах: высоко активны, катализируют разрыв С-С связей.
По причине высокой активности атомы ступеней и изломов не закоксовываются во время реакции. Предполагается, что образующийся на них слой карбонизированного продукта немедленно удаляется по реакции гидрирования.
Методом ИК-спектроскопии была изучена хемосорбционная активность платины по отношению к СО. Были выявлены следующие комплексы СО на поверхности Pt:
(СО) на ступенях: 2066 см-1, низкая степень покрытия поверхности, разрыхленная связь СО;
(СО) на террасах: 2090 см-1, высокая степень покрытия поверхности.
Эти данные объясняют высокую активность атомов Pt на ступенях в реакциях с участием СО.
Еще один пример влияния структуры поверхности на каталитическую активность - разложение ацетонитрила на никеле (Рис. 5.31).

Рис. 5.31. Адсорбция и разложение ацетонитрила на поверхности Ni.
Было установлено, что на гладких поверхностях (111) адсорбция ацетонитрила слабая и обратимая, а расщепление протекает значительно медленнее, чем на плоскости (110), которая имеет более высокую плотность ступенек.
Это объясняется тем, что молекула ацетонитрила всегда адсорбируется через атом азота и нитрильная группа располагается перпендикулярно поверхности. Таким образом, на ровной поверхности (Рис. 5.31а) геометрически не может произойти взаимодействие СН3-группы с поверхностью, и молекула остается не достаточно активированной. На изломе, ступени или рядом со ступенью происходит активирование водорода метильной группы и молекула легко подвергается разложению (Рис. 5.31 б,в).
Как следует из рассмотренных примеров, скорость каталитической реакции во многих случаях сильно зависит от геометрического строения активного центра. Наблюдаемая скорость гетерогенно-каталитической реакции складывается из суммы скоростей реакций, протекающих на разных каталитических центрах поверхности. Очевидно, что суммарная, наблюдаемая скорость реакции пропорциональна концентрации активных центров (на единицу массы катализатора), которая, в свою очередь пропорциональна удельной поверхности частиц катализатора.
Удельную поверхность металлических нанесенных катализаторов характеризуют дисперсностью.
Дисперсность (степень дисперсности) - это отношение числа поверхностных атомов к общему числу атомов активного компонента.

Рис. 5.32. Расположение поверхностных атомов в кристаллитах платины: а) октаэдрической конфигурации; б) кубоктаэдрической конфигурации.
Рассмотрим зависимость дисперсности от размера частицы на примере идеального октаэдрического кристалла платины (Рис. 5.32 а). Самый маленький кристалл представляет собой октаэдр из шести атомов (по 2 атома в каждом ребре), каждый из которых расположен на поверхности кристалла. Значит дисперсность равна 1 (или 100%), так как:

Следующий по размеру кристалл платины содержит по 3 атома в ребре и состоит из 19 атомов, из которых 18 атомов находятся на поверхности. Соответственно дисперсность, в данном случае, составляет 18:19 = 0,947 0,95 (или 95%). В Таблице 5.10 приведены данные по дисперсности для следующих, более крупных, кристаллов платины. Для частицы платины размером 1 мкм дисперсность составляет 0,001. В высокоэффективных промышленных платиновых катализаторах дисперсность нанесенной платины, как правило, выше 0,5.
На Рисунке (5.32 а) видно, что атомы поверхности платины можно разделить на три типа по координационному числу:
-
атомы на гранях имеют координационное число 9;
-
атомы на ребрах имеют координационное число 7;
-
атомы на углах имеют координационное число 4.
Соотношение поверхностных атомов с различным координационным числом также зависит от размера кристалла, то есть от дисперсности. Например, самый маленький октаэдрический кристалл (число атомов = 6) состоит только из угловых атомов с координационным числом 4. В Таблице 5.10 приведено среднее координационное число атомов поверхности для кристаллов различной дисперсности.
Таблица 5.10.
Дисперсность и среднее координационное число поверхностных атомов в октаэдрических кристаллах платины.
|
Ребро кристалла |
Дисперсность, % |
Общее число атомов в кристалле |
Среднее координационное число поверхностных атомов |
|
|
Число атомов в ребре |
Длина ребра, нм |
|||
|
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 |
0,550 0,895 1,100 1,375 1,650 1,925 2,200 2,475 2,750 3,025 3,300 3,575 3,850 4,125 4,400 4,675 4,950 |
100 95 87 78 70 63 57 53 49 45 42 39 37 35 33 31 30 |
6 19 44 85 146 231 344 489 670 891 1156 1469 1834 2255 2736 3281 3894 |
4,00 6,00 6,94 7,46 7,76 7,97 8,12 8,23 8,31 8,38 8,44 8,47 8,53 8,56 8,59 8,62 8,64 |
Установлено, что для благородных металлов при высокой дисперсности преобладают угловые атомы; максимальное количество атомов на ступеньках достигается при средней дисперсности; террасы преобладают при низкой дисперсности. Поскольку каталитическая активность поверхностных атомов зависит от их координационной насыщенности, то естественно ожидать, что с уменьшением размеров частиц катализатора (т.е. с увеличением дисперсности) в некоторых реакциях должна изменяться наблюдаемая каталитическая активность.
По этому признаку каталитические реакции делят на:
Структурно-чувствительные - это реакции, для которых удельная активность или число оборотов на одном активном центре зависит от размера частиц катализатора;
Структурно-нечувствительные - это реакции для которых удельная активность или число оборотов на одном активном центре не зависит от размера частиц катализатора.
К структурно-чувствительным реакциям, как правило относятся те, которые протекают с разрывом связей в молекуле реагента, и активация реагентов происходит на полиядерных центрах.
Структурно-нечувствительные реакции, это, как правило, реакции в которых активированный реагент связан с одним атомом поверхности катализатора (одноцентровая хемосорбция).
Причем, одна и та же реакция может быть структурно-чувствительной на одном катализаторе и структурно-нечувствительной на другом. Примеры реакций обоих типов приведены в Таблице 5.11.
Таблица 5.11.
Примеры структурно-чувствительных и структурно-нечувствительных реакций.
|
Структурно-чувствительные реакции |
Структурно-нечувствительные реакции |
|
Гидрогенолиз: Этан (Ni); Метилциклопентан (Pt) Циклогексан (Pt)
Гидрирование: Бензол (Ni) Этилен (Ni)
Изомеризация: Бутан, Гексан (Pt)
Окисление: углеводородов (Pt); аммиака (Pt);
Дегидролциклизация: Гексан, Гептан (Pt)
Синтез аммиака (Fe)
Гидродесульфирование (Re) |
Гидрирование: Бензол (Pt) Этилен (Pt) Кетоны (Cu)
Дегидрирование: Циклогексан (Pt)
Окисление: СО Этилена до этиленоксида (Ag)
Гидродесульфирование (Mo) |



