
- •1. Термодинамика. Химическая термодинамика. Основные понятия. Термодинамическая система. Фаза. Классификация термодинамических процессов.
- •2. Системы гомогенные и гетерогенные. Основные параметры системы:
- •3. Понятие термодинамической функции. Внутренняя энергия, полная энергия системы. Устойчивость состояния системы.
- •4. Теплота, работа. 1-й закон термодинамики.
- •6. Энтропия, ее определение. Определение Клаузиуса и Планка. Второй закон термодинамики.
- •7. Классификация химических процессов. 1) по знаку; 2) по условиям протекания; 3) по самопроизвольности.
- •9. Энтропия образования вещества в результате химической реакции.Стандартная энтропия образования вещества (s ).Закономерности изменения энтропии.
- •10. Термодинамическое равновесие. Самопроизвольные процессы.
- •12. Влияние отдельных факторов на изменение энергии Гиббса.
- •16. Закон Гесса. Следствия из закона Гесса.
- •17. Обратимые и необратимые реакции. Состояние равновесия.Истинное равновесие. Стационарное и кажущееся равновесие. Константа равновесия.
- •18. Теория активации химических реакций.Механизм сложной химической реакции.
- •19. Закон Лавуазье-Лапласа.Закономерности изменения энтропии.
- •20. Виды химических реакций. Факторы, определяющие процесс реакции.
- •21. Химические реакции в твердой фазе.Способы инициирования реакций
- •22. Способы инициирования реакций Механохимия. Трибохимия
- •24. Виды диффузионных процессов в твердом теле.
- •25. Избыточная энтальпия.
- •26. Третий закон термодинамики.
- •27. Растворы. Дисперсии. Истинные растворы.
- •28. Идеальные растворы. Закон Рауля и отклонения от него.
- •29. Закон действующих масс. Закон разбавления Оствальда
- •30. Термодинамика процесса растворения. Физическая и Химическая сторона процесса растворения. Теплота растворения.
- •31. Энтропия растворения.Энергия Гиббса.
- •32. Уравнение Нернста
- •34. Методы идентификации продуктов реакции
- •2. Структурный анализ
29. Закон действующих масс. Закон разбавления Оствальда
Слабые электролиты при растворении и расплавлении диссоциируют на ионы частично. Параллельно с процессом диссоциации идет обратный процесс – ассоциация – образование молекул из ионов. В определенный момент времени скорости прямой и обратной реакций выравниваются, и наступает состояние химического равновесия. В данном состоянии система будет находиться столь долго, пока какое-либо внешнее воздействие не приведет к смещению равновесия. Состояние химического равновесия характеризуется константой равновесия.
Выведем выражение для константы химического равновесия, опираясь на понятия химической кинетики.
1. Запишем уравнение диссоциации слабого электролита в общем виде:
aA + bB ⇄ dD + eE.
2. Запишем уравнения для скорости прямой и обратной реакции через концентрации веществ:
v1=k1 [A]a[B]b,
v2 =k2 [D]d[Е]е .
3. Состояние химического равновесия характеризуется равенством скоростей прямой и обратной реакции:
v1= v2 , или
k 1 [A]a[B]b= k2[D]d[Е]е .
4. Преобразуем последнее выражение, сгруппировав переменные величины (концентрации) в одной части выражения, а постоянные величины (константы скоростей) – в другой:
|
|
|
|
5. Так как отношение констант скоростей есть величина постоянная, вводим новую константу, которая будет характеризовать состояние химического равновесия.
6. На основании полученного выражения формулируем закон действующих масс.
Для обратимой химической реакции в состоянии равновесия произведение равновесных концентраций продуктов реакции в степенях их стехиометрических коэффициентов, отнесенное к такому же произведению для исходных веществ, есть величина постоянная при данной температуре и давлении.
Константа химического равновесия есть величина постоянная при данной температуре и давлении; она не зависит от концентраций реагирующих веществ, а определяется лишь природой вещества и растворителя. Для слабых электролитов эта константа называется константой ионизации. Для сильных электролитов константа диссоциации не имеет смысла, так как данные вещества при растворении полностью диссоциируют на ионы.
Помимо константы ионизации силу электролита характеризует степень диссоциации. Степень диссоциации – это отношение числа распавшихся при диссоциации молекул на ионы, отнесенное к общему числу частиц растворенного вещества.
|
|
|
|
Между степенью диссоциации и константой ионизации существует математическая связь, выражаемая законом разбавления Оствальда:
|
|
|
(9) |
если электролит слабый и степень диссоциации мала, то величиной α в знаменателе можно пренебречь по сравнению с единицей, в итоге получим упрощенное выражение закона разбавления Оствальда:
![]() .
.
Закон
разбавления Оствальда. При
разбавлении слабого электролита степень
его диссоциации
увеличивается.
![]()
|
|
|
30. Термодинамика процесса растворения. Физическая и Химическая сторона процесса растворения. Теплота растворения.
Растворение – это физико-химический процесс.
Насыщенный раствор – это раствор который находится в равновесии с растворяющимся веществом.
Физическая сторона – растворяющее вещество теряет свою структуру, разрушается.
Химическая сторона – растворяемое вещество взаимодействует с растворителем- сольватация- образуются сольваты, если растворение идет в воде, то процесс называется гидратацией - образуются гидраты.
Теплотой или энтальпией растворения – называется количество теплоты, которое выделяется или поглощается при растворении.
Что происходит при растворении?
а) разрушение структуры растворенного вещества, т.е. фазовый переход Нфп
Нфп > 0 тепло затрачивается
NaClтв = Na+ + Cl– H>0 S>0
б) гидратация
Нгидр < 0 тепло выделяется
Na+ + n·H2O = [Na(H2O)n]+
Cl– + m·H2O = Cl– •m·H2O H<0 S<0
в) Hраст = Hфп + Нгидр
Если Hфп > Нгидр – то процесс эндотермический,
Если Hфп < Нгидр – то процесс экзотермический.

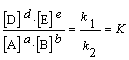 .
.