
- •1. Термодинамика. Химическая термодинамика. Основные понятия. Термодинамическая система. Фаза. Классификация термодинамических процессов.
- •2. Системы гомогенные и гетерогенные. Основные параметры системы:
- •3. Понятие термодинамической функции. Внутренняя энергия, полная энергия системы. Устойчивость состояния системы.
- •4. Теплота, работа. 1-й закон термодинамики.
- •6. Энтропия, ее определение. Определение Клаузиуса и Планка. Второй закон термодинамики.
- •7. Классификация химических процессов. 1) по знаку; 2) по условиям протекания; 3) по самопроизвольности.
- •9. Энтропия образования вещества в результате химической реакции.Стандартная энтропия образования вещества (s ).Закономерности изменения энтропии.
- •10. Термодинамическое равновесие. Самопроизвольные процессы.
- •12. Влияние отдельных факторов на изменение энергии Гиббса.
- •16. Закон Гесса. Следствия из закона Гесса.
- •17. Обратимые и необратимые реакции. Состояние равновесия.Истинное равновесие. Стационарное и кажущееся равновесие. Константа равновесия.
- •18. Теория активации химических реакций.Механизм сложной химической реакции.
- •19. Закон Лавуазье-Лапласа.Закономерности изменения энтропии.
- •20. Виды химических реакций. Факторы, определяющие процесс реакции.
- •21. Химические реакции в твердой фазе.Способы инициирования реакций
- •22. Способы инициирования реакций Механохимия. Трибохимия
- •24. Виды диффузионных процессов в твердом теле.
- •25. Избыточная энтальпия.
- •26. Третий закон термодинамики.
- •27. Растворы. Дисперсии. Истинные растворы.
- •28. Идеальные растворы. Закон Рауля и отклонения от него.
- •29. Закон действующих масс. Закон разбавления Оствальда
- •30. Термодинамика процесса растворения. Физическая и Химическая сторона процесса растворения. Теплота растворения.
- •31. Энтропия растворения.Энергия Гиббса.
- •32. Уравнение Нернста
- •34. Методы идентификации продуктов реакции
- •2. Структурный анализ
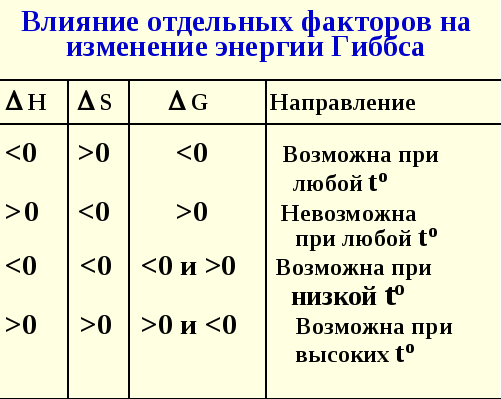
12. Влияние отдельных факторов на изменение энергии Гиббса.
Критерий направленности процессов
Равновесие
G = 0; Н = ТS
Самопроизвольный процесс
G < 0; Н - ТS < 0
Несамопроизвольный процесс
G > 0; Н - ТS > 0
Н - ТS = G
13. Уравнение Вант –Гоффа. Константа равновесия, определение через нее G.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.Математически правило Вант-Гоффа выражается так:
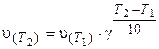
где v(T2) и v(T1) - скорости реакций, соответственно при температурах Т2 и T1 (T2> T1); γ-температурный коэффициент скорости реакции. Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
14. Уравнение Аррениуса. Энергия активации. Химическая реакция в газовой фазе, зависимость от температуры и энергии активации.
Правило Вант-Гоффа применимо для ограниченного числа химических реакций. Влияние температуры на скорость процес-сов чаще определяют по уравнению Аррениуса.
Уравнение Аррениуса. В 1889 г. шведский ученый С. Арре-1иус на основании экспериментов вывел уравнение, которое на-звано его именем
k = Aexp[ -Eа /RT]
где k - константа скорости реакции; А - предэксноненциальный множитель; Eа - постоянная, называемая энергией активации, определяемая природой реагентов: R-универсальная газовая постоянная, равная 8,314 Дж/моль×К. Значения Еa для химических реакций лежат в пределах 4 - 400 кДж/моль.
Многие реакции характеризуются определенным энергетическим барьером. Для его преодоления необходима энергия актации - некоторая избыточная энергия (по сравнению со вредней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового ве-щества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.Чтобы молекулы прореагировали, они прежде всего должны столкнуться. Отсюда следует, что реакция должна идти тем быстрее, чем чаще сталкиваются друг с другом молекулы исходных веществ. Поэтому каждый фактор, влияющий на частоту столкновений между молекулами, будет влиять и на скорость реакции. Таким образом, имеется два главных фактора влияющих на скорость химических реакций: энергия активации и температура, определяющая энергию движущихся молекул и атомов.

k = A exp[ -EA /RT] lnk = lnA – [(EA/RT]
tg(α)= Ea/R
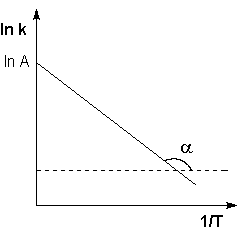
Строя экспериментальную зависимость k - константы скорости реакции от 1/Т можно определить важные для химического процесса величины А и Eа
В общем случае, если температура реакции изменяется от Т1 до Т2, уравнение после логарифмирования примет вид:
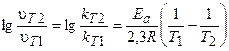 .
(3.10)
.
(3.10)
Это уравнение позволяет рассчитывать энергию активации реакции при изменении температуры от Т1 до Т2.
15. Принцип подвижного равновесия (принцип Ле-Шателье).
Принцип Ле-Шателье - внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
1. Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
2. Повышение температуры смещает равновесие в сторону эндотермической реакции.
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в строну прямой реакции.
4. Катализаторы не влияют на положение равновесия.
Химическое равновесиеможносместитьвнешнимвоздействием, руководствуясь принципом Ошибка! Недопустимый объект гиперссылки.: еслинаравновеснуюсистемуоказыватьвнешнеевоздействие, торавновесиесмещаетсявсторону, противодействующуюэтомувоздействию.
Влияниетемпературы. Дляреакций, идущихсуменьшениемэнтальпии (экзотермических), повышениетемпературыбудетпрепятствоватьпротеканиюпрямогопроцесса, тоестьсмещатьреакциювсторонуисходныхвеществ. Эндотермическиереакцииприэтомбудутсмещатьсявсторонуконечныхпродуктов. Например, приобычныхусловияхреакция N2 + O2 неидет(ΔH > 0), ноповышениетемпературыможетсделатьэтиреакциюосуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 сповышениемтемпературыбудутсмещатьсявсторонуисходныхвеществ.
Влияниедавления. Еслиреагируютгазообразныевещества, топринеизменномчислемолейначальныхиконечныхреагентовповышениеобщегодавлениянеприведетксмещениюравновесия. Есличисломолейприреакциименяется, тоизменениеобщегодавленияприведетксмещениюравновесия. Вчастности, реакция 2CO + O2 = 2CO2, протекающаясуменьшением Δn, приповышенииобщегодавлениясместитсявсторонуобразованияСO2.
3. Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции. Пусть водород, иодоводород и пары иода находятся в равновесии друг с другом при определенных температуре и давлении.
H2 + I2 ↔ 2HI
Введем в систему дополнительно некоторое количество водорода. Согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции — реакции синтеза HI, тогда как скорость обратной реакции не изменится. В прямом направлении реакция будет теперь протекать быстрее, чем в обратном. В результате этого концентрации водорода и паров иода будут уменьшаться, что повлечет за собою замедление прямой реакции, а концентрация HI будет возрастать, что вызовет ускорение обратной реакции. Через некоторое время скорости прямой и обратной реакций вновь сравняются— установится новое равновесие. Но при этом концентрация HI будет теперь выше, чем она была до добавления H2 , а концентрация I2— ниже.
4. Нарушение равновесия вследствие изменения температуры. Равновесие подавляющего большинства химических реакций сдвигается при изменении температуры. Фактором, который определяет направление смещения равновесия, является при этом знак теплового эффекта реакции. Можно показать, что при повышении температуры равновесие смещается в направлении эндотермической, а при понижении — в направлении экзотермической реакции.
Так, синтез аммиака представляет собой экзотермическую реакцию
![]()
Поэтому
при повышении температуры равновесие
в системе
![]() сдвигается
влево — в сторону разложения аммиака,
так как этот процесс идет с поглощением
теплоты.
сдвигается
влево — в сторону разложения аммиака,
так как этот процесс идет с поглощением
теплоты.
Наоборот, синтез оксида азота (II) представляет собой эндотермическую реакцию:
![]()
Поэтому при повышении температуры равновесие в системе сдвигается вправо — в сторону образования .
Закономерности, которые проявляются в рассмотренных примерах нарушения химического равновесия, представляют собою частные случаи общего принципа, определяющего влияние различных факторов на равновесные системы. Этот принцип, известный под названием принципа Ле Шателье, в применении к химическим равновесиям можно сформулировать так:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
