
- •1. Термодинамика. Химическая термодинамика. Основные понятия. Термодинамическая система. Фаза. Классификация термодинамических процессов.
- •2. Системы гомогенные и гетерогенные. Основные параметры системы:
- •3. Понятие термодинамической функции. Внутренняя энергия, полная энергия системы. Устойчивость состояния системы.
- •4. Теплота, работа. 1-й закон термодинамики.
- •6. Энтропия, ее определение. Определение Клаузиуса и Планка. Второй закон термодинамики.
- •7. Классификация химических процессов. 1) по знаку; 2) по условиям протекания; 3) по самопроизвольности.
- •9. Энтропия образования вещества в результате химической реакции.Стандартная энтропия образования вещества (s ).Закономерности изменения энтропии.
- •10. Термодинамическое равновесие. Самопроизвольные процессы.
- •12. Влияние отдельных факторов на изменение энергии Гиббса.
- •16. Закон Гесса. Следствия из закона Гесса.
- •17. Обратимые и необратимые реакции. Состояние равновесия.Истинное равновесие. Стационарное и кажущееся равновесие. Константа равновесия.
- •18. Теория активации химических реакций.Механизм сложной химической реакции.
- •19. Закон Лавуазье-Лапласа.Закономерности изменения энтропии.
- •20. Виды химических реакций. Факторы, определяющие процесс реакции.
- •21. Химические реакции в твердой фазе.Способы инициирования реакций
- •22. Способы инициирования реакций Механохимия. Трибохимия
- •24. Виды диффузионных процессов в твердом теле.
- •25. Избыточная энтальпия.
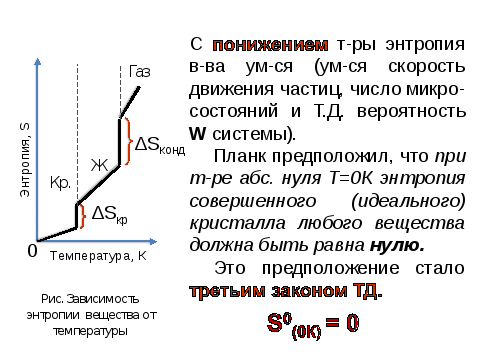
- •26. Третий закон термодинамики.
- •27. Растворы. Дисперсии. Истинные растворы.
- •28. Идеальные растворы. Закон Рауля и отклонения от него.
- •29. Закон действующих масс. Закон разбавления Оствальда
- •30. Термодинамика процесса растворения. Физическая и Химическая сторона процесса растворения. Теплота растворения.
- •31. Энтропия растворения.Энергия Гиббса.
- •32. Уравнение Нернста
- •34. Методы идентификации продуктов реакции
- •2. Структурный анализ
6. Энтропия, ее определение. Определение Клаузиуса и Планка. Второй закон термодинамики.
По закону сохранения энергии система может самопроизвольно совершать работу только за счёт собственной энергии, т.е. U 0. У химических реакций это выражается в виде экзотермического эффекта Н 0. Этот фактор является одной из движущих сил химической реакции и называется энергетическим (энтальпийным).Другой движущей силой является структурный (энтропийный) фактор. Для поиска критерия направления процессов в природе был сформулирован второй закон ТД.
1. Постулат Клаузиуса:теплота не переходит от холодного тела к горячему.
Из постулатов следует, что в обратимом процессе :
![]()
Это эквивалентно утверждению, что dQ/T есть дифференциал нек-рой функции состояния S, т.е.
![]()
Рудольф Клаузиус (1865) дал величине S имя «энтропия» – изменение.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
2. Определение энтропии Планка Больцмана:S = klnW
Л.Больцман (1877): термодинамическая вероятность W состояния системы – это число микросостояний, реализующих данное макросостояние: S = klnW
где S – энтропия; k – константа Больцмана.
![]()
Чем больше микросостояний у данного макро-состояния, тем оно более вероятно. Т.о.: Энтропия есть мера молекулярного беспорядка, представляющая логарифмическое выражение термодинамической вероятности состояния системы
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое изменение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
7. Классификация химических процессов. 1) по знаку; 2) по условиям протекания; 3) по самопроизвольности.
1) по знаку
эндотермический процесс - система получает тепло (+)
экзотермический процесс - система отдает тепло (–)

2) по условиям протекания
Параметры Процесс
Т - const изотермический
Р - const изобарный
V - const изохорный
3) по принципу самопроизвольности
Изобарно-изотермический потенциал (G) - критерий направления процессов
G < 0 - самопроизвольный процесс
G > 0 - несамопроизвольный процесс
G = 0 - состояние равновесия
8. Энтальпия образования сложного вещества. Стандартные условия.
Энтальпия образования сложного в-ва (H )- это тепловой эффект, который сопровождает образование 1 моль вещества из простых веществ в их устойчивых агрегатных состояниях (даже если в-во не может быть получено таким путем)
Например: K(тв)+1/2Cl2+3/2O2=KClO3(тв)
H = - 39,1кДж/моль
Для унификации измерений и возможности сравнения H их определение проводят в стандартных условиях:
Р = 101,3кПа (760 мм Hg, 1 атм)
T = 298,15К (25оC); n = 1 моль; для растворов концентрация - 1 моль/л
