
- •1. Термодинамика. Химическая термодинамика. Основные понятия. Термодинамическая система. Фаза. Классификация термодинамических процессов.
- •2. Системы гомогенные и гетерогенные. Основные параметры системы:
- •3. Понятие термодинамической функции. Внутренняя энергия, полная энергия системы. Устойчивость состояния системы.
- •4. Теплота, работа. 1-й закон термодинамики.
- •6. Энтропия, ее определение. Определение Клаузиуса и Планка. Второй закон термодинамики.
- •7. Классификация химических процессов. 1) по знаку; 2) по условиям протекания; 3) по самопроизвольности.
- •9. Энтропия образования вещества в результате химической реакции.Стандартная энтропия образования вещества (s ).Закономерности изменения энтропии.
- •10. Термодинамическое равновесие. Самопроизвольные процессы.
- •12. Влияние отдельных факторов на изменение энергии Гиббса.
- •16. Закон Гесса. Следствия из закона Гесса.
- •17. Обратимые и необратимые реакции. Состояние равновесия.Истинное равновесие. Стационарное и кажущееся равновесие. Константа равновесия.
- •18. Теория активации химических реакций.Механизм сложной химической реакции.
- •19. Закон Лавуазье-Лапласа.Закономерности изменения энтропии.
- •20. Виды химических реакций. Факторы, определяющие процесс реакции.
- •21. Химические реакции в твердой фазе.Способы инициирования реакций
- •22. Способы инициирования реакций Механохимия. Трибохимия
- •24. Виды диффузионных процессов в твердом теле.
- •25. Избыточная энтальпия.
- •26. Третий закон термодинамики.
- •27. Растворы. Дисперсии. Истинные растворы.
- •28. Идеальные растворы. Закон Рауля и отклонения от него.
- •29. Закон действующих масс. Закон разбавления Оствальда
- •30. Термодинамика процесса растворения. Физическая и Химическая сторона процесса растворения. Теплота растворения.
- •31. Энтропия растворения.Энергия Гиббса.
- •32. Уравнение Нернста
- •34. Методы идентификации продуктов реакции
- •2. Структурный анализ
18. Теория активации химических реакций.Механизм сложной химической реакции.
Теория активации Аррениуса
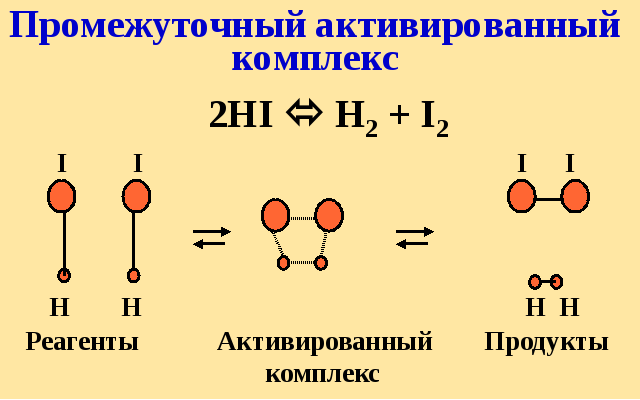
Хим. реакция может происходить только при столкновении активных частиц, т.е. тех, которые обладают характерной для данной реакции энергией, необходимой для преодоления сил отталкивания между электронными оболочками частиц.
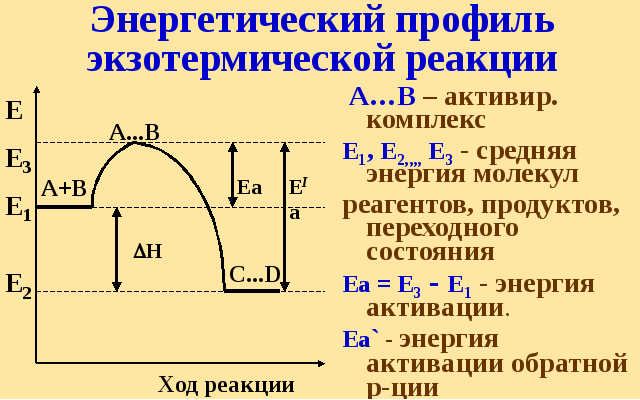
Энергия активации (Еа, кДж/моль) – это избыточный запас энергии молекулы над средне статистическим запасом энергии, позволяющий молекуле реализовать хим. Взаимодействие
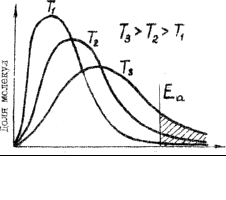
Cогласно молекулярно-кинетической теории газов для каждой системы существует порог энергии Еа , начиная с которого энергия достаточна для протекания реакции Еа меняется от 0 до 500кДж/моль.
Еа - велика, скорость реакции – мала
Еа – мала, скорость – велика
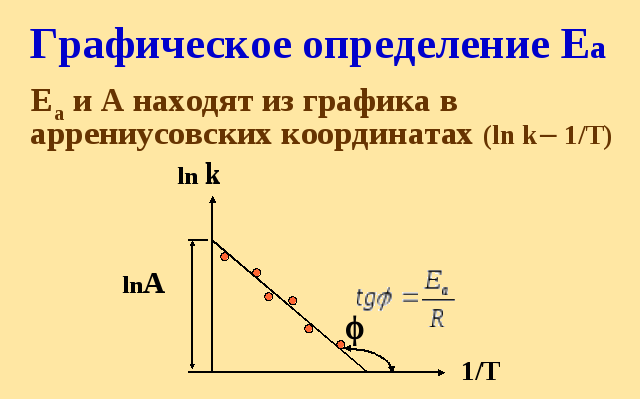
У![]() равнение
Аррениуса
равнение
Аррениуса
ПРЕДЭКСПОНЕНТА И ЭКСПОНЕНТА
П![]() редэкспоненциальный
множитель (А) дает некоторую характеристику
полного числа столкновений
редэкспоненциальный
множитель (А) дает некоторую характеристику
полного числа столкновений
доля результативных столкновений
Распределение молекул газа по их энергии при различных to (Исследования Максвелла – Больцмана)
При увеличении to доля молекул, имеющих энергию Еа увеличивается. Это приводит к увеличению скорости
Способы активации молекул
термический
светом
ионизирующее излучение
![]() ,
- излучение
,
- излучение
корпускулярные и др.
механохимическая
звуковая активация
19. Закон Лавуазье-Лапласа.Закономерности изменения энтропии.
Закон Лавуазье-Лапласа
Энтальпия разложения хим. соединения равна, но противоположна по знаку энтальпии его образования при одинаковых условиях
Нобр = –Нразл
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ. Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты (см. рис.). Реакция даже может идти со взрывом - так много энергии заключено в этом превращении. Такие реакции называются ЭКЗОТЕРМИЧЕСКИМИ от латинского "экзо" - наружу (имея в виду выделяющуюся энергию).

В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании.(см. рис.)
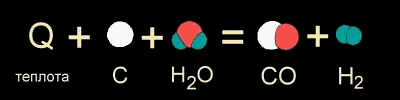
Закономерности изменения энтропии.
Sг>Sж>Sтв
S растет при растворении твердого или жидкого вещества и уменьшается при растворении газа
S растет с увеличением массы
S тем меньше, чем прочнее хим. связи, чем больше твердость в-ва
S растет с усложнением состава структурных единиц вещества
S простых веществ и однотипных соединений является периодическим свойством
Самопроизвольные процессы, происходящие на макроуровне идут с потерей части энергии на бесполезное нагревание системы, т.е. на беспорядочное движение микрочастиц:
S >H/ T
