
- •Билет 1.
- •Билет № 2
- •Химическое равновесие
- •Понятие об активном комплексе.
- •2.Серная кислота
- •Билет №3.
- •2. Современная химическая атомистика:
- •Билет 4.
- •1.Осмос и осмотическое давление. Закон Вант-Гоффа.
- •2. Сера. Её физические и химические свойства. Биологическая роль.
- •Билет 5.
- •Билет 8.
- •Хим. Свойства
- •Билет 12.
- •Химические свойства:
- •Билет 13
- •Билет 14
- •2. Координационная теория вернера Альфред Вернер ввёл в химию представления о соединениях высшего порядка и назвал их комплексными соединениями.
- •Билет 15.
- •1 Периодич.Закон д. И. Менделеева
- •2. Окислы азота
- •Билет 16.
- •Билет 19
- •1.Мышьяк. Его хим. И физ. Св-ва
2. Окислы азота
Оксид азота(I) Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2
Оксид азота NO2 (диоксид азота) — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:

и растворами щелочей:
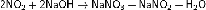
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO2. Этот оксид окисляет SO2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3
Билет 16.
1.Классификация
и изомерия комплексных соединений.
Комплексные
соединения – соединения высшего порядка,
в узлах кристаллических структур которых
находятся сложные ионы, способные к
самостоятельному существованию в р-рах
и расплавах.
Классификация
комплексных соединений:
-по классам
соединений
1) Комплексные кислоты
(H3[Fe(CN)6])
2)
Комплексные основания([Cu(NH3)4](OH)2
3)
Комплексные соли([Cu(NH3)4]SO4)
-по
природе лигандов (частиц, связанных с
центральным атомом)
1) Ацидокомплексы
(лиганды – кислотные остатки)
(K3[FeCN)4])
2)Аквакомплексы
(лиганды – молекулы воды) ([Cr(H2O)6]Cl3
)
3)Аммиакаты(образованные аммиаком)
([Cu(NH3)4]SO4)
4)Гидроксокомплексы
(лиганды – ОН- группы) (K3[Al(OH)4])
-по
знаку заряда комплекса
1) Катионные
комплексы ([Co(NH3)6]Cl3)
2)
Анионные комплексы (Li[AlH4])
3)
Нейтральные комплексы([Co(NH3)3Cl3])
-по
внутренней структуре комплекса
1)
Неоднородные комплексы (лиганды разной
природы входят в состав комплекса)
(Cr(NH3)4Br]SO4)
2)По
числу ядер различают моно- и полиядерные
комплексы ([(NH3)5Cr(OH)Cr(NH3)5]Cl5
– 2 иона хрома связаны ОН-«мостиком»)
В качестве мостиков могут функционировать
частицы, имеющие неподелённые эл. пары:
ионы F-, Cl
-, O 2- .
3) Сверхкомплексные
соединения (число лиганд превышает
к.ч.) ([Cu(H2O)4]SO4*H2O)
4)
По отсутствию и наличию циклов в составе
комплексных соединений различают
простые и циклические комплексные
соединения.
Комплексы, которые содержат
лиганды, связанные с 1 и тем же центральным
атомом несколькими связями – циклические
комплексные соединения.
Лиганды,
занимающие одно координационное место
– простые комплексные соединения.
Изомерия
комплексных соединений:
1)Гидратная
изомерия. Обнаруживается, когда
распределение молекул воды между
внутренней и внешней средой оказывается
неодинаковым.
СrCl3*6H2O
a)
[Cr(H2O)6]Cl3
b)
[Cr(H2O)5Cl]Cl2*H2O
c)
[Cr(H2O)4Cl2]Cl*2H2O
2)Ионизационная
изомерия. Связана с различной лёгкостью
диссоциации ионов из внутренней и
внешней среды комплекса.
a)
[Co(NH3)5Br]SO4
b)
[Co(NH3)5 SO4]
Br
3)Геометрическая
изомерия (цис-, транс- изомерия) Обусловлена
тем, что одинаковые лиганды располагаются
вокруг комплексообразователя либо
рядом (цис-положение), либо напротив
(транс-положение)
4) Координационная
изомерия. Встречается только у
дикомплексных соединений.
а)
[Co(NH3)6][Fe(CN)6]
б)
[Fe(NH3)6][Co(CN)6]
5)
Изомерия связи возникает тогда, когда
малодипольные лиганды могут координироваться
через 2 разных атома.
а) [(NH3)5-Ir-NO2]Cl2
б)
[(NH3)5-Ir-O-NO]Cl2
2.Щелочные
металлы. Биологическая роль.
Входят
в 1А группу, являются S-элементами
Электронная
ф-ла валентной оболочки nS1
, т.е. атомы имеют по 1 валентному электрону
на S-подуровне внешнего
энергетического уровня
Соответственно
устойчивая степень ок-ления +1
Все
элементы 1А группы сходны по св-вам, что
объясняется строением внешней электронной
оболочки (искл. – литий)
Li
Na
K
Rb
Cs
Fr
-
растёт радиус атома
- ослабевает связь
валентного электрона с ядром
-уменьшается
энергия ионизации
-растут основные
св-ва
-увеличение химической
активности
Комплексообразование
для ионов щелочных Ме малохарактерно,
т.к. у них устойчивая эл. структура,
большие заряды, малый заряд ядра.
Щелочные
металлы относятся к числу наиболее
активных в химическом отношении
элементов.
Хим. св-ва:
1) С
кислородом
- все щелочные Ме(кроме
лития)+кислород=пероксиды
2Na+O2=Na2O2
-литий
и все остальные Ме +кислород=
оксиды
2Ca+O2=2CaO
2)С
галогенами
Ме+галоген=соли
галогеноводородных к-т
2Na+Cl2=2NaCl
3)
С водородом
Активный
Ме+водород=гидрид
2Na+H2=2NaH
4)
С азотом (р-ия идёт при нагревании со
всеми Ме, кроме лития)
6Na+N2=2Na3N
– нитрид натрия
5) С серой (р-ия идёт
при нагревании со всеми Ме, со ртутью –
без)
2Na+S=Na2S
- сульфид натрия
6) С водой
Все
щелочные и щелочно-земельные металлы
при обычных условиях
Ме+вода=гидроксид
Ме+водород
2Na+2H2O=2NaOH+H2
7)
С кислотами
- с соляной, разбавленной
серной, фосфорной – Ме, стоящие до
водорода
Ме+кислота=соль+водород
Fe+H2SO4=FeSO4+H2
-
с концентрированной серной все, кроме
железа
Ме+кислота=соль+оксид серы(сера,
сероводород)+вода
-с азотной
к-той
Биологическая роль:
По
содержанию в организме человека натрий
и калий относятся к макроэлемантам, а
остальные металлы – к микроэлементам.
Щелочные Ме в виде различных соединений
входят в состав тканей человека и
животных.
Натрий и калий относятся к
жизненно необходимым элементам, постоянно
содержатся в организме, участвуют в
обмене в-тв.
- Соединения лития у
высших животных концентрируются в
печени, почках, селезёнке, лёгких, крови,
молоке. Максимальное его кол-во найдено
в мышцах.
Установлено, что некоторые
соединения лития оказывают положит.
влияние на больных с маниакальной
депрессией. Ионы, всасываясь в кровь и
достигая нужной концентрации, снижают
эмоциональное напряжение.
- Основное
кол-во натрия находится в костной ткани,
явл. Местом депонирования ионов Na+.
Участвуют в обменных процессах.
Na
распределён по всему организму в
сыворотке крови, спинномозговой жидкости,
глазной полости, пищ. соках и т.д..
Ионы
Na участвуют в передаче
нервных импульсов и поддерживают норм.
возбудимость мышечных клеток.
При
изменении содержания натрия в организме
происходит нарушение ф-ий нервной,
сердечно-сосудистой систем, гладких и
скелетных мышц.
NaCl –
основной источник соляной к-ты в
желудке.
-Соединения калия
распространены по всему организму.
В частности: печень, почки, сердце,
костная ткань.
Ионы К+ являются важными
активаторами ферментов, играет роль в
сокращении мышц, нормальном функционировании
сердца, проведении нервных импульсов.
Билет
17.
1.Ионная связь.
Первоначально Коссель считал, что при химическом взаимодействии разнородных атомов стремится приобрести конфигурацию внешней оболочки благородных газов. Это достигается отдачей и присоединением электоронов нейтральными атомами химических элеменотов. Атомы отдают свои электроны, превращаясь в положительно заряженные ионы (катион). Противополжны катионам-анионы. Химическая связь осуществляется за счет электростатических образовавшихся разноименных ионов ( В этом заключается сущность теории ионной связи). Согласно теории в решетке ионного кристалла (NaCl) происходит не только притягивание но и отталкивание одноименных ионов. В этих условия устойчивость подобных кристаллов объединяется тем, что расстояние между разноименными ионами меньше чем расстояние между одноименными. Поэтому кулоновские силы притяжения привелируют над отталкивающими, что и обеспечивает ионную связь. Однако идеальных ионнх соединений не существуют, а следовательно истенной ионной связи нет. При химическом взаимодействии наиболее электроотриательне и положительные электроны образуют соединения не со 100% ионной связью. Эффективный заряд атома в ходящий в состав соединения определяется как суммы его отрицательные и положительные заряда ядра.
2. Бор.
В больших количествах бор технической чистот получают посредством металлотермического восстановления его соединений активными металлами:
B2O3 + Mg = 3Mgo + 2B
Можно получить бор электролизом расплава Na[BF4]. Бор всокой чистоты получают восстановлением галогенидов бора водородом на расколенной танталовой проволоке или чистым цинком:
2Bcl3 + 3H2 = 6Hcl + 2В
2Bcl3 + 3Zn = 3Zncl2 + 2B
А так же разложение борановой и йодида бора при нагревании: B2H6 = 2B + 3H
2BI3 = 2B + 3I2
Электронная конфигурация невозбужденного атома бора 1S2 2s2 2p1. В большинстве своих соединений бор (III), однако в целом ряде случаев координационное число атома бора может возрасти до 4 за счет одной вакантной 2р-орбитали, участвующей в донорно-акцепторном взаимодействии. Наиболее характерная степень окисления бора в соединениях равна +3. Лишь в некоторых случаях реализоваться низшие степени окисления +2, +1. Кристаллический бор окрашен в темно-серый цвет, диамагнитен, полупроводник.
Из кислот на бор при нагревании действуют только лишь концентрированные H2SO4 и HNO3 и царская водка.
B + 3HNO3 = H3BO3 + 3NO2
Концентрированные щелочи на бор не действуют. Реакция же аморфного бора со щелочами протекает при кипячении и в присутствии окислителей
4B + 4NaOH + 3O2 = 4NaBO2 + 2H2O
Окисд бора( +3), борные кислоты.
Кристаллический оксид B2O3 образует несколько модиикаций, имеющих слоистое строение, плавится и кипит, соответственно при 577 и 1860 С.
Получают B2O3 посредством окисления бора кислородом при 700 с или обезвоживанием ортоборной кислот:
4В + 3О =(t) 2 B2O3
2H3BO3=(t) B2O3 + 3H2O
Соли борнх кислот. Их называют боратами. В большинстве своем в их составе содержится многоядерные полиборатные анионы, объединенне в цепи или циклы. Одной из весьма важных таких солей является натриевая соль тетраборной кислоты H2B4O7-тетроборат натрия, встречающийся в природе в виде минерала бур Na2B4O*10H2O/
Галогениды бора. Известны все галогениды бора помимо синтеза из простых веществ, они могут быть получен и косвенным путем. Например BF3 получают нагреванием смеси B2O3 с СaF2 в присутствии конц. H2SO4. Хлорированием оксида бора в присутствии углерода при t=700 можно получить
Bcl3
B2O3 + 3C + 3Cl = 2BCl3 + 3СО
С ростом размера атома галогена в молекуле увиличивается длинна связи и уменьшается ее энергия. Это приводит к падению устойчивостисоединений в ряду BF3-Bcl3-Bbr3-Bi3. Особенностью галогенидов бора является то, что они сильнее акцепторы электронов, а следовательно, являются кислотами Льюиса.
Соединения бора в низших степенях окисления (+2, +1)
Низшие степени окисления для бора не характерны, т.к. они разлагаются при комнатной температуре.
Биологическая роль бора
-
регулирует активность паратиреоидного гормона (гормон паращитовидных желез)
-
увеличивает всасывание кальция и магния, а также влияет на их обмен
-
влияет на обмен фосфора
-
способствует переходу витамина D в активную форму
-
снижает риск возникновения рака простаты
-
повышает уровень эстрогенов и тестостерона в крови.
Билет 18.
1. Ван-дер-ваальсовы силы(ВВ силы)
— силы межмолекуляр.(и межатомного) взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обознач.все такие силы, в современ. науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты ван дер Ваальсом в 1869 году. ВВ силы межатомного взаимодействия инертных газов обусловливают возможность сущ-ния агрегатных состояний инертных газов (газ, жид-ть и твёрд. тела). К ВВ силам относятся взаимодействия между диполями (постоян.и индуцированными). Название связано с тем фактом, что эти силы явл.причиной поправки на внутреннее давление в уравнении состояния реального газа ВВ. Эти взаимодействия в осн-м опр-ют силы, ответств-е за формирование пространств-й структуры биологических макромолекул. ВВ силы также возникают между частицей (макроскопич. частицей или наночастицей) и молекулой и между двумя частицами. ВВ взаимодействие состоит из 3типов слабых взаим-й: Ориентационные силы, диполь-дипольное притяжение. Осущ-ся между молекулами, явл.постоянными диполями. Примером может служить HCl в жид.и тверд. состоянии. Энергия такого взаимодействия обратно пропорц.кубу расстояния между диполями. Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаим-я обратно пропорц. шестой степени расстояния между диполями. Индукционное притяжение. Взаимодействие между пост.диполем и наведенным (индуцированным). Энергия такого взаим-я обратно пропорц. шестой степени расстояния между диполями.
2. Алюминий.
Al— лёгкий, парамагнитный металл серебристо-белого цв., легко поддающ.формовке, литью, механич.обработке. Аl обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образ. прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Легко реагирует с простыми в-вами: O2, Сl2, S, N2, С (Al4C3), H2 (AlH3).
Легко раств-ся в соляной и разбавл. серной к-тах:
2Al + 6HCl = 2AlCl3 + 3H2,
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
При нагревании раств-ся в к-тах -окислителях, образ-х растворимые соли алюминия:
2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O,
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe,
2Al + Cr2O3 = Al2O3 + 2Cr
Со щелочами: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2.
Al(OH)3— соединение оксида алюминия с водой. Белое студенистое в-во, плохо раств. в воде, обладает амфотерными свойствами. Получают при взаимод. солей алюминия с вод. р-рами щёлочи, избегая их избытка: AlCl3+3NaOH-> Al(OH)3+3NaCl. Свежеосаждённый гидроксид алюминия способен взаим-ть с: к-ми- Al(OH)3+3HCl->AlCl3+3H2O; щел-ми- Al(OH)3+NaOH-> Na3[Al(OH)6]. Высушенный гидроксид алюминия — представл.собой бел.кристаллич. в-во, нераств. в к-тах и щёлочах. Отдельные случаи взаимодействия гидрооксида алюминия с: гидрооксидом рубидия Al(OH)3 + 3RbOH (водн. р-р) —> Rb3[Al(OH)6], оксидом рубидия:2Al(OH)3 + Rb2O (сплав.) —> 2RbAlO2 + 3H2O,гидрооксидом цезия: Al(OH)3 + CsOH (сплав.) —> CsAlO2 + 2H2O, карбонатом цезия: 2Al(OH)3 + Cs2CO3 (сплав.) — 2CsAlO2 + 3H2O + CO2. Биологич. роль: В целом алюминий относят к токсич. (иммунотоксичным) элементам. Алюминий входит в состав множ-ва биомолекул, образовывая прочн.связи с атомами кислорода или азота. Алюминий явл. постоян. составной частью клеток, где преимущественно находится в виде Al 3+ . Его присутствие в том или ином виде обнаружено практич.во всех органах чел .Алюминий играет в организме важ. Физиологич. роль – он участвует в образов.фосфатных и белковых комплексов; процессах регенерации костной, соединит. и эпителиальной ткани; оказывает, в зависимости от концентрации, тормоз. или активирующее действие на пищеварит.ферменты; способен влиять на функцию околощитовид. желез. Алюминий в небольших к-вах необходим для организма, и особенно для костн.ткани, в случае же его избытка этот металл может представлять серьезную опасность для здоровья.
