
- •Билет 1.
- •Билет № 2
- •Химическое равновесие
- •Понятие об активном комплексе.
- •2.Серная кислота
- •Билет №3.
- •2. Современная химическая атомистика:
- •Билет 4.
- •1.Осмос и осмотическое давление. Закон Вант-Гоффа.
- •2. Сера. Её физические и химические свойства. Биологическая роль.
- •Билет 5.
- •Билет 8.
- •Хим. Свойства
- •Билет 12.
- •Химические свойства:
- •Билет 13
- •Билет 14
- •2. Координационная теория вернера Альфред Вернер ввёл в химию представления о соединениях высшего порядка и назвал их комплексными соединениями.
- •Билет 15.
- •1 Периодич.Закон д. И. Менделеева
- •2. Окислы азота
- •Билет 16.
- •Билет 19
- •1.Мышьяк. Его хим. И физ. Св-ва
Хим. Свойства
-
Легко окисляется O2 4P+5O2=2P2O5
-
Взаимодействует со многими простыми веществами (галогены, сера, некоторые металлы)
Ca+2P= Ca3P2 (фосфид) – разлагается водой и кислотами до фосфина (PH3)
2P+3S=P2S3
-
Не взаимодействует с H2
-
С водой 8P+12H2O=5Ph3+3 H3Po4
-
Со щелочами 4P+3KoH+3H2O=PH3+3KH2PO2
-
Восстановительные свойства: 3P+5HNO3 +2H2O=3H3Po4+5NO
Биологические св-ва: Присутствует в клетках в виде пиро-орто-фосфатов, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, ферментов. Кости человека состоят из гидромитапа 3Ca(Po4)3 *Ca(oh)2. В состав зубной ткани входит фторапатит. Основная роль в превращениях соединений фосфора играет печень, объем фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре800-1500 мг. При недостатке фосфора развиваются различные болезни костей.
Билет 12.
1.Водородные соединения галогенов. Галогеноводородные кислоты.
Галагеноводороды – общие названия соединений, образованных из галогенов и водорода.
Химическая связь в газообразных галогеноводородах (НГ) полярная ковалентная. Электронная пара, осуществляющая связь, сильно смещена к более электроотрицательному галогену. С точки зрения МВС химическая связь в НГ имеет одинаковый характер:
С ростом ионного радиуса свойства НГ изменяются
HF сверху вниз: снижается прочность химической связи, понижается степень перекрывания
HCl орбиталей атомов галогена и водорода, увеличивается межядерное расстояние,
HBr увеличивается восстановительная активность
HI
В НГ галогены имеют степень окисления -1. При комнатной температуре молекулы НГ образуются за счет водородных связей. Галогеноводороды – бесцветные газы с резким запахом, хорошо растворимые в воде (кроме HF – жидкость). На воздухе их концентрированные растворы дымят, вследствие выделения галогеноводородов
Химические свойства:
Особенности HF: SiO2+4Hf=SiF4+2H2O
Кач.реак. NaCl(Br, I) + AgNo3 – AgCl(белый), AgI(желтоватый), AgBr(желтый)+NaNo3
NaF+CaCl2=CaF2(белый)+ 2NaCl
-
При повышенной температуре окисляют активные Ме Mg+2HCl=MgCl2+H2
-
Могут проявлять свойства восстановителей. 2HI+Cl2=2HCl+I2
-
Могут участвовать в реакции присоединения с органическими веществами.
-
Как кислоты могут взаимодействовать с Ме, оксидами, солями, амфотерными гидроксидами, щелочами
-
Хорошие комплексообразователи 2Ag+4HI=2H[AgI2]
Биологические свойства: Разбавленный раствор соляной кислоты (8%) применяется в медицине для повышения кислотности желудочного сока с целью восстановления нормальной pH среды и пищеварения.
2.Метод молекулярных орбиталей
Если бы мы рассматривали молекулу О3 со стороны МВС, то она была бы представлена в виде правильного треугольника с ординарными связями между атомами кислорода. Однако экспериментальные измерения опровергают этот прогноз. Чтобы согласовать эксперимент и теорию, следует предположить, что одна из трех электронных пар равномерно распределена по всей молекуле О3 или, как говорят, делокализована. Делокализация электронов с точки зрения квантовой механики означает, что электроны в молекулах совершают движение по всей молекуле, а не только в пределах какого-то одного атома. Волновую функцию Ψ(пси) , определяющую область наиболее вероятного нахождения и энергетического уровне в молекуле, называют молекулярной орбиталью. Теория, использующая представление о молекулярных орбиталях для расчета различных характеристик молекул, получила название метод молекулярных орбиталей. Математическая сущность ММО заключается в построении молекулярных орбиталей на основе орбиталей атомов, образующих молекулу. Если молекула состоит из атомов А, В, С с атомными орбитами φА, φВ, φС, то волновая функция молекулы:
Ψ=фА+- фВ+-фС (+- - плюс/минус)
Данная сумма называется линейной комбинацией атомных орбиталей (МО ЛКАО)
Точно можно это рассмотреть на примере молеулы H2: (рисунок должен быть, но его нет)
Понятия, которые входят в ММО
-
n – главное квантовое число, целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень (1,2,3… бесконечность)
-
Орбитальное квантовое число
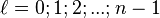 .
Величина ОКЧ определяет форму атомной
орбитали и орбитальный подуровень
энергии Ene главного
энергетического уровня
.
Величина ОКЧ определяет форму атомной
орбитали и орбитальный подуровень
энергии Ene главного
энергетического уровня
Е = 0 Ф.ор. сфеерическая/ s-орбиталь
Е=1 Ф.ор. знак бесконечности / р – орбиталь
Е= 2 Ф.ор. четырехлопастная / d – орбиталь
-
Магнитное квантовое число m. Это число принимает целые значения 0, +-1,+-2/ +-е
Эти значения определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне Ene
-
Спиновое квантовое число s принимает два значения : +1/2 и -1/2
Характеризует собственное вращательное движение электрона. На каждой атомной орбитали двум значениям S=+-1/2 отвечают вращения по и против часовой стрелки.
