
- •Билет 1.
- •Билет № 2
- •Химическое равновесие
- •Понятие об активном комплексе.
- •2.Серная кислота
- •Билет №3.
- •2. Современная химическая атомистика:
- •Билет 4.
- •1.Осмос и осмотическое давление. Закон Вант-Гоффа.
- •2. Сера. Её физические и химические свойства. Биологическая роль.
- •Билет 5.
- •Билет 8.
- •Хим. Свойства
- •Билет 12.
- •Химические свойства:
- •Билет 13
- •Билет 14
- •2. Координационная теория вернера Альфред Вернер ввёл в химию представления о соединениях высшего порядка и назвал их комплексными соединениями.
- •Билет 15.
- •1 Периодич.Закон д. И. Менделеева
- •2. Окислы азота
- •Билет 16.
- •Билет 19
- •1.Мышьяк. Его хим. И физ. Св-ва
Билет № 2
1. Скорость химических реакций и химическое равновесие. Понятие об активном комплексе и энергии активации.
Скорость химич. реакции- это число элементарных актов взаимодействия, происходящих в единицу времени в единице объема для гомогенных реакций .
V=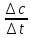
Факторы влияющие на скорость химических реакций:
1.концентрация реагирующих веществ : чем больше конц, тем больше скорость , т.к. увеличивается число столкновений между частицами.
2.температура
3.степень смещения
4.освещение
5.площадь соприкосновения в-в
1) во сколько раз увеличится давление, во столько раз мы и увеличится концентрацию
2)природа реагирующих веществ. Если в реакции участвуют неметаллы , то наиболее активно будут реагир. Неметаллы стоящие ближе к фтору. Если в реакции участвуют металл, то чем активнее металл , тем больше скорость.
3) температура , зависимость скорости от температуры определяется правилом Вант-Гофа:
А)при нагревании темп. На каждые 10 град. , скорость увеличивается в 2,3,4 раза.
ɣ= ɣ-
температу коэфф
показывает во сколько раз изменится
скорость при нагревании.
ɣ-
температу коэфф
показывает во сколько раз изменится
скорость при нагревании.
3)катализатор – вещество ускоряющее реакцию , учавст. В ней , но в итоге не расходуется.
4)давление влияет на скорость химич. Веществ , если хотя бы одно из них находится в газообразном состоянии.
Химическое равновесие
Обратимые реакции-это реакции которые при одних и тех же условиях протекают в противоположном направлении. Обратимые реакции заканчиваются установлением химического равновесия , т.е. когда скорость прямой реакции равна скорости обратимой реакции.
Условия смещения химического равновесия определяется принципом Ле-Шетелье:
Если на систему , находящуюся в сост химич равновесия , производит воздействие (измен. Температуру , давление, конц.) , то из двух противоп. Реакций с большой скоростью будет идти та реакция , которая ослабляет наше воздействие.
-
Изменение концентрации: при увеличении конц. исходных веществ или уменьшении конц. Продуктов реакции , хим. Равновесие смещается в право.
-
Температура: а) при повышении темп. Химич. Равновесие смещается в сторону эндотермической реакции, б) при понижении темп. хим. равнов. Смещается в сторону экзотермической реакции.
-
Катализатор не влияет на смещение хим. Равновесия , а только ускоряет его наступление
-
При увеличении давления хим. Равновесие смещается в сторону уменьшения давления и наоборот .
Понятие об активном комплексе.
Для того чтобы пошла реакции недостаточно одного лишь столкновения молекул. Необходимым условием для реакции должно быть наличие активных частиц , способных к взаимодействию.
Уравнение
Аррениуса:
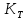 =
=
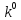 exp(-Eq/RT)
, где Eq-
аррениусовая энергия активации,
T-абсолютная
температура, R-универсальная
газовая постоянная ,
exp(-Eq/RT)
, где Eq-
аррениусовая энергия активации,
T-абсолютная
температура, R-универсальная
газовая постоянная ,
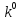 -
предэкспоненциальный множитель.
-
предэкспоненциальный множитель.
Энергия активации- энергия необходимая для совершения реакции. Подавляющее большенство хим. Процессов протекающих не через полный разрыв связи между атомами в молекулах исход. Подавляющих большинству химич. процессов протекающих не через полный разрыв связи между атомом в молекуле исходного вещества ,а через образование активного комплекса , в котором исодные связи еще не разорвались , а новые не до конца образовались .
Но реакции через активный комплекс энергически более выгоден , чем ее протекания через полный разрыв связи.
Теория активных столкновений. Эта теория базируется на двух общих положениях.: -реакция осуществляется в момент столкновения двух молекул А и В; -столкновение приводит к хим превращению только в том случае, когда молекулы А и В обладают достаточно большим запасом энергии.
В теории активированного комплекса – результат взаимодействия 2-х частиц- яв-ся переходным состоянием , в котором старые связи разрушаются, а новые еще не об-сь-активированный комплекс. - происходит распад активного комплекса с образованием продукта.
