
- •Билет 1.
- •Билет № 2
- •Химическое равновесие
- •Понятие об активном комплексе.
- •2.Серная кислота
- •Билет №3.
- •2. Современная химическая атомистика:
- •Билет 4.
- •1.Осмос и осмотическое давление. Закон Вант-Гоффа.
- •2. Сера. Её физические и химические свойства. Биологическая роль.
- •Билет 5.
- •Билет 8.
- •Хим. Свойства
- •Билет 12.
- •Химические свойства:
- •Билет 13
- •Билет 14
- •2. Координационная теория вернера Альфред Вернер ввёл в химию представления о соединениях высшего порядка и назвал их комплексными соединениями.
- •Билет 15.
- •1 Периодич.Закон д. И. Менделеева
- •2. Окислы азота
- •Билет 16.
- •Билет 19
- •1.Мышьяк. Его хим. И физ. Св-ва
Билет 8.
1.Метод валентных связей.
Был впервые применен немецким ученым гейтлером и лондоном при при рассмотрении молкулы водорода.
Рассматривая два атома водорода,находящихся на расстоянии гораздо большем,чем радиус орбитали.(На таком расстоянии электроны и ядра разных атомов взаимодействуют очень слабо)
При постепенном сближении атомов взаимодействие возрастает и когда расстояние между ядрами становится меньше радиуса орбитала происходит перекрывание электронных орбиталь.При таком сближении они уже не могут двигаться независимо.
Хим.связь между атомами возникающую между ВС путем перекрывания атомных орбиталей и обобщения электрон.пары называется ковалентной.
Т.О. вследствие перекрывания орбиталей атомы постоянно обмениваются электронами,если их спиновые числа противоположны по знаку.
Противоположная направленность спинов обусловлена принципом Паули,который запрещает электронам с одинаковыми спиновыми числами находится на одной орбитали.
В результате обмена электрона между атомами возникает сильное притяжение.Такой тип взаимодействия называется обменным(90% от связи).
Помимо обменного взаимодействия,определенный вклад в энергию атм.связи вносят кулоновские силы,действующие между электронами и ядрами.
Т.О. энергия взаимодействия между атомами складывается Е=Еоб+Еq
И так в итоге в основе метода ВС лежат полодения:
1.Ковалентная связь образуется двумя электронами с противоположно направленными спинами,причем эта элетрон.пара принадлежит двум атомам.
2.Ковалентная связь тем прочнее,чем больше степени перекрывания электрон.облаков.
2.Благородные газы.
Благородные газы это элементы 8 А группы.Имеют элетронную конфигурацию
По мере возрастания порядкового номера растут атомные радиусы и их поляризуемость.
Поляризация-физическое свойство веществ приобретать электрический или магнитный дипольный момент во внешнем электромагнитном поле.
Это приводит к усилению межмолекулярных взаимодействий,и повышению температур плавления и кипения,к увеличению растворимости газов в воде и др.растворителях.
Низкая химическая активность связана с тем,что внешние электронные оболочки полностью заполнены(2 электрона у гелия и по 8 у остальных),что не допускает никаких валентных связей.
Благородные газы кристаллизуются в кубической гранецентрированной решетке.
В небольших количествах они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Инертные газы отличаются крайне низкой хим.активность.
Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он сильно радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Атомы благородные газы имеют полностью заполненные внеш. электронные оболочки (s2 для Не и s2p6 для всех остальных), что обусловливает их низкую реакционную способность. Благородные газы (кроме Не) получают как побочные продукты при производстве N2 и О2 из воздуха. Гелий выделяют из подземных гелионосных газов. Используют благородные газы в качестве инертной среды в металлургии, атомной и ракетной технике, в производстве полупроводниковых материалов и других, как наполнитель в электронике, электротехнике и др., рабочее вещество в лазерной технике.
При повышенных давлениях благородные газы оказывают вредное действие на нервную систему (усиливающееся с увеличением атомной массы элемента), которое быстро проходит при вдыхании чистого воздуха.
Биологическое действие.
Энертные газы не ядовиты,однако атмосфера с увеличением концентрации инертных газов и соответственным снижением концентрации кислорода может оказывать удушающее воздействие на человека вплоть до потери сознания или смерти.
Вдыхание радиоактивного радона может вызывать рак.
Инертные газы обладают биологическим действием которое проявляется в наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в след.порядке: Xe,Kr,Ar/Ne,He
Кардиотическое действие неона и гелия в опытах не регистрируется,так как под давлением возникают др.симптомы ”нервного синдрома высокого давления”.
Билет 9.
1.Теория электролитической диссоциации. Константа и степень электролитической диссоциации.
Теория эл. диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887г. была предложена теория электролитической диссоциации.
Современное содержание этой теории можно свести к следующим трем положениям:
-
Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные. Ионы находятся в более устойчивых эл? состояниях, чем атомы. Состоят из одного атома – простые ионы (Na+, Mg2+) из двух – сложные (NO3-, SO42-)
-
Под действием эл. тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательные – к амоду (поэтому первые называются катионы, а вторые – анионы)
-
Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях ЭД вместо знака равно стоит знак обратимости:
KA ⇄ K+ + A-
Константная степень электролитической диссоциации
Электролитической диссоциацией называют процесс распада молекул на ионы под действием растворителя. Вещества, молекулы которых подвергаются диссоциации, называются электролитами. К ним относятся кислоты, гидроксиды, соли. Причиной диссоциации является взаимодействие между растворенным веществом и растворителем, в результате которого в растворе образуются гидратированные ионы:
КА + (n+m)H2O ↔ [K(H2O)n]+ + [A(H2O)m]-
В хим. литературе уравнения электролитич диссоциации обычно символизируют только процесс распада молекул электролитов на ионы, не включая связанные с ним процессы гидратации (сольватации) образовавшихся ионов. Это связано со сложностью установления количества молекул растворителя, образующих сольватную оболочку. Одним из главных отличий электролитов от неэлектролитов является способность их в водных растворах проводить электрический ток. При погружении в водный раствор электролита электродов, подключенных к источнику постоянного тока, положительно заряженные ионы (катионы) будут перемещаться к отрицательному электроду – катоду, а отрицательно заряженные ионы (анионы) к положительно заряженному электроду – аноду. Ионы могут быть простыми, например: Na+, H+, Ca2+, Al3+, Cl-, S2- и др, и сложными:OH-, SO42-, PO43- и др. Степень диссоциации α- выражается отношением числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n+N):
α
=
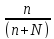 или
α =
или
α =
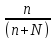 * 100%
* 100%
Степень электролитической диссоциации α зависит от природы растворенного вещества и растворителя, температуры, концентрации раствора (величина эта тем больше, чем более разбавлен раствор), добавления одноименных ионов (α понижается). Степень диссоциации различных электролитов при постоянной температуре и концентрации колеблется в широких пределах. Электролиты называются сильными, если α > 0,3 (>30%). К ним относятся многие к-ты (H2SO4, HNO3, HCl, HBr, HI, HClO4, HMnO4, H2Cr2O4 и др.), гидроксиды щелочных и щелочноземельных металлов, почти все растворимые соли.
Электролиты называются слабыми, если α < 0,03 (α <3%). К ним относятся многие к-ты (НNO2, HF, H2CO3, H2SiO3, H3BO3 и др.), вода, водный раствор аммиака NH3 * H2O, гидроксиды метал. и др.
Иногда в отдельную группу выделяют электролиты средней силы: H3PO4, H2SO3, H2C2O4. Их значения степени диссоциации (α) находятся в интервале от 0,03 до 0,3. Для более точной оценки силы слабых электролитов служит константа электролитич. диссоциации (Кд). Константа электролитической диссоциации характеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией нераспавшихся на ионы молекул электролита.
В общем виде для процесса электролитич диссоциации, выражаемого уравнением:
KmAn
 mKn+
+ nAm-
mKn+
+ nAm-
константа диссоциации (Кд) равна:
Кд
=

Напр., для HF выражение Кд имеет следующий вид:
HF
 H+
+ F-
H+
+ F-
Кд
=
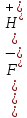
Значение Кд зависит от природы электролита, природы растворителя, температуры и не зависит от концентрации раствора. Данное свойство Кд позволяет определить силу слабых электролитов, пользуясь табличными значениями Кд. Чем больше Кд к-ты (основания), тем сильнее к-та (основание). Например, Кд HCN = 7,2 * 10-10; Кд HF = 7,2 *10-4, следовательно, плавиковая к-та (HF) более сильная, чем синильная (HCN).
Cтупенчатая дисс-ция
Многоосновные к-ты и многокислотные основания в водных растворах диссоциируют ступенчато, т.е. вначале от молекулы отщепляется один из ионов, затем другой и т. д. Каждая такая ступень характеризуется своей константой – ступенчатой костантой дисс-ции
Например, серная к-та H2SO4 – сильная двухосновная к-та, диссоциирует в две ступени.
I
ступень:
H2SO4
 H+
+HSO4-
H+
+HSO4-
II
ступень:
HSO4-
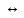 H+
+
SO42-
H+
+
SO42-
Степень дисс-ции (α) серной к-ты по каждой ступени близка к 1, поэтому для серной к-ты можно записать суммарное уравнение дисс-ции:
H2SO4
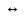 2H+
+ SO42-
2H+
+ SO42-
Для слабых многоосновных кис-т суммарное уравнение дисс-ции писать некорректно, т.к. наибольшую конц-цию ионов водорода обеспечивает дисс-ция по I ступени.
I
ступень:
H2S
 H+
+
HS-
КдI
=
8,9 * 10-8
H+
+
HS-
КдI
=
8,9 * 10-8
II
ступень:
HS-
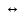 H+
+
S2-
КдII
=
1,3 * 10-15
H+
+
S2-
КдII
=
1,3 * 10-15
КдI > КдII
Значения 2х констант дисс-ции показывают, что процесс дисс-ции во второй ступени практически не протекает. Все вышесказанное относится и к растворам многокислотных сильных и слабых гидроксидов (оснований)ю Например, гидроксид бария Ba(OH)2 – сильный гидроксид:
I
ступень: Ba(OH)2
 BaOH+
+ OH-
BaOH+
+ OH-
II
ступень: BaOH+
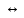 Ba2+
+ OH-
Ba2+
+ OH-
Cуммарное
уравнение: Ba(OH)2
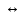 Ba2+
+ 2OH-
Ba2+
+ 2OH-
Гидроксид магния Mg(OH)2 - слабый гидроксид:
I
ступень:
Mg(OH)2
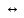 MgOH+
+ OH-
MgOH+
+ OH-
II
ступень:
MgOH+
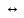 Mg2+
+ OH-
Mg2+
+ OH-
Азотная кислота и ее свойства
Азотная кислота – сильная кислота, в разбавленных водных растворах полностью диссоциирует на ионы:
HNO3
 H+
+ NO3-
H+
+ NO3-
Физические свойства:
Это
одна из важнейших неорганических кислот.
Она представляет собой индивидуальное
вещ-во, бесцветную жидкость, кипящую
при 86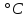 и затвердевающую при -42
и затвердевающую при -42 .
Смешивается с водой в любых соотношениях,
характерен резким запахом.
.
Смешивается с водой в любых соотношениях,
характерен резким запахом.
2.Азотная кислота и её свойства.
Атомные
орбитали азота Sp2
гибридны. Образуют
с p
орбиталями трех атомов кислорода при
G
– связи. Свободная p-орбиталь
атома азота перекрываясь с аналогичными
р-орбиталями двух атомов кислорода
образует
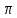 -
связь. Кроме того, один из атомов кислорода
связан G-связью
с атомом водорода.
-
связь. Кроме того, один из атомов кислорода
связан G-связью
с атомом водорода.
Хим. свойства:
Является сильным окислителем
-
Разбавленная азотная кислота проявляет все свойства сильных кислот, в водных растворах она диссоциирует по следующей схеме:
HNO3 = H+ + NO3-
безводная кислота:
2HNO3 = NO2 + NO3- + H2O
Постепенно, особенно на свету или при нагревании азотная кислота разлагается, при хранении раствор становится коричневатым из-за диоксида азота:
4HNO3 = 4NO2 + 2H2O + О2
-
Азотная кислота взаимодействует почти со всеми металлами. Разбавленная азотная кис-та со щелочными и щелочноземельными металлами, а также с железом и цинком образует соответствующие нитраты, нитрат аммония или оксид азота(I) в зависимости активности метала и воду:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O,
5Fe + 12HNO3 (оч.разб) = 5Fe(NO3) 3 + N2 +6H2O,
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Концентрированная азотная кислота при взаимодействии со щелочными металлами образует соответствующие нитраты, воду и выделяется оксид азота(I)
8Na + 10HNO3 = 8NaNO3 + N2O + 5H2O
Такие металлы как железо, хром, алюминий, золото, платина, иридий, тантал
Концентрированная кислота пассивирует, т.е. на поверхности металла образуется пленка оксидов не проницаемая для кислоты. Другие тяжелые металлы при взаимодействии с концентрированной азотной кислотой образуют соответствующие нитраты, воду и выделяется оксид или диоксид азота:
Ag + 2HNO3 = Ag NO3+ N2O + 5H2O
Обычно процесс восстановления идет в нескольких направлениях в зависимости от силы восстановителя, концентрации и температуры.
-
Азотная кислота способна растворить золото, платину и другие благородные металлы. Но в смеси с соляной кислотой в отношении 3 объема концентрированной соляной кислоты и один объем концентрированной азотной кислоты называют «царской водкой». Действие царской водки заключается в том, что азотная кислота окисляет соляную до свободного хлора, который соединяется с металлами:
HNO3 + HCl = Cl2 + 2H2O + NOCl
2NOCl = 2NO + Cl2
Царская водка способна растворить золото, платину, родий, иридий и тантал, которые не растворяются ни в азотной, а уж тем более в соляной кислоте:
Au + HNO3+ 3HCl = AuCl3 +NO+NOCl
HCl + AuCl3 = H[AuCl4]
-
Неметаллы также окисляются азотной кислотой до соответствующих кислот, разбавленная кислота выделяет оксид азота:
3P + 5HNO3 +2H2O = 3H3PO4 +5NO
Концентрированная кислота выделяет диоксид азота:
S + 6HNO3 = H2SO4 + 6NO2 +2H2O
Ge + 4HNO3 = GeO2 + 4NO2 +2H2O
Азотная кислота способна также окислять некоторые неорганические соединения:
3H2S
+ 8HNO3
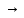 3H2SO4
+ 8NO + 4 H2O
3H2SO4
+ 8NO + 4 H2O
-
Азотная кислота взаимодействует также со многими органическими веществами.
-
Качественная реакция на азотную кислоту «проба коричневого кольца» - взаимодействие с раствором сульфида железа и серной кислоты, в случае присутствия азотной кислоты выпадает в осадок коричневый комплекс:
2HNO3
+
FeSO4
+ 3H2SO4 2|Fe(NO)|SO4
+ 3Fe2(SO4)3
+ 4H2O
2|Fe(NO)|SO4
+ 3Fe2(SO4)3
+ 4H2O
Получение азотной кислоты.
-
Промышленный способ. Каталитическое окисление аммиака до оксида азота:
4NH3
+ 5O2
(800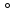 C,
Pt(+10%Rh)) = 4NO + 6H2O
C,
Pt(+10%Rh)) = 4NO + 6H2O
Окисление оксида азота в избытке кислорода до диоксида азота, для ускорения реакции снижают температуру и давление:
2NO + O2 = 2NO2
Поглощение диоксида азота водой в присутствии избытка кислорода:
4NO2 + 2H2O + O2 = 4HNO3
-
В лаборатории азотную кислоту получают действием концентрированной серной кислоты на кристаллические нитраты калия или натрия:
KNO3 + H2SO4 = K HSO4 + HNO3
-
Разложение азотистой кислоты:
HNO2 = HNO3 + 2NO +H2O
Применение азотной кислоты. Для производства комплексных и азотных удобрений, минеральных кислот, взрывчатых веществ, красителей. Применяется для травления и растворения металлов в металлургии. Дымящая азотная кислота в качестве окислителя ракетного топлива.
Биологическая роль.
Азотная кислота применяется для производства многочисленных лекарственных средств.
10 билет.
1.Окислительно-0восстановительные реакции.
Окислительно-восстановительными реакциями называют хим. процессы, сопровождающиеся переносов электронов от одних молекул или ионов к другим.
При ОВР протекают два взаимосвязанных процесса: окисление и восстановление.
Окисление - процесс потери электронов.
Восстановление - процесс присоединения электронов.
Вещества (атомы) ионы которых отдают электроны, называют восстановителями.
Присоединяют электроны окислители.
СО. Одним из основных понятий неорг. химии является понятие о степени окисления.
СО - формальный заряд атома элемента, вычисляемый из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
При окислении элемента СО увеличивается. Восстановление уменьшается.
Таким образом можно дать еще одну формулировку ОВР: это реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Окислители и восстановители
-Типичными окислителями являются простые в-ва, атомы которых имеют большую ОЭО>3,0.
Из наиболее сильных окислителей известны: KMnO4, MnO2, K2Cr2O7, K2CrO4, HClO, HClO3, H2SO4(к), HNO3(к), H2O2.
-К типичным восстановителям относятся простые в-ва, атомы которых имеют малую ОЭО<1,5.
Представители: H2S, NH3, C, H2, CO, H2SO3.
Вещества содержащие атомы в макс. Или мин. Степени окисления являются соответственно только окислителями/восстановителями.
Виды ОВР:
1)Межмолекулярные-реакции в которых окисляющиеся или восстанавливающиеся атомы находятся в молекулах разных в-в.
Пример:
H2S+CL2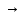 S+2HCL
S+2HCL
2)Внутримолекулярные-реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же в-ва.
Пример:
2H2O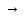 2H2+O2
2H2+O2
3)Диспропорционирование (самоокисление-самовосстановление) реакции в которых один и тот же элемент выступает как окислитель и как восстановитель
Пример:CL2+H2O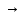 HCLO+HCL
HCLO+HCL
4)Репропорционирование – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления.
Пример:NH4NO3 N2O+2H2O
N2O+2H2O
2.Аммиак и его свойства
Аммиак NH3- бесцветный газ с резким запахом, очень хорошо растворим в воде.
(В мед. Практике применяют 10%-ный р-р аммиака, нашатырный спирт для вывода из обморочного состояния)
В молекула аммиака атом азота находится в состоянии sp3- гибридизации:
Присутствие одной из гибридных орбиталейнеподеленной пары эл. Определяет способность атома азота в аммиаке к образованию связей с др.атомами или ионами по донорно-акцептороному механизму.
Химические свойства аммиака
1.Взаимодействие с простыми веществами:
4NH3+3O2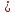 2N2+6H2O
2N2+6H2O
2NH3+2Na=2NaNH2+H2
2.С водой аммиак образует гидрат аммиака или гидроксид аммония, который дает щелочную среду:
NH3+H2O=NH3H2O(NH4+ + OH- )
3.При взаимодействии с кислотами образует соли аммония:
2(NH3H2O)+H2SO4=(NH4)2SO4+H2O
Пары аммиака и соляной кислоты образуют белый дым хлорида аммония:
NH3+HCl=NH4Cl
4.Восстанавливает оксид меди:
2NH3+3CuO=3Cu+N2+3H2O
5.Качественные реакции на аммиак.Как было указано выше,образование белого дыма в присутствии хлороводорода. Изменение голубого раствора медного купороса на ярко-синий:
4NH3+CuSO4+H2O= [Cu(NH3)4]SO4H2O
При взаимодействии с реактивом Несслера K2[HgI4] выпадает в осадок красно-коричневый хлопьевидный комплекс HOHgNHHgI.
Почернение бумажки смоченной раствором динитрата ртути Hg2(NO3)2 из-за выделения металла.
Получение аммиака
1.В промышленности, взаимодействием азота с водородом:
N2+3H2(500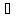 ,
25 МПа, Fe+MeOH+SiO2)=2NH3
,
25 МПа, Fe+MeOH+SiO2)=2NH3
2.В лаборатории взаимодействием соли аммония со щелочью:
NH4CL+KOH=KCL+H2O+NH3
Разложением нитридов металлов водой:
Mg3N2+6H2O=3Mg(OH)2+2NH3
Взаимодействием нитрата натрия с цинком в щелочной среде:
NaNO3+4Zn+7NaOH+6H2O=NH3+4Na2[Zn(OH)4].
Биологические свойства.
Высокие концентрации аммиака вызывают состояние удушья, сильное слезоточение, рвоту, головокружение, приступы кашля, боли в желудке. Нарушение обменных процессов в коре головного мозга и способность организма усваивать кислород.
В случае сильных отравлений может развиваться отек гортани и легких, остановиться дыхание, развиться сердечная недостаточность, приводящая к летальному исходу.
В практике в качестве мочегонного средства используют соль аммиака NH4CL. Так же эта соль служит средством против защелачивания крови.
Билет 11.
Гибридизация атомных орбиталей.
Гибридизация – образование одинаковых по энергии и форме орбиталей атома в результате сложения разных по энергии и форме орбиталей при возбуждении этого атома
(Л.Полинг в 1901г. Предложил усовершенствовать метод ВС . Он выдвинул дополнительные положения о возможности гибридизации атомных орбиталей при образовании химической связи.)
При образовании молекулы (с гибридными орбиталями) форма и взаимное расположение атомных электронных облаков (*) изменяется по сравнению с их формой и расположением в свободных атомах. В результате достигается более полное перекрывание орбиталей(*) при образовании химической связи. Такая деформация электронных облаков требует затраты энергии, но более полное перекрывание приводит к образованию более прочной связи , и в целом получается выгодным энергетически. Этим и объясняется возникновение гибридных орбиталей.
Форма гибридной орбитали может определяться математически путем сложения волновых функций исходных орбиталей:
В результате сложения волновых функций s- и p- орбиталей с учетом их знаков оказывается, что плотность электронного облака по одну сторону от ядра повышена, а по другую – понижена.
Процесс гибридизации включает следующие этапы:
- возбуждение атома(*)
-гибридизация орбиталей возбужденного атома, образование связей с другими атомами
(Затраты энергии на первые два этапа происходят с выигрышем энергии при образовании более прочных связей с гибридными орбиталями)
Тип гибридизации определяется типом и количеством участвующих в ней орбиталей.
-
Гибридизация одной s- и одной p- орбитали (sp-гибридизация) происходит при образовании галогенидов берилия, цинка, кадмия, ртути (Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s – электрона, в результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона , из которых один s, а другой p – электрон. При образовании химической связи (*) эти две различные орбитали преобразуются в две одинаковые гибридные орбитали (sp-орбитали), направленные под углом 180 градусов друг к другу.
-
Гибридизация s- и двух p- орбиталей (sp2-гибридизация) - образование соединений бора
Возбужденный атом бора обладает тремя неспаренными электронами – одним s- и 2 p- из трех орбиталей образуются три эквивалентные sp2 – гибридные орбитали, расположенные в одной плоскости под углом 120 градусов.
-
Гибридизация одной s – и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. В этом случае sp3 гибридные орбитали расположены под углом 109 градусов 28 минут друг к другу, объясняется тем, что гибридизация является неполной.
2.Фософор. Физическая, химическая и биологическая роль.
В земной коре фосфор содержится в связанном состоянии, в соединениях, содержащих фофат ионы PO4 (3-)
Известны три аллотропных модификаций фосфора: Белый(молекулярная решетка, чесночный запах, воскообразный, плохо растворяется в воде, хорошо в этаноле и СS2), Красный(атомная решетка, без запаха, твердый, плавится только при повышенном давлении, выше 280 градусов переходит в пары белого фосфора, практически не растворим), Черный (атомная решетка, без запаха, относительно мягкий , плавится только при повышенном давлении, выше 280 градусов переходит в пары белого фосфора, практически не растворим)
Получение: 2Ca3(PO4)2 + 6 SiO2+10C=6CaSio3+10CO+P4
В периодической системе находится в 5 группе. Электронная формула внешней оболочки атома ns2 np3
Фосфор имеет d-подуровень , поэтому при возбуждении происходит распаривание s – электронов, и переход одного из них на d – подуровень ns1 np3 nd1
Поэтому фосфор может образовывать 3, а максимум 5 ковалентных связей.
Но такие свободные 3 d –орбитали могут участвовать в образовании еще нескольких аналогичных связей , и по донорно-акцепторному механизму, выступая в качестве акцептора электронных пар атомов-доноров. Этим объясняется характерность для атома фосфора таких координационных чисел как 5 (sp3d –гибридизация) и 6 (sp3d2-гибридизация)
