
- •Учебно-методические материалы для лабораторных занятий по курсу «Технология изготовления современных ис, мэмс и нэмс»
- •Критерии применимости фоторезистов
- •Лабораторная работа № 2 «Термическое окисление кремния»
- •Механизм роста и кинетика окисления
- •Факторы, влияющие на скорость термического окисления
- •Определение толщины оксидного слоя
- •Структура и дефекты оксидной пленки
- •Методы осуществления диффузии
- •Лабораторное задание
- •Порядок выполнения работы
- •Требования к отчету
- •Контрольные вопросы
- •Лабораторная работа 4 «Изучение процесса плазмохимического травления»
- •Совмещение
- •Лабораторное задание
- •1. Изучение подложек гис
- •2. Изучение конструкций гис
Лабораторная работа № 2 «Термическое окисление кремния»
Цель работы: I) ознакомиться с методами термического окисления кремния в производстве полупроводниковых ИС; 2) освоить инженерные методы выбора технологических режимов и методы контроля основных параметров пленок диоксида кремния.
Теоретические сведения
В современной технологии изготовления полупроводниковых приборов и ИС диэлектрические слои выполняют различные функции. Они используется:
для маскирования при ионной имплантации или диффузии легирующей примеси в кремний,
для пассивации поверхности полупроводников,
для изоляции элементов ИС друг от друга,
для изоляции проводящих слоев в структурах с многослойной разводкой,
в качестве активных компонентов в МДП - структурах,
для защиты полупроводниковых структур от механических повреждений и воздействия внешней среды (влаги, загрязнений, излучений) .
Существует две группы методов, с помощью которых наносятся пленки оксида кремния. Первая группа связана с использованием материала подложки (термическое окисление, электролитическое и плазменное анодирование), а вторая - с нанесением пленки оксида кремния из внешней фазы (пиролитическое осаждение или осаждение из парогазовых смесей при атмосферном и пониженном давлении, плазмохимическое осаждение и др.). Выбор конкретного метода получения пленок зависит от функционального назначения оксидных пленок.
Наибольшее распространение в технологии ИС получили метода термического окисления, позволяющие получать высококачественные пленки: равномерные по толщине, совершенные по структуре, с высокими диэлектрическими свойствами.
Известны следующие методы термического окисления: в сухом кислороде, в сухом кислороде с добавлением галогенов, в парах воды, во влажном кислороде, пирогенное окисление, окисление при повышенном давлении.
Механизм роста и кинетика окисления
Согласно имеющимся экспериментальным данным свежеобработанная поверхность кремния при обычных условиях довольно быстро покрывается слоем оксида толщиной 3 - 7 нм, после чего процесс дальнейшего окисления практически прекращается. Время образования такой оксидной пленки зависит от применявшейся химической обработки и влажности окружающей среды, обычно оно не превосходит нескольких суток.
Для продолжения роста пленки, когда необходимо активизировать перенос реагирующих элементов (кислорода или кремния) с целью их непосредственного контакта и образования SiO2. Активация процесса диффузии окислителя происходит при высоких температурах, этот процесс называется термическим окислением.
Для анализа процесса окисления при высокой температуре рассмотрим рис.1.

Рис.1. Механизм высокотемпературного окисления кремния.
Экспериментально доказано, что термическое окисление Si происходит за счет диффузии окисляющих частиц через оксид к границе раздела Si – SiO2, а не путем прохождения ионов кремния через оксид.
Химические реакции, происходящие при термическом окислении кремния в сухом кислороде и парах воды, имеют следующий вид:
 (1)
(1)
 (2)
(2)
Отношение объема кремния, участвующего в образовании оксидного слоя, к объему образовавшегося оксида составляет примерно 0,44. Процесс окисления можно разбить на три стадии (рис. 1).
Стадия 1. Перенос окисляющих частиц из газовой фазы на поверхность оксида (адсорбция) и растворение в нем до равновесного значения. При этом поток частиц, пересекающих поверхность единичной площади на единицу времени, можно описать выражением
 (3)
(3)
где h - коэффициент массопереноса окисляющих частиц из газовой фазы на поверхность SiO2; С*- предельная растворимость окислителя в оксиде; С0 - концентрация окисляющих частиц на внешней поверхности оксида в любой момент времени.
Если поверхность оксида насытится до предельной растворимости (С0 = С*), то поток окисляющих частиц из газовой среды в оксид прекратится ( F1=0), В свою очередь предельная растворимость С* окисляющих частиц увеличивается с повышением парциального давления окислителя в соответствии с законом Генри:
 ,
,
где Р - парциальное давление окислителя; Н - постоянная Генри.
Закон Генри справедлив только в отсутствии явления диссоциации молекул окислителя на границе раздела оксида с газовой фазой. Совпадение теоретической модели и экспериментальных результатов подтверждает правильность использования закона Генри и свидетельствует об отсутствии явлений диссоциации на границе SiO2 с газовой фазой.
Стадия 2. Поток частиц окислителя через оксид определяется диффузией:
 , (4)
, (4)
где D - коэффициент диффузии окислителя в оксиде; Сi - концентрация частиц на поверхности кремния; х0 - толщина оксидной пленки.
Стадия 3. Окисляющие частицы вступают в реакцию с кремнием, образуя очередной слой оксида. Поток частиц на границе пропорционален концентрации окисляющих частиц на поверхности кремния:
 (5)
(5)
где k - константа скорости реакции; Сi - константа скорости химической реакции.
В установившемся равновесном случае все три потока равны, то есть
F1 = F2 = F3 .
Из совместного решения уравнений (3) - (5) получим
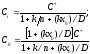
Возможны два предельных случая:
I) Коэффициент диффузии D очень мал, тогда Ci 0, C0 С*. В этом случае скорость реакции зависит от доставки окислителя к границе раздела фаз, а не от скорости его взаимодействия с кремнием, т.е. лимитирующей является диффузионная стадия протекания реакции.
2) Коэффициент диффузии очень большой, следовательно,
Сc = Сi = С* /(1+ k/h) . Лимитирующей является кинетическая стадия протекания самой реакции, так как скорость окисления кремния определяется константой скорости реакции k и концентрацией Сi, равной С0.
Если предположить, что на образование единицы объема оксида идет N частиц окислителя, то скорость роста слоя оксида выражается следующим уравнением:
 (6)
(6)
Для того чтобы получить начальные условия в общем виде, считают, что полная толщина оксида х0 состоит из двух частей: начального слоя толщиной xi , который был на кремнии до рассматриваемой стадии окисления, и дополнительного слоя, выращенного во время процесса окисления. Тогда начальное условие можно сформулировать следующим образом:
x0=хi при t=0.
Такое деление оксидного слоя позволяет изучать механизм многократного окисления и учитывать влияние поля и пространственного заряда в процессе термического окисления на первоначальный слой SiO2 .
Введем обозначения:

Тогда уравнение (6) примет вид
 (7)
(7)
Из уравнения (7) можно получить общее соотношение между временем окисления и толщиной выросшего оксида:
 (8)
(8)
где =(xi2 + Aхi)/B - смещение по оси времени, соответствующее начальной толщине оксидного слоя xi .
Решение уравнения (8) для х0 как функции времени записывается в следующем виде:

Практический интерес представляют два предельных случая:
1. Для больших значений времени окисления, когда t >> A2/4В, и t>>τ, получим

или параболический закон роста оксида:

где B - параболическая константа скорости окисления.
2. Для малых значений скорости окисления при (t+τ)<<A2/(4B) получим

или линейный закон роста оксида:

где
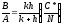 - линейная
константа скорости окисления.
- линейная
константа скорости окисления.
Таким образом, существует характерное время процесса окисления:
 (9)
(9)
превышение которого приводит к переходу от линейного закона роста пленки к параболическому.
Характерная толщина оксида, соответствующая указанному времени, определяется как
 (10)
(10)
На рис.2 показана общая зависимость толщины оксида кремния от времени окисления при нормальном давлении и два ее предельных случая.

Pис.2. Общий вид зависимости толщины оксида кремния от температуры.
