
- •2.Основные исторические этапы развития микробиологии, вклад отечественных и зарубежных ученых. Разделы микробиологии.
- •3.В лабораторию поступила мокрота больного с патологическим процессом в легких. Наметить план лабораторных исследований.
- •1. Стрептококки и заболевания, вызываемые ими.
- •2.Основные исторические этапы развития вирусологии, вклад отечественных и зарубежных ученых в ее развитие. Разделы вирусологии.
- •1.Пневмококки и заболевания, вызываемые ими.
- •2. Космическая микробиология и гнотобиология (цели, задачи, достижения и их применение в медицине).
- •3.Наметить план бактериологического обследования работников кондитерской фабрики для выявления возможного бактерионосительства, опасного для производства.
- •1. Менингококки и менингококковая инфекция.
- •2.Значение микробиологии, вирусологии в деятельности врача.
- •3.В стационаре у ребенка с диагнозом “Острая бронхопневмония” обнаружена дисфункция кишечника. Как установить этиологию патологии? Каковы причины кишечной патологии?
- •2.Основные принципы классификации микробов и их номенклатура. Понятие о штамме, клоне, культуре, колонии микроорганизмов.
- •3. С какого дня болезни следует проводить серологические исследования при брюшном тифе у детей и взрослых? Какие титры агглютининов считают в этих случаях диагностическими?
- •1.Псевдомонада – синегнойная палочка, ее роль в патологии человека.
- •2.Основные принципы классификации вирусов (генетическая, структурная, органотропная систематика). Понятие о ретровирусах, дефектных вирусах.
- •1.Эшерихии и эшерихиозы.
- •3.У больного, поступившего в стационар с диагнозом “Пищевая токсикоинфекция”, резко нарастают явления обезвоживания. Как, с помощью каких методов, можно установить причину?
- •1.Сальмонеллы и сальмонеллезы – брюшной тиф, паратифы.
- •2.Временные структурные элементы бактериальной клетки (споры, капсулы), их функциональное значение и обнаружение.
- •1. Пищевые токсикоинфекции и их возбудители.
- •2.Подвижность микроорганизмов, органеллы движения и методы определения (прямые, косвенные). Примеры непостоянства движения при наличии органелл.
- •1.Шигеллы и шигеллезы.
- •2.Спирохеты, классификация, особенности выявления.
- •3.Реакция Хеддельсона с сывороткой крови больного в объеме 0,2 мл
- •1.Клебсиеллы и заболевания, вызываемые ими (очаговая пневмония, риносклерома).
- •2.Вирусы, структура вириона, выявление.
- •1. Иерсинии, возбудитель чумы.
- •2.Понятие о прионах.
- •3.На прибывшем в порт судне обнаружены трупы грызунов. Наметить план лабораторной индикации возбудителя, противоэпидемических мероприятий.
- •1.Иерсинии, возбудитель псевдотуберкулеза.
- •2.Грибы, классификация, патогенные и условно-патогенные виды, методы выявления.
- •1.Yersinia enterocolitica, роль в патологии.
- •2.Патогенные простейшие, классификация, биологические свойства, методы выявления.
- •1.Холера и холерные вибрионы (классический холерный, Эль-Тор, о139).
- •2.Тинкториальные свойства микроорганизмов, сущность, дифференциально-диагностическое значение, определение методами Грама и Циль-Нильсена.
- •3.Каковы профилактические и лечебные мероприятия при поступлении в стационар больного с бактериологически подтвержденным диагнозом “ботулизм”.
- •1. Пищевые интоксикации (стафилококковые, ботулизм и пр.).
- •2.Размеры микробной клетки, особенности у разных таксономических групп. Способы определения.
- •1. Бруцеллы и бруцеллез.
- •2.Питание микробов, его виды, механизмы, пластический обмен.
- •1.Туляремия и ее возбудитель.
- •2.Лабораторное обеспечение питания микробов. Питательные среды, сущность их конструирования, виды, назначение, контроль.
- •1.Бордетеллы и бордетеллиозы (коклюш и паракоклюш).
- •2.Дыхание микробов, его варианты, сущность, механизмы аэробного и анаэробного дыхания, определение типа.
- •3.Как оценить положительную реакцию Вассермана со специфическим спирохетозным антигеном, положительные риф, рит у беременных на 8, 12, 24 неделях беременности?
- •1. Особо опасный бациллез – сибирская язва.
- •2.Методы культивирования анаэробов в лабораторных условиях.
- •1.Патогенные клостридии и возбудители раневого анаэробиоза – газовой гангрены, условия развития
- •2.Культуральные свойства микроорганизмов, их своеобразие у различных видов и обеспечение в лабораторных условиях.
- •1.Патогенные клостридии и возбудитель раневого анаэробиоза – столбняка.
- •2.Размножение микробов, фазы роста.
- •3.В стационар поступил ребенок с диагнозом “Острое респираторное заболевание”. Как, используя микробиологические методы, уточнить этиологию заболевания? Что можно заподозрить?
- •1.Патогенные клостридии и возбудители ботулизма.
- •2.Биохимическая активность микроорганизмов, ее определение и дифференциально-диагностическое значение.
- •1.Листерии и листериозы.
- •2.Понятие о патогенности, вирулентности, единицы ее измерения. Пути повышения и снижения вирулентности патогенных микробов, практическое значение в медицине. Примеры.
- •1.Коринобактерии и коринобактериозы
- •2.Факторы патогенности микробов, их выявление.
- •3.Из носоглоточного смыва больного выделена чистая культура золотистого стафилококка. Всегда ли можно утверждать, что она причина болезни. Как доказать, что данный штамм – возбудитель заболевания?
- •1.Патогенные микобактерии – возбудители туберкулеза.
- •3.Из желчи переболевшего брюшным тифом выделен возбудитель названного заболевания. Как оценить данную ситуацию? Болен ли человек в настоящее время?
- •1. Патогенные микобактерии, возбудитель лепры.
- •2.Особенности культивирования, выделения и идентификации чистой культуры анаэробов.
- •3.Из организма практически здорового человека выделен заведомо патогенный вид микроба. О чем это свидетельствует? Почему возбудитель болезни присутствует в организме, а заболевание не проявляется?
- •1. Патогенные актиномицеты и актиномикозы.
- •2.Репродукция вирусов, особенности ее обеспечения в лабораторных условиях. Методы культивирования вирусов.
- •1.Патогенные спирохеты, сифилис.
- •2.Антигены, их виды и материальная основа, функции, определение. Назначение в практической медицине вакцин, диагностикумов.
- •3.У двух реконвалесцентов проведены бактериологические исследования. У одного возбудитель не обнаружен, у другого – выявлен. Как оценить исход заболевания? с чем это может быть связано?
- •1.Патогенные спирохеты – возбудители бореллиозов (эндемического и эпидемического возвратного тифа).
- •2.Понятие об “о”, “н”, “к”-антигенах, аутоантигенах, изоантигенах организма. Примеры.
- •3.В детскую инфекционную больницу поступил ребенок с диагнозом “дифтерия”, “скарлатина”. Как уточнить этиологию заболевания? Возможно ли сочетание этих инфекций?
- •1.Патогенные спирохеты – возбудители лептоспирозов.
- •2. Токсины и ферменты, как антигены.
- •3.У больного гриппом выявлена пневмония, вызванная стафилококком. Как называется такая форма инфекции? Объясните причины ее возникновения. Приведите другие примеры такого сочетания.
- •1.Патогенные риккетсии и эпидемический сыпной тиф.
- •2.Антитела, их виды, материальная основа, функции.
- •3.В хирургическом отделении возникла серия гнойных послеоперационных осложнений. Наметить план выявления источника инфекции, выделения возбудителя и связи его с ним.
- •1.Патогенные риккетсии и эндемический сыпной тиф.
- •2.Иммуноглобулины основных классов, структурные и функциональные особенности, динамика биосинтеза, значение при инфекционных заболеваниях.
- •3.Крышка на банке с заготовленными впрок грибами вздулась. Наметить план обнаружения причины порчи продукта.
- •1. Патогенные микоплазмы и заболевания вызываемые ими
- •2.Современные представления о механизмах и сущности антителообразования. Роль антигена в антителогенезе.
- •3.Микробное число в пробе колодезной воды 15 мт/мл, коли-индекс равен 2, обнаружен вибрион Эль-Тор. Дать заключение пригодности воды данного источника.
- •1.Патогенные хламидии и хламидиозы (трахома, урогенитальный, респираторный хламидиоз).
- •2.Убитые вакцины и техника их приготовления; контроль.
- •3.Коли-титр воды открытого водоема 550 мл, из нее выделен брюшнотифозный бактериофаг в высоком титре. Пригодна ли вода данного водоема в качестве питьевой?
- •1. Поксвирусы. Натуральная оспа и ее возбудитель.
- •2.Химические вакцины, виды, способы приготовления.
- •1. Герпесвирусы. Вирусы простого герпеса (впг).
- •1. Герпесвирусы. Вирус ветряной оспы и опоясывающего герпеса.
- •2.Анатоксин, его приготовление, назначение, определение силы и качества, контроль.
- •3.С какого дня болезни следует проводить серологические исследования при брюшном тифе у детей и взрослых? Какие титры агглютининов считают в этих случаях диагностическими?
- •1. Герпесвирусы. Вирус Эпштейна-Барр, вирус цитомегалии.
- •2.Понятие о поливакцинах. Условия, определяющие эффективность иммунопрофилактики.
- •1. Коронавирусы. Sars.
- •2.Вакцинопрофилактика и вакцинотерапия. Основные принципы их использования. Аутовакцины, приготовление, контроль качества, назначение.
- •3. У больного, поступившего в стационар с диагнозом “Пищевая токсикоинфекция”, резко нарастают явления обезвоживания. Как, с помощью, каких методов, можно установить причину?
- •1.Тогавирусы. Вирус краснухи.
- •2.Живые вакцины, методы аттенуации вакцинных штаммов и особенности их применения.
- •1. Паповавирусы. Папилломавирусы человека
- •2.Реакция агглютинации, сущность, техника, варианты, применение.
- •2.Реакция гемагглютинации, пассивной гемагглютинации, реакция торможения гемагглютинации, их диагностическое значение при инфекциях.
- •3.Реакция Хеддельсона с сывороткой крови больного в объеме 0,2 мл
- •1.Ортомиксовирусы. Вирус гриппа и грипп.
- •2.Реакция гемадсорбции и реакция торможения гемадсорбции, их диагностическое значение при вирусных инфекциях.
- •1.Парамиксовирусы. Парагриппозные вирусы и их роль в возникновении острых респираторных заболеваний.
- •2.Реакция связывания комплемента, сущность, техника, варианты, применение. Примеры.
- •3.На прибывшем в порт судне обнаружены трупы грызунов. Наметить план лабораторной индикации возбудителя, противоэпидемических мероприятий.
- •1. Парамиксовирусы. Эпидемический паротит и его возбудитель.
- •2.Неполные (блокирующие) антитела и их определение в реакции торможения связывания комплемента, сущность, техника, особенности учета.
- •1. Парамиксовирусы. Корь и ее возбудитель.
- •2.Реакция преципитации, сущность, техника, варианты, применение.
- •1. Рабдовирусы. Бешенство и его возбудители.
- •2.Особенности вирусных инфекций. Роль вирусной нуклеиновой кислоты, белков, токсических веществ в инфекционном процессе. Понятие о дефектных вирусах.
- •2. Каковы профилактические и лечебные мероприятия при поступлении в стационар больного с бактериологически подтвержденным диагнозом “ботулизм”.
- •1.Пикорнавирусы. Полиомиелит и его возбудители.
- •2.Реакция нейтрализации токсина антитоксином: сущность, техника, варианты, применение in vitro и in vivo.
- •1.Флавивирусы. Клещевой и комариный энцефалиты и их возбудители.
- •1.Флавивирусы. Вирус лихорадки Западного Нила.
- •2.Персистенция микроорганизмов, их инвазионно-колонизационная активность и здоровое носительство возбудителей инфекционных заболеваний. Значение латентных инфекций.
- •1.Возбудители вирусных острых кишечных инфекций: ротавирусы, вирусы гепатитов а и е.
- •2.Реакция иммобилизации спирохет, примеры применения. Реакция иммунного прилипания. Практическое значение.
- •1. Возбудители парентеральных вирусных гепатитов в, d, c, g, их роль в патологии печени и вирусоносительстве.
- •2.Иммуноферментный и радиоиммунологический методы, сущность, применение.
- •1.Ретровирусы. Вич-инфекция (спид) и ее возбудители.
- •2.Полимеразная цепная реакция (пцр).
- •2. Основные исторические этапы учения о наследственности и изменчивости микробов. Вклад отечественных и зарубежных ученых.
- •1.Роль вирусов в этиологии опухолей (днк- и рнк-вирусы).
- •1.Патогенные грибы – возбудители профессиональных и бытовых микозов (мукоромикоз, аспергиллез, пенициллиоз и пр.).
- •2.Понятие о плазмидах, их виды, определение, значение.
- •1. Условно-патогенные грибы – возбудители кандидомикоза, условия развития.
- •2.Пол бактерий и плазмиды фертильности, видовая и межвидовая конъюгация, значение для изменчивости микроорганизмов.
- •3.Из носоглоточного смыва больного выделена чистая культура золотистого стафилококка. Всегда ли можно утверждать, что она причина болезни. Как доказать, что данный штамм – возбудитель заболевания?
- •1. Патогенные грибы и поверхностные дерматомикозы (трихофития, микроспория, парша, эпидермофития).
- •2.Направленная изменчивость микроорганизмов, ее практическое применение в генной инженерии.
- •3.Из желчи переболевшего брюшным тифом выделен возбудитель названного заболевания. Как оценить данную ситуацию? Болен ли человек в настоящее время?
- •1. Патогенные грибы и глубокие микозы (гистоплазмоз, криптококкоз и пр.).
- •2.Фенотипическая изменчивость, сущность, формы, практическое значение. Роль экологии.
- •3.Из организма практически здорового человека выделен заведомо патогенный вид микроба. О чем это свидетельствует? Почему возбудитель болезни присутствует в организме, а заболевание не проявляется?
- •1. Плазмодии малярии и малярия.
- •2.Генотипическая изменчивость. Трансформационная изменчивость, значение для диагностики и профилактики инфекционных заболеваний.
- •1. Возбудитель амебиаза и амебиаз.
- •2. Генотипическая изменчивость. Трансдукция и лизогенная конверсия, значение для науки и практики.
- •3. У двух реконвалесцентов проведены бактериологические исследования. У одного возбудитель не обнаружен, у другого – выявлен. Как оценить исход заболевания? с чем это может быть связано?
- •1.Лейшмании, кожный и висцеральный лейшманиоз.
- •1. Токсоплазмы и токсоплазмоз.
- •2.Влияние физических и химических факторов на микробы. Мутация и ее значение в практической медицине.
- •3. У больного гриппом выявлена пневмония, вызванная стафилококком. Как называется такая форма инфекции? Объясните причины ее возникновения. Приведите другие примеры такого сочетания.
- •1. Трипаносомы и трипаносомоз.
- •3. Крышка на банке с заготовленными впрок грибами вздулась. Наметить план установления причины порчи продукта.
- •1. Балантидии и лямблии, их роль в патологии человека.
- •3. Микробное число в пробе колодезной воды 15 мт/мл, коли-индекс равен 2, но обнаружен вибрион Эль-Тор. Дать заключение о пригодности воды данного источника.
- •2.Стерилизация, сущность, варианты, применение. Контроль качества стерилизации.
- •3. Коли-титр воды открытого водоема 550 мл, из нее выделен брюшнотифозный бактериофаг в высоком титре. Пригодна ли вода данного водоема в качестве питьевой?
- •1. Кампилобактерии и кампилобактериоз.
- •2.Влияние химических факторов среды на микробы. Дезинфекция, дезинсекция, дератизация, назначение. Контроль эффективности.
- •1. Госпитальные (внутрибольничные) инфекции и их возбудители.
- •2.Микробиология народному хозяйству и медицине. Микробиологическая биотехнология.
- •1.Инфекционные «болезни цивилизации» (легионеллез, псевдотуберкулез, вич-инфекция).
- •2.Нормальная микрофлора человека, ее значение в жизнедеятельности организма. Способы восстановления микрофлоры.
- •1. Дисбактериоз, роль микроорганизмов в развитии и предрасполагающие условия.
- •3. С какого дня болезни следует проводить серологические исследования при брюшном тифе у детей и взрослых? Какие титры агглютининов считают в этих случаях диагностическими?
- •1. Инфекционные заболевания в медицине катастроф.
- •2.Риккетсии, классификация, общие биологические свойства, методы выявления.
- •3. В стационаре у ребенка с диагнозом “Острая бронхопневмония” обнаружена дисфункция кишечника. Как установить этиологию патологии? Каковы причины кишечной патологии.
- •1. Медленные инфекции – прионозы.
- •2.Хламидии, морфо-физиологические свойства, способы выявления.
- •3. С какого дня болезни следует проводить серологические исследования при брюшном тифе у детей и взрослых? Какие титры агглютининов считают в этих случаях диагностическими?
- •2. Микоплазмы, морфология, структура, физиологические особенности, методы выявления.
- •1. Патогенные спирохеты, сифилис.
- •3.У больного, поступившего в стационар с диагнозом “Пищевая токсикоинфекция”, резко нарастают явления обезвоживания. Как, с помощью, каких методов, можно установить причину?
- •1. Стафилококки и стафилококковые инфекции (стафилококкозы).
- •2. Микрофлора воды и ее значение для здоровья человека. Принципы санитарно-бактериологического анализа и оценки. Способы очистки воды от микробов.
- •1. Стрептококки и заболевания, вызываемые ими.
- •2. Микрофлора почвы. Её значение в развитии патологии человека.
- •2.Микрофлора продуктов питания. Её роль в развитии заболеваний. Методы определения и дифференциальной оценки.
- •1. Менингококки и менингококковая инфекция.
- •2. Биологический метод диагностики инфекционных заболеваний. Сущность, техника, варианты, применение.
- •1. Гонококк и гонококковая инфекция.
- •3. На прибывшем в порт судне обнаружены трупы грызунов. Наметить план лабораторной индикации возбудителя, противоэпидемических мероприятий.
1.Флавивирусы. Клещевой и комариный энцефалиты и их возбудители.
Вирусные энцефалиты - большая группа острых инфекционных заболеваний ЦНС, вызываемых нейротропными вирусами преимущественно из рода арбовирусов, передающихся человеку кровососущими членистоногими переносчиками (англ.arboviruses произошло от слов arthropod borne viruses - вирусы, передаваемые членистоногими). Род арбовирусов включает альфавирусы и флавивирусы. Они входят в семейство тогавирусов (Togaviridae).
Вирусные энцефалиты, вызываемые арбовирусами, относятся к первичным, поскольку поражение вещества мозга при них возникает первично и является сущностью болезни. Эти энцефалиты следует отличать от вторичных вирусных энцефалитов, возникающих при многих вирусных заболеваниях (корь, ветряная оспа, краснуха, грипп, эпидемический паротит, энтеровирусные инфекции и др.).
Морфология, химический состав и антигенная структура. Вирионы чаще имеют сферическую форму. Строение сложное: они относятся к РНК-геномным вирусам и состоят из РНК и белка-капсида, окруженных суперкапсидом; на поверхности суперкапсида находятся шипы — гликопротеины. Имеют родоспецифические антигены, выявляемые в РСК, группоспецифические и типоспецифические антигены — гликопротеины, обладающие протективной активностью и выявляемые в РТГА и реакции нейтрализации.
Культивирование. Универсальной моделью для выделениях арбовирусов служат мыши, у которых при заражении возникает энцефалит, заканчивающий¬ся летально. Арбовирусы культивируют также в культурах кле¬ток, где они не вызывают цитопатического эффекта. Для выделения некоторых арбовирусов применяют за¬ражение куриных эмбрионов в желточный мешок. Арбовирусы размножаются при двух температурных режимах, 36—40 и 22— 25С, что позволяет им репродуцироваться в организме не только позвоночных, но и кровососущих членистоногих переносчиков.
Флавивирусы являются возбудителями клещевого энцефалита, энцефалита Сент-Луис, энцефалита долины Муррея, японского энцефалита, энцефалита Западного Нила.
На территории нашей страны чваще всего встречаются клещевой энцефалит и комариный (японский) энцефалит.
Клещевой (весенне-летний, или таежный) энцефалит - природно-очаговое вирусное заболевание с преимущественным поражением ЦНС, проявляющееся общемозговыми, менингеальными и очаговыми симптомами.
Таксономия: семейство Flaviviridae, род Flavivirus.
Морфологические свойства: сложные, +РНК, структурные белки – V2капсид,V3суперкапсид,V1внутри от суперкапсида. Имеет пять генотипов, имеющих некоторые антигенные различия, но только один структурный гликопротеин V-3 индуцирует образование вируснейтрализующих антител. Он обладает четкой антигенной консервативностью. Несмотря на небольшую устойчивость вируса к действию физических и химических факторов, в организме переносчиков он сохраняет свою жизнеспособность от —150С до +30С.
Резистентность: Высокая, к действию кислых значений рН, что важно при алиментарном пути заражения. Вирус обладает висцеротропностью и нейротропностью. К вирусу чувствительны белые мыши.
Эпидемиология: Переносчиком и основным резервуаром являются иксодовые клещи. У клещей происходит трансовариальная и трансфазовая передача вируса. Поддержание циркуляции осуществляется за счет прокормителей клещей — грызунов, птиц, диких животных. Характерна весенне-летняя сезонность.
Патогенез:Человек заражается трансмиссивно при укусе инфицированными клещами, от которых в период кровососания вирус проникает в макроорганизм. Проникновение вируса в организм возможно также контактным путем через мелкие повреждения кожи. Алиментарный путь заражения при употреблении сырого молока коз и овец. Употребление молока ведет к ощелачиванию желудочного сока, что препятствует инактивации вируса.
Клиника: Инкубационный период — от 8 до 23 дн. Сначала вирус размножается в месте входных ворот инфекции под кожей, откуда он попадает в кровь. Возникает резорбтивная вирусемия. Вирус проникает в эндотелий кровеносных сосудов, внутренних органов, где активно размножается. При пищевом пути заражения входными воротами является слизистая оболочка глотки и тонкой кишки. В конце инкубационного периода в эндотелии кровеносных сосудов возникает вторичная вирусемия, длящаяся 5 дн. Вирусы гематогенно, периневрально проникают в головной и спинной мозг, поражая мотонейроны (крупные двигательные клетки в сером веществе спинного мозга). Различают три клинические формы клещевого энцефалита: лихорадочную, менингеальную и очаговую. Иммунитет: После перенесенного заболевания остается стойкий иммунитет. Вирус клещевого энцефалита относится к факультативным возбудителям медленных вирусных инфекций. Микробиологическая диагностика: Выделение вируса из крови и цереброспинальной жидкости, внутренних органов и мозга путем интрацеребрального заражения мышей и культур клеток. Идентификацию вируса проводят в РТГА, РН и РСК, а в монослое культур клеток — в РИФ. Обнаружение антител в парных сыворотках и цереброспинальной жидкости проводят с помощью РСК и РТГА, а также других серологических реакций. Экспресс-диагностика основана на обнаружении вирусного антигена в крови с помощью РИГА и ИФА, выявлении IgM антител на первой неделе заболевания в цереброспинальной жидкости и обнаружении РНК-вируса в крови и цереброспинальной жидкости у людей, в клещах и внутренних органах животных с помощью ПЦР. Лечение и профилактика: Для лечения и экстренной профилактики применяют специфический гомологичный донорский иммуноглобулин против клещевого энцефалита, полученный из плазмы доноров, проживающих в природных очагах клещевого энцефалита и содержащий в высоком титре антитела к вирусу клещевого энцефалита. При отсутствии препарата назначают специфический гетерологичный лошадиный иммуноглобулин. При лечении тяжелых форм применяют иммуногемосорбцию и серотерапию иммунной плазмой доноров. Применяют виферон, ридостин, рибонуклеазу.
Активная иммунизация – убитые вакцины:
1. Вакцина против клещевого энцефалита культуральная сорбированная инактивированная жидкая; 2. Вакцина против клещевого энцефалита культуральная очищенная концентрированная инактивированная сухая (вакцина клещевого энцефалита концентрированная), предназначенная для вакцинации взрослых; 3. Австрийская вакцина клещевого энцефалита культуральная очищенная концентрированная инактивированная для иммунизации детей; 4. Вакцина против клещевого энцефалита очищенная концентрированная инактивированная «Энцепур К»
5. Культуральная концентрированная инактивированная сухая вакцина для профилактики клещевого энцефалита у детей с 4-летнего возраста
Для формирования надежной защиты необходима ревакцинация, так как при вакцинации убитыми вакцинами формируется кратковременный иммунитет. Протективным действием обладает неструктурный белок NS1 вируса - растворимый комплементсвязывающий антиген. Он является компонентом для противовирусных вакцин.
Комариный, или японский (осенний), энцефалит - острая сезонная нейроинфекция с общеинфекционными проявлениями и тяжелым поражением вещества мозга.
Этиология. Возбудитель комариного энцефалита, так же как и возбудитель клещевого энцефалита, относится к арбовирусам (род флавивирусы) и является одной из 4 антигенных разновидностей этого рода. Среди животных наиболее чувствительны к вирусу обезьяны, белые мыши, хомяки, крысы и др.
Эпидемиология. Комариный (японский) энцефалит - типичная природно-очаговая инфекция. Резервуаром вируса являются многие дикие животные и особенно птицы, переносчиками - комары Culex tritaeniorhynonus и др. Инфицированные комары передают вирус человеку во время укуса со слюной. Заболевание имеет строгую летне-осеннюю сезонность с максимумом заболеваемости в августе - сентябре. Обычно эпидемической вспышке предшествует жаркая погода, способствующая массовому выплоду комаров.
К комариному энцефалиту восприимчивы все люди. Заболевание чаще встречается среди сельскохозяйственных рабочих, а также среди детей старшего возраста. Возможны групповые заболевания детей в лагерях отдыха, расположенных недалеко от природных очагов инфекции, вблизи мелких водоемов или в заболоченном районе.
Патогенез. После укуса инфицированным комаром вирус гематогенным путем попадает в ЦНС и в связи с выраженной нейротропностью быстро размножается в нервных клетках. По достижении максимальной концентрации вирус повторно выходит в кровь и действует общетоксически, что соответствует окончанию инкубационного периода и началу клинических проявлений.
Наибольшие морфологические изменения обнаруживаются в ЦНС. Макроскопически мозговые оболочки отечны, гиперемированы, с точечными кровоизлияниями. Вещество мозга набухшее, дряблое, с локальными кровоизлияниями и очагами размягчения. Выраженные изменения отмечаются в области зрительных бугров и стриарных образо ваний.
При гистологическом исследовании выявляют дегенеративно-дистрофические и некробиотические изменения в нервных клетках, пролиферацию глиозных элементов. Инфильтраты из лимфоцитов и плазматических клеток располагаются вокруг сосудов, группы некротизированных нервных клеток формируют относительно специфические для комариного энцефалита микрогранулемы. Процесс в ЦНС всегда диффузный, но изменения больше выражены в зрительных буграх, красном ядре, оливах и зубчатых ядрах мозжечка.
В других органах отмечают явления распространенного геморрагического капилляротоксикоза с полнокровием, точечными кровоизлияниями, паренхиматозным перерождением во внутренних органах.
Клиническая картина. Инкубационный период составляет 5-14 дней. Заболевание начинается остро, с подъема температуры тела до 39-40 °С, озноба, головной боли, тошноты и рвоты. Лицо больного быстро становится гиперемированным, выражены склерит и катаральный конъюнктивит. На 2-3-й день болезни появляются менингеальные симптомы, а с 3-4-го дня - симптомы очагового или диффузного энцефалита. Больные оглушены, безучастны, не реагируют на осмотр и окружающее. Реже отмечается возбуждение с бредом, галлюцинациями и потерей сознания. Вследствие мышечной гипертонии больной лежит с запрокинутой головой и приведенными к животу конечностями. При поражении пирамидной системы возникают спастические моно- и гемипарезы. При поражении спинного мозга появляются вялые параличи. При распространении поражения на бульбарные центры возможны нарушения дыхания, глотания, падение сердечно-сосудистого тонуса, поражение двигательной сферы. Клинически это проявляется разнообразными гиперкинезами мышц лица и верхних конечностей.
В тяжелых случаях возникают тонические или клонические судороги.
Клиническая картина комариного энцефалита включает в себя также повышенную потливость, лабильность сердечно-сосудистой системы, глухость сердечных тонов, снижение артериального давления. При тяжелых формах могут возникать циркуляторные нарушения в органах дыхания, приводящие к развитию пневмонических очагов, преимущественно в задних отделах легких, или даже к серозно-геморрагическому отеку легких.
В крови определяются лейкоцитоз, нейтрофилез со сдвигом до палочкоядерных и юных форм, лимфопения, эозинопения, повышение СОЭ.
При спинномозговой пункции прозрачная жидкость вытекает под давлением. Обнаруживают умеренный (до 100-300 клеток в 1 мкл) лимфоцитарный цитоз и небольшое увеличение содержания белка.
Общепринятой классификации комариных вирусных энцефалитов нет. Случаи с поражением ЦНС относят к типичным, которые в зависимости от выраженности общемозговых и очаговых симптомов могут быть легкими, среднетяжелыми и тяжелыми.
К атипичным формам комариного энцефалита относят стертые и субклинические формы с абортивным течением без поражения ЦНС.
Диагностика. Комариный энцефалит диагностируют на основании клинической картины энцефалита или менингоэнцефалита, остро возникшего на фоне общеинфекционных симптомов у ребенка, проживающего в эндемическом очаге комариного энцефалита, летом или осенью. Для подтверждения диагноза используют ПЦР и ИФА, а также выделение вируса из крови и спинномозговой жидкости на культуре тканей или путем заражения новорожденных мышей в мозг с последующей идентификацией вируса с помощью серологических реакций. Диагностическое значение имеет обнаружение прироста специфических антител в парных сыворотках больных в РН, РСК, РТГА и др.
Лечение. В ранние сроки комариного энцефалита рекомендуется вводить специфический иммуноглобулин из расчета 0,5-1 мл/ (кг • сут) в 2-3 приема. Патогенетическая и симптоматическая терапия такая же, как и при клещевом энцефалите.
Профилактика. Борьба с комарами - переносчиками возбудителя и создание активного иммунитета у населения, проживающего в эндемичных районах. Иммунизацию проводят убитой вакциной. Для экстренной профилактики однократно вводят специфический иммуноглобулин в дозе 0,2 мл/кг.
2. Реакция иммунофлюоресценции (прямая-РИФ, непрямая-РНИФ), как метод экспресс-диагностики инфекционных заболеваний.
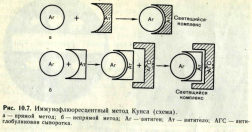
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью.
Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток.
Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности.
Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
3.В стационар поступил больной с диагнозом “пневмония”. Из анамнеза известно, что 6 лет назад он был болен туберкулезом легких. После 4 лет лечения больной выздоровел, был снят с учета. Как выяснить этиологию настоящего заболевания? Как уточнить, что в прошлом пациент болел туберкулезом?
Для определения этиологии данного эпизода заболеваемости пневмонией, необходимо провести определенные исследования. Данные исследования помогут очертить круг возбудителей данного заболевания в этом конкретном случае, тем самым это поможет назначить наиболее эффективное лечение. Такими следованиями могут стать:
1. Исследование мазков – окраска по Грамму и др. – для ориентировочного определения возбудителя.
2. Микробиологическое исследование - со всеми стадиями его проведения, начиная с забора материала (в данном случае может стать мокрота), проведение непосредственно выделения чистой культуры возбудителя и ее идентификации.
3.Вирусологическое исследование – так же с сохранением всех ступеней исследования + определение патогенной микрофлоры, которая могла присоединиться к данной вирусной инфекции, тем самым усугубив ее (возникновение вторичной инфекции).
4. Возможно взятие крови для последующей постановки серологических исследований крови : определение антигенов воздудителя, определение антител (что особенно необходимо для установления возбудителя хронической формы пневмонии)- Ра на стекле, РСК, .
Нельзя исключать и того, что пневмонию могли вызвать не только патогенные МКО, но и условно- патогенные МКО. Это могло случиться на фоне общего снижения резистентности иммунитета после проведенного лечения против возбудителя туберкулеза – как из-за самого возбудителя, так и после химиотерапии. Для определения того, что данный пациент имел в анамнезе диагноз “туберкулез”, необходимо также провести некоторые лабораторные исследования:
1. Проведение туберкулинодиагностики – внутрикожной аллергической пробы с помощью введения туберкулина (т.н. проба Манту). Положительная проба будет свидетельствовать о предшествующем заражении туберкулезом (как в данном случае).
2. Проведение серодиагностики – определение антигенов туберкулеза в составе осажденных в тканях иммунных комплексов, так и непосредственно антител . Это возможно сделать с помощью ИФА, РИА, РНИФ, РНГА и др.
Но все же предпочтение можно отдать туберкулиновой пробе – как наиболее простому, быстрому, нетрудоемкому и экономичному методу исследования.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 51
