
75 группа 2 вариант / Химия / fischem
.pdf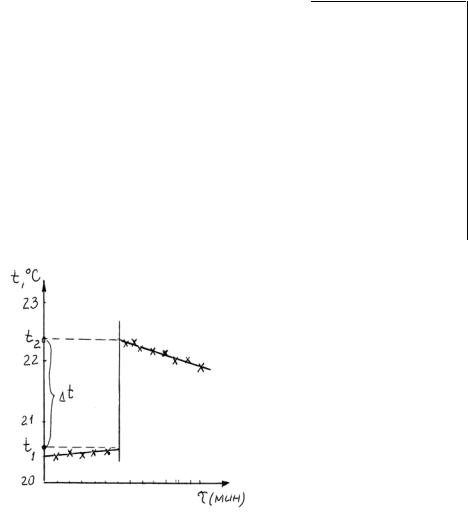
Изменение температуры системы со временем
Время от начала |
Температура |
Время от начала |
Температура |
опыта |
|
опыта |
|
0 |
|
6,5 |
|
1 |
|
7 |
|
2 |
|
8 |
|
3 |
|
9 |
|
4 |
|
10 |
|
5 |
|
11 |
|
5,5 |
|
12 |
|
6 |
|
|
|
|
|
|
|
Рис.1.4. График изменения температуры со временем
Построить график изменения температуры со временем. По графику определить необходимую для расчетов величину t. Для этого, экстраполируя линейный ход температур к началу реакции, найдите температуру процесса нейтрализации с учетом теплообмена калориметра с окружающей средой. Разность ординат точки, полученной экстраполяцией, и точки окончания предварительного термостатирования дает величину t. Значение t занесите в таблицу 2. Сделайте расчет количества теплоты, выделившейся в процессе реакции, рассчитайте тепловой эффект реакции нейтрализации в пересчете на 1 моль воды, сравните с теоретическим значением теплоты нейтрализации. Рассчитайте относительную ошибку опыта по формуле:
|
|
H 0 |
− H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
η = |
|
теор |
|
эксп |
|
|
100%, |
(1.30) |
|
|
|
||||||||
|
|
|
|
|
|||||
|
|
Нтеор0 |
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
если Нтеор=56,9 кДж/моль.
Таблица 1.2
Расчет теплоты нейтрализации и ошибки опыта
|
|
HNO3 |
|
|
|
|
NaOH |
|
m, |
|
|
toC |
|
Q, |
H,кДж/моль |
η, |
||||
C |
ρ |
3 |
|
V, см3 |
C |
н |
ρ |
3 |
V, см3 |
г |
t |
2 |
t |
1 |
|
t |
Дж |
Hэ |
Hт |
% |
н |
|
, г/см |
|
|
|
|
, г/см |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
Контрольные вопросы
1.Дайте определение термодинамической системы и ее параметров.
2.Дайте определение внутренней энергии системы как функции состояния.
3.Дайте формулировку первого закона термодинамики.
4.Объясните различие величин тепловых эффектов реакций, проведенных при постоянном объеме и постоянном давлении.
5.Дайте определение энтальпии как функции состояния и стандартной энтальпии образования вещества.
6.Дайте формулировку закона Гесса и следствий из этого закона.
7.Охарактеризуйте энтропию как функцию состояния, являющуюся мерой неупорядоченности системы.
8.Дайте формулировку второго и третьего законов термодинамики.
9.Охарактеризуйте энергию Гиббса, как критерий возможности протекания химической реакции.
10. Объясните влияние температуры на направление протекания химической реакции. Как рассчитать температуру, выше которой реакция идет самопроизвольно?
Примеры решения задач
Пример 1. Рассчитайте изменение энтальпии реакции взаимодействия оксида серы (IV) c кислородом при стандартных условиях. Укажите, экзоили эндотермической является данная реакция.
Дано: из табл 2: |
|
Решение: |
|
||
В-ва |
|
Ho f,298, кДж/моль |
2SO2(г) + O2(г)= 2SO3(г) |
||
|
|||||
SO2 |
|
-297 |
|
Ho2 98 реакц =ΣΔНo298 прод-ΣΔНo298 исходн |
|
O2 |
|
0 |
|
С учетом коэффициентов: |
|
SO3 |
|
-396 |
|
Нo298 реакции=2(-396)–[2(-297)+1(0)]=-198 (кДж) |
|
|
|
|
|
Ответ: Ho298 реакции = –198 кДж, реакция |
|
Найти: |
|
Ho298 реакции |
|
||
|
|
|
|
экзотермическая, т.к. Ho298<0. |
|
Пример 2. При сгорании 3,2 г серы выделилось 27,9 кДж. Рассчитайте |
|||||
теплоту образования оксида серы (IV). |
|
||||
Дано: |
|
Решение: 3,2 г |
29,7 кДж |
||
mсеры= 3,2 г |
|
S(к)+ O2(г) = SO2(г) + Q ; Q = - Hр |
|||
Hр=-29,7 кДж |
|
1 моль |
1 моль х кДж |
||
|
|
M(S) =32 г/моль |
|
||
Найти: |
Hof,298 (SO2) |
|
|||
|
|
|
Составим пропорцию: |
3,2:32=29,7:х; х=297(кДж). |
|
|
|
|
Рассчитанный тепловой эффект реакции относится к |
||
|
|
|
образованию 1 моль SO2 из простых веществ в их |
||
|
|
|
устойчивых состояниях при стандартных условиях: |
||
|
|
|
Hof,298(SO2)=-297кДж/моль |
||
12

Ответ: Hof, 298(SO2)= -297 кДж/моль
Пример 3. Не производя расчетов, предскажите знак изменения энтропии системы при стандартных условиях для следующих процессов: 1)NH3(г)+HCl(г)=NH4Cl(к); 2) 2NH3(г)=N2(г)+3H2(г); 3)Ag+(р)+Cl-(р)=AgCl(к)
Решение. Прогноз без расчета Sреакции возможен в тех случаях, когда меняется объем системы, или агрегатное состояние вещества. Так, с
уменьшением объема системы, или при переходе вещества в кристаллическое состояние степень беспорядка уменьшается ( S<0).
1)Объем твердого продукта меньше объема исходных газов, т.е. упорядоченность системы возрастает, S<0.
2) В реакцию вступают два объема газа, а образуется 4 объема. В результате объем системы увеличивается, и степень беспорядка возрастает, S>0.
3) Ионы Ag+ и Cl- из раствора перешли в кристаллическое вещество, S<0. Пример 4. Теплота растворения хлорида бария BaCl2 равна 8,80 кДж/моль, а теплота растворения кристаллогидрата хлорида бария BaCl2 2H2O равна –20,53
кДж/моль. Вычислите теплоту гидратации при переходе BaCl2 в BaCl2 2H2O.
Дано: |
Решение: |
Qраств.(BaCl2)=8,80 кДж/моль |
Qраств.(BaCl2)=Qгидратации+Qраств(BaCl2 2H2O) |
Qраств(BaCl2 2H2O)=-20,53 кДж/моль |
Qгидратации=Qраств.(BaCl2)-Qраств(BaCl2 2H2O) |
Найти: Qгидратации |
Qгидратации=8,80–(-20,53)=29,33 (кДж/моль) |
Ответ: Qгидратации=29,33 кДж/моль.
Пример 5. Рассчитайте, возможно ли, протекание реакции восстановления оксида железа (II) водородом при температуре 25оС. Найдите температуру, выше которой указанная реакция может протекать самопроизвольно.
Дано: из табл.2: |
|
|
|
|
Решение: |
|||
В-во |
|
Hof298, |
|
So298, |
|
Gof298, |
FeO(к)+ H2(г)= Fe(к)+ H2O(г) |
|
|
|
|
||||||
|
|
кДж/моль |
|
кДж/моль К |
|
кДж/моль |
Go298 |
р=ΣΔGof298(прод)-ΣΔGof298 (исх.в-в) |
|
|
|
|
|
|
|
Go298 |
р=-228,6–(-244,3)=15,7(кДж) |
FeO(к) |
|
-264,8 |
|
0,061 |
|
-244,3 |
||
H2O(г) |
|
-241,8 |
|
0,190 |
|
-228,6 |
Из уравнения G= H-T S найдем Трав |
|
H2(г) |
|
0 |
|
0,130 |
|
0 |
При равновесии: |
|
Fe(к) |
|
0 |
|
0,027 |
|
0 |
G=0, |
H=T S, Tравн= H/ S |
|
|
|
|
|
|
|
Ho298 |
р=-241,8-(-264,8)=23(кДж) |
Найти: |
|
Травновесия. |
|
|
|
|
So298р=0,19+0,027-0,061-0,13=0,026 |
|
|
|
|
|
|
|
|
(кДж/К) |
|
|
|
|
|
|
|
|
Травн=23/0,026=884,6 К. |
|
Ответ: при Т = 298 К данная реакция невозможна т.к. Go298 р > 0. Самопроизвольное протекание прямого процесса возможно при Т> 884,6 К.
13
Задания для самостоятельной работы
Вариант 1 1.Рассчитайте стандартную энтальпию реакции взаимодействия оксида
углерода (II) с кислородом. Укажите, экзоили эндотермической будет данная реакция.
2.Тепловой эффект реакции С2Н5ОН(ж)+3О2(г)=2СО2(г)+3Н2О(г) составляет 1235 кДж. Рассчитайте количество энергии, выделяющейся при сжигании 100 г
этилового спирта.
3.Рассчитайте стандартную энтропию образования сульфата алюминия, если стандартная энтропия реакции 2Al2O3(к)+6SO2(г)+3O2(г)=2Al2(SO4)3(к) равна –
1727 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: MgO(к)+CO2(г)→MgCO3(к);
CO(г)+O2(г)→CO2(г); NaCl(к)+H2SO4(ж)→NaHSO4(к)+HCl(г).
5.Сделайте вывод о возможности самопроизвольного протекания процесса NO(г)+O2(г)→NO2(г) при стандартных условиях.
6.Рассчитайте температуру, выше которой реакция PbO(к)+C(к)=Pb(к)+CO(г) идет самопроизвольно.
Вариант 2 1.Рассчитайте стандартную энтальпию реакции окисления оксида железа
(II) кислородом до оксида железа (III). Укажите, экзоили эндотермической будет данная реакция.
2.Какую массу угля надо сжечь, чтобы получить 35000 кДж энергии? 3.Рассчитайте стандартную энтропию образования нитрата меди, если
стандартная энтропия реакции 2CuO(к+4NO2(г)+O2(г)=2Cu(NO3)2(к) равна - 867Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для процессов: KMnO4(к)→K2MnO4(к)+MnO2(к)+O2(г);
CaC2(к)+H2O(ж)→Ca(OH)2(к)+C2H2(г); ZnS(к)+O2(г)→ZnO(к)+SO2(г).
5.Сделайте вывод о возможности протекания при стандартных условиях
реакции: Na2O(к)+H2O(ж)→NaOH(к).
6.Рассчитайте Go реакции СаСО3(к)→СаО(к)+СО2(г) для стандартных условий. Определите температуру, выше которой реакция может протекать самопроизвольно.
Вариант 3 1.Рассчитайте стандартную энтальпию реакции СаО(к)+СО2(г)=СаСО3(к).
Укажите, экзоили эндотермической будет эта реакция.
2.Рассчитайте количество энергии, выделяющейся при сжигании 10 м3
(н.у.) ацетилена, если тепловой эффект реакции 2С2Н2(г)+5О2(г)=4СО2(г)+2Н2О(г) составляет 2600 кДж.
3.Рассчитайте стандартную энтропию реакции SO2(г)+H2S(г)→S(к)+H2O(ж). 4.Не производя расчетов, предскажите знак изменения энтропии при
стандартных условиях для каждого из процессов: CS2(ж)+O2(г)→CO2(г)+SO2(г); Al2(SO4)3(к)→Al2O3(к)+SO3(г); SO2(г)+H2S(г)→S(к)+H2O(ж).
14
5.Определите принципиальную возможность осуществления реакции
NH3(г)+O2(г)→NO(г)+H2O(г) в стандартных условиях.
6.Определите, могет ли быть восстановлен водородом оксид меди (CuO)
до Cu при 298 К и 500 К.
Вариант 4
1.Рассчитайте стандартную энтальпию восстановления оксида хрома (III) алюминием. Укажите, экзоили эндотермическим является данный процесс.
2.Теплота растворения Na2SO3 равна 11,3 кДж/моль, теплота гидратации этой соли Na2SO3→Na2SO3 7H2O составляет 58,16 кДж/моль. Вычислите теплоту растворения кристаллогидрата.
3.Рассчитайте изменение энтропии при стандартных условиях для
реакции CH4(г)+O2(г)→CO2(г)+H2O(г).
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: AgNO3(к)→Ag(т)+NO2(г)+O2(г);
H2O(г)+Fe(к)→H2(г)+Fe3O4(к); C(к)+O2(г)→CO2(г).
5.Сделайте вывод о возможности протекания при стандартных условиях
реакции СаО(к)+Н2О(ж)=Са(ОН)2(к).
6.Определите температуру, выше которой реакция C(к)+Fe2O3(к)→Fe(к)+CO(г) протекает самопроизвольно.
Вариант 5 1.Рассчитайте изменение энтальпии при стандартных условиях для
реакции KClO3(к)→KCl(к)+O2(г). Укажите, экзо или эндотермической будет эта реакция.
2.Вычислите количество тепла, выделяющееся при сгорании 100 м3
этилена по реакции C2H4(г)+O2(г)=CO2(г)+H2O(г).
3.Рассчитайте стандартную энтропию образования азотной кислоты, если значение стандартной энтропии реакции 4NO2(г)+O2(г)+2H2O(ж)=4HNO3(ж) равно
–681 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для процессов: Fe2O3(к)+CO(г)→Fe3O4(к)+CO2(г);
HF(г)+N2(г)→NF3(г)+H2(г); PbS(к)+O2(г)→PbO(к)+SO2(г).
5.Рассчитайте, будет ли самопроизвольно протекать реакция SO2(г)+H2S(г)=S(к)+H2O(ж) в изолированной системе при стандартных условиях.
6.Определите, при какой температуре равновероятно протекание прямого и обратного процессов SnO2(к)+2H2(г)=Sn(к)+2H2O(г).
Вариант 6 1.Рассчитайте изменение энтальпии при стандартных условиях для
реакции Са(ОН)2(к)=СаО(к)+Н2О(ж). Укажите экзоили эндотермической будет эта реакция.
2.Горение формальдегида НСОН протекает согласно уравнению НСОН(г)+О2(г)=СО2(г)+Н2О(ж); Нр=-560 кДж. Вычислите теплоту образования формальдегида.
15
3.Рассчитайте стандартную энтропию образования серной кислоты, если значение стандартной энтропии реакции 2H2O(ж)+2SO2(г)+O2(г)=2H2SO4(ж) составляет –527 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: Fe3O4(к)+CO(г)→FeO(к)+CO2(г);
As(к)+F2(г)→AsF3(г); NO(г)+O2(г)→NO2(г).
5. Сделайте вывод о возможности протекания при стандартных условиях
реакции СО2(г)+Н2О(ж)→С6Н12О6(к)+О2(г).
6.Определите, может ли быть восстановлен оксид магния до магния алюминием при 300 К.
Вариант 7 1.Расчитайте изменение энтальпии при стандартных условиях для
реакции Fe2O3(к)+CO(г)→Fe3O4(к)+CO2(г). Укажите, экзо или эндотермической является эта реакция.
2.По термохимическому уравнению 2NH3(г)+H2O(г)+SO3(г)=(NH4)2SO4(к); Нр=-451 кДж рассчитайте стандартную энтальпию образования сульфата аммония.
3.Рассчитайте стандартную энтропию образования продукта, если значение стандартной энтропии реакции H2O(г)+CO2(г)+2CuO(к)=[CuOH]2CO3(к) составляет –267 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: AsF5(г)→AsF3(г)+F2(г);
H2(г)+I2(г)→HI(г); Fe3O4(к)+H2(г)→FeO(к)+H2O(г).
5.Определите, может ли протекать самопроизвольно при стандартных условиях реакция SO2(г)+NO2(г)=SO3(г)+NO(г).
6.Рассчитайте Gо298 реакции С2Н4(г)→С2Н2(г)+Н2(г), определите температуру, при которой равновероятно протекание прямого и обратного
процессов.
Вариант 8 1.Рассчитайте стандартную энтальпию реакции
СаО(к)+Р2О5(к)→Са3(РО4)2(к). Укажите, экзоили эндотермическим является этот процесс.
2.На основании следующих термохимических уравнений:
С(алмаз)+О2(г)=СО2(г); -395,39 кДж/моль; С(графит)+О2(г)=СО2(г); -393,51 кДж/моль,
вычислите тепловой эффект превращения алмаза в графит.
3.Рассчитайте стандартную энтропию образования нитрата свинца, если значение стандартной энтропии реакции 2PbO(к)+4NO2(г)+O2(г)=2Pb(NO3)2(к) составляет –871 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: C2H2(г)+О2→CO2(г)+H2O(г);
CaO(к)+SO2(г)→CaSO3(к); H2S(г)+O2(г)→S(к)+H2O(г).
5.Сделайте вывод о возможности протекания при стандартных условиях реакции Al2O3(к)+H2O(г)→Al(OH)3(к).
16
6.Рассчитайте стандартную энергию Гиббса для реакции FeO(к)+CO(г)→Fe(к)+CO2(г), определите температуру, при которой равновероятно протекание прямого и обратного процессов.
Вариант 9 1.Рассчитайте стандартную энтальпию реакции
Fe3O4(к)+H2(г)→FeO(к)+H2O(г). Укажите, эндоили экзотермической является эта реакция.
2.Какое количество энергии выделится при получении 1 т карбида кальция по реакции СаО(к)+3С(к)=СаС2(к)+СО(г) при стандартных условиях?
3.Расчитайте стандартную энтропию образования нитрата магния 2Mg(NO3)2(к)=2MgO(к)+4NO2(г)+O2(г), если значение стандартной энтропии реакции +891 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: NH3(г)+O2(г)→NO(г)+H2O(г);
BaO(к)+CO2(г)→BaCO3(к); N2O(г)+O2(г)→NO(г).
5.Рассчитайте стандартную энергию Гиббса образования оксида железа (III) по следующим данным:
(I)2Fe(к)+O2(г)=2FeO(к); Gо298(I)=-490 кДж
(II)4FeO(к)+O2(г)=2Fe2O3(к); Gо298(II)=-504 кДж.
6.Вычислите стандартную энергию Гиббса для реакции восстановления оксида хрома(III) водородом. Определите температуру, выше которой процесс идет самопроизвольно.
Вариант 10 1.Рассчитайте значение стандартной энтальпии реакции
Fe2O3(к)+Mg(к)→Fe(к)+MgO(к). Укажите, экзо или эндотермической является эта реакция.
2. Определите тепловой эффект окисления 100 м3 аммиака по реакции 4NH3(г)+5O2(г)=4NO(г)+6H2O(г) при стандартных условиях.
3.Рассчитайте стандартную энтропию образования хромата аммония, стандартная энтропия реакции 2(NH4)2CrO4(к)=Cr2O3(к)+N2(г)+5H2O(ж)+2NH3(г) равна +661 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: CH4(г)+O2(г)→CO2(г)+H2O(г);
FeO(к)+C(к)→Fe(к)+CO(г); NH3(г)+O2(г)→N2(г)+H2O(ж).
5. Сделайте вывод о возможности протекания при стандартных условиях
реакции: NaOH(к)+CO2(г)→Na2CO3(к)+H2O(ж).
6. Определите, можно ли восстановить цинк магнием по реакции
ZnO(к)+Mg(к)→Zn(к)+MgO(к) при 1500 К.
Вариант 11
1.Вычислите стандартную энтальпию реакции PH3(г)+O2(г)→P2O5(к)+H2O(г). Укажите, экзоили эндотермической является эта реакция.
2.На основании следующих термохимических данных:
С(графит)+О2(г)=СО2(г); Н=-393,51 кДж, С(аморфный уголь)+О2(г)→СО2(г); Н =-409,20
кДж, вычислите тепловой эффект превращения графит→аморфный уголь.
17
3.Рассчитайте стандартную энтропию образования KClO4, если значение стандартной энтропии реакции 4KClO4(к) = 2KClO3(к) + 2KCl(к) + 5O2(г), равно
871Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: C2H4(г)+H2(г)→C2H6(г);
CO(г)+H2O(г)→CO2(г)+H2(г); NaOH(к)+CO2(г)→Na2CO3(к)+H2O(ж).
5.Определите возможность самопроизвольного протекания реакции
CH4(г)+O2(г)→CO2(г)+H2O(г) при стандартных условиях.
6.Рассчитайте стандартную энергию Гиббса для реакции MgCO3(к)=MgO(к)+CO2(г). Вычислите температуру, выше которой данная реакция протекает самопроизвольно.
Вариант 12
1.Вычислите стандартную энтальпию реакции H2S(г)+O2(г)→S(к)+H2O(ж). Укажите, экзоили эндотермической будет эта реакция.
2.По термохимическому уравнению NH3(г)+HCl(г)=NH4Cl(к); -175 кДж, вычислите стандартную энтальпию образования хлорида аммония.
3.Рассчитайте изменение энтропии при стандартных условиях для
реакции NaCl(к)+H2SO4(ж)→Na2SO4(к)+HCl(г).
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: C2H4(г)+H2O(г)→C2H5OH(г);
CaO(к)+C(аморф)→CaC2(к)+CO(г); H2(г)+O2(г)→H2O(г).
5.Рассчитайте стандартную энергию Гиббса образования оксида мышьяка
(V) из простых веществ:
(I)4As(к)+3O2(г)=2As2O3(к); Gо298(I)=-1178 кДж;
(II)As2O3(к)+O2(г)=As2O5(к); Gо298(II)=-193 кДж.
6.Рассчитайте, будет ли самопроизвольно протекать реакция
ZnS(к)+O2(г)→ZnO(к)+SO2(г) при 298 К и 1000 К.
Вариант 13
1.Для реакции FeO(к)+H2O(г)=Fe(к)+H2O(г) рассчитайте стандартную энтальпию. Укажите, экзоили эндотермической является эта реакция.
2.Теплота растворения хлорида бария равна 8,66 кДж/моль; теплота гидратации этой соли BaCl2→BaCl2 2H2O составляет 29,162 кДж/моль. Вычислите теплоту растворения кристаллогидрата.
3.Рассчитайте изменение энтропии при стандартных условиях для
реакции С(графит)+Н2О(г)=СО(г)+Н2(г).
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов:
(NH4)2Cr2O7(к)→Cr2O3(к)+N2(г)+H2O(г); C2H2(г)+H2(г)→C2H6(г); Cu(к)+Cl2(г)→CuCl2(к).
5.Сделайте вывод о возможности протекания при стандартных условиях
реакции Са(ОН)2(к)+СО2(г)→СаСО3(к)+Н2О(ж).
6.Рассчитайте стандартную энергию Гиббса реакции PbS(к)+3O2(г)=2PbO(к)+2SO2(г) Определите температуру, выше которой данная реакция идет самопроизвольно.
18
Вариант 14 1.Рассчитайте стандартную энтальпию реакции С2Н2(г)+Н2(г)=С2Н4(г).
Укажите, экзоили эндотермической является данная реакция .
2.Вычислить тепловой эффект перехода S(моноклинная)→S(ромбическая) по
следующим термохимическим данным: S(моноклинная)+O2(г)→SO2(г); Нр=-296,959
кДж; S(ромбическая)+O2(г)=SO2(г); Нр=-296,645 кДж.
3.Рассчитайте стандартную энтропию образования исходного вещества, если для реакции Na2CO3 10H2O(к)=2NaOH(к)+CO2(г)+9H2O(ж) значение стандартной энтропии составляет +1478 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при стандартных условиях для каждого из процессов: CO(г)+F2(г)→COF2(г);
C6H12O6(к)→C2H5OH(ж)+CO2(г); MgCO3(к)→MgO(к)+CO2(г).
5.Рассчитайте, будет ли протекать самопроизвольно при стандартных условиях реакция AgNO3(к)=Ag(к)+NO2(г)+O2(г).
6.Рассчитайте стандартную энергию Гиббса для реакции SO2(г)+H2S(г)→S(к)+H2O(ж), Рассчитайте температуру, при которой равновероятно протекание прямого и обратного процессов.
Вариант 15 1.Рассчитайте стандартную энтальпию реакции восстановления оксида
никеля(II) алюминием до свободного никеля. Укажите, экзоили эндотермической является данная реакция.
2.По термохимическому уравнению C2H6(ж)+ 3,5O2(г) = 2CO2(г)+ 3H2O(ж); -1559,8 кДж, рассчитайте стандартную энтальпию образования этана.
3.Рассчитайте стандартную энтропию образования сульфита натрия, если значение стандартной энтропии реакции 4Na2SO3(к) =3Na2SO4(к) +Na2S(к) равно –
60 Дж/К.
4.Не производя расчетов, предскажите знак изменения энтропии при
стандартных условиях для каждого из процессов: Fe2O3(к)+H2(г)→Fe3O4(к)+H2O(г);
C2H6(г)+O2(г)→CO2(г)+H2O(г); SO2(г)+O2(г)→SO3(г).
5. Сделайте вывод о возможности самопроизвольного протекания при стандартных условиях реакции FeS(к) +O2(г)→Fe2O3(к)+SO2(к).
6.Определите, будет ли самопроизвольно протекать реакция
Ca3(PO4)2(к)+C(к)+_SiO2(к)→CaSiO3(к)+CO(г)+P4(к) при 1300 К.
Тестовые задания для самоконтроля
1 Как называется энергия движения и взаимодействия всех частиц системы, за исключением кинетической энергии движения системы и потенциальной энергии ее в поле тяготения?
1)энтальпия;
2)внутренняя энергия;
3)потенциал Гиббса.
2. Как называется функция состояния, характеризующая теплосодержание системы при р=const?
1) энтальпия;
19
2)энергия Гиббса;
3)энтропия.
3. При абсолютном нуле энтропия всех тел равна 0- это:
1)Первый закон термодинамики;
2)Второй закон термодинамики;
3)Третий закон термодинамики.
4. |
Не |
прибегая к расчетам, определите знак изменения энтропии при |
|||||
стандартных |
|
условиях |
для |
реакций: |
a)2SO2(г)+O2(г)=2SO3(г); |
||
b)NH3(г)+HBr(г)=NH4Br(к). |
|
|
|
||||
1) |
a) |
S>0; |
b) |
S<0; |
|
|
|
2) |
a) |
S>0; |
b) |
S>0; |
|
|
|
3) |
a) |
S<0; |
b) |
S<0. |
|
|
|
5. Рассчитайте температуру равновесия для обратимой реакции, если |
|||||||
Нр0=260,3 кДж, |
Sр0=282 Дж/К: |
|
|
|
|||
1)0,92 К;
2)923 К;
3)1,08 К.
6. Как называются реакции, протекающие с выделением тепла?
1)гетерогенные;
2)экзотермические;
3)эндотермические.
7. Подводимая к системе энергия расходуется на увеличение внутренней энергии и совершение работы против сил внешнего давления - это:
1)Первый закон термодинамики;
2)Второй закон термодинамики;
3)Третий закон термодинамики.
8. Как называется критерий самопроизвольного протекания реакции при постоянном давлении?
1)энтальпия;
2)энергия Гиббса;
3)энтропия.
9. Функция состояния, характеризующая степень неупорядоченности системы, – это:
1)энтальпия;
2)энергия Гиббса;
3)энтропия
10. Какова стандартная энтальпия образования оксида бария – BaO в кДж/моль, если при окислении 0,2 моль бария выделилось 111,62 кДж тепла?
1)1116,2;
2)2232,4;
3)558,1.
20
