
75 группа 2 вариант / Химия / fischem
.pdfCm= |
177,92 |
|
1000 |
= 1,94 (моль/1000 г Н2О) |
||
|
98 |
(1112 −177,92) |
||||
|
|
|
||||
Ответ: СМ=1,82 моль/л, СН=3,64 моль-экв/л, Сm=1,94 моль/1000 г Н2О Пример 5. Произведите расчет для приготовления 40 мл 12%-ного
раствора азотной кислоты из имеющегося в лаборатории концентрированного
раствора (ρ=1,375 г/мл) и воды. |
|
||
Дано: |
|
Решение: |
|
V12% р-ра=40 мл |
|
W = mв−ва 100% ; mр-ра=ρ V; |
|
W(HNO3)=12% |
|
mр−ра |
|
|
ρ |
||
|
|
12%р-ра=1,068 г/мл ;m12% р-ра=1,068 40=42,72 (г) |
|
ρ(HNO3 конц)=1,375 г/мл |
|
Найдем массу безводной азотной кислоты в 42,72 г |
|
Найти:V(HNO3 конц), |
|
12%-ного раствора: m(HNO3)=42,72 0,12=5,13 (г). |
|
V(H2O). |
|
W(HNO3 конц)=60% или 0,6. |
|
Найдем массу 60% |
-ного раствора HNO3, содержащего 5,13 г безводной |
||
азотной кислоты: |
m60% р-ра=5,13/0,6=8,54 (г). |
|
|
Найдем объем 60%-ного раствора HNO3: V60% р-ра=8,54:1,373=6,22≈6 (мл)
Найдем объем добавляемой воды: m(H2O)=m12%р-ра – m60%р-ра m(H2O)=42,72-8,54=34,18 (г); ρ(H2O)=1 г/мл; V(H2O)=34,18≈34 (мл)
Ответ: для приготовления 40 мл 12%-ного раствора азотной кислоты
необходимо 6 мл 60%-ного раствора HNO3 и 34 мл воды.
Пример 6. Определите давление пара раствора при 40оС, содержащего 3,6 г глюкозы в 250 г воды. Давление пара воды при той же температуре равно
55,32 мм.рт.ст.
m (глюкозы) =3,6 г |
|
|
|
|
|
p0 |
− p0 |
|
|
|
n |
|
1 |
Решение: по закону Рауля |
2 |
1 |
= |
|
|
1 |
, или |
||||
|
|
p0 |
n |
2 |
+ n |
|||||||
m2 (H2O)=250 г |
|
|
|
|
|
|
2 |
|
|
1 |
|
|
р1= p2 |
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
n |
2 |
+ n |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
Р2=55,32 мм.рт.ст |
Найдем число молей С6Н12О6 |
(n1) и Н2О (n2): n=m/M |
||||||||||
|
M(С6Н12О6)=180 г/моль, n1=3,6:180=0,02(моль) |
|||||||||||
Найти: р1 |
М(Н2О)=18 г/моль, n2=250:18=13,89 моль |
|
||||||||||
|
р1=55,32 13,89/(13,89+0,02)=55,24 (мм.рт.ст.) |
|||||||||||
Ответ: р1=55,24 мм.рт.ст Пример 7. Определите температуру замерзания раствора, содержащего
0,8132 г нафталина в 25,46 г бензола. Температура замерзания бензола 5,5оС, а криоскопическая постоянная его 5,12.
Дано: |
Решение: Тз=ЕзСm; Сm= |
mр.в. |
1000 |
, Т |
= |
ЕЗ mр.в. 1000 |
|
m1(C10H8)=0,8132 г |
|
|
|
|
|||
M р.в. |
mр−ля |
М р.в. mр−ля |
|||||
m2 (С6Н6) =25,46 г |
М(С10Н8)=128г/моль, |
|
|
|
|
|
|
tЗ=5,5оС |
|
|
о |
|
|
||
|
|
|
|
|
|
||
EЗ=5,12 |
Тз=5,12 0,8132 1000/25,46 128=1,277 |
|
о |
||||
|
Тз=tЗ–t(з.ра-ра), t(з. ра-ра),=tЗ- Тз, t(з.ра-ра),=5,5-1,277=4,223 |
||||||
Найти: tзамерзания раствора. |
|||||||
|
Ответ: раствор замерзает при 4,223оС. |
|
|
||||
51

Пример 8. Определите массовую долю мочевины в водном растворе, если его температура кипения 100,174оС. Эбуллиоскопическая постоянная воды
0,512. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дано: |
о |
|
Решение: |
Тк=ЕкСm, Сm= |
mр.в. |
|
|
1000 |
, |
Т = |
Ек mр.в. 1000 |
|
||||||
|
M р.в. |
|
|
|
||||||||||||||
tк. р-ра=100,174 С |
|
|
|
|
|
|
|
mр−ля |
|
|
М р.в. |
mр−ля |
||||||
Ек=0,512. |
|
|
для |
100 |
г |
раствора |
|
mр-ля=(100 |
– |
mр.в.); |
||||||||
|
|
|
М(CO(NH2)2)=60г/моль |
|
|
|
|
|
|
|
|
|
||||||
Найти: ω%р.в. |
|
|
Тк=100,174 – 100=0,174о |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
0,512 mр.в.1000 |
|
|
|
|
|
||||||
|
|
|
Из уравнения 0,174 = |
|
находим mр.в.. |
|||||||||||||
|
|
|
(100 − mр.в. ) 60 |
|||||||||||||||
|
|
|
mр.в.=2 г. Т.е. в 100 г раствора - 2 г мочевины или 2%. |
|||||||||||||||
|
|
|
Ответ: раствор содержит 2% мочевины |
|
|
|
||||||||||||
Пример |
9. |
Определить |
активность хлорида |
|
железа |
(II) |
и |
среднюю |
||||||||||
активность ионов Fe2+ и Cl- в 0,05 моляльном растворе, если средний коэффициент активности f=0,62.
Дано: |
|
Fe |
2+ |
+2Cl |
- |
; a(FeCl2)=a(Fe |
2+ |
2 |
- |
f +,-=0,62 |
Решение: FeCl2 |
|
|
|
) a |
(Cl ). |
|||
Выражаем активности |
|
ионов через |
их |
||||||
|
моляльности |
|
|
|
|
|
|
|
|
Cm=0,05 моль/1000 г р-ля |
и средний коэффициент активности: |
|
|
|
|||||
Найти: а(FeCl2), a+,- |
a(Fe2+)=0,62 0,05=0,031; a(Cl-)=0,62 0,05 2=0,062 |
||||||||
|
a(FeCl2)=0,031 (0,062)2=1,192 10-4. |
|
|
|
|||||
|
a+,-=[ a(Fe2+) a2(Cl-)]1/3; a+,-=(0,031 0,0622)1/3=4,92 10- |
||||||||
|
2 |
|
|
|
|
|
|
|
|
Ответ: а(FeCl2)=1,192 10-4, a+,-= 4,92 10-2
Пример 10. Вычислить средний коэффициент активности и активность ионов в 0,02 моляльном растворе сульфата натрия при 25оС, коэффициент в уравнении Дебая – Хюккеля равен 0,5117.
Дано: |
|
Решение: находим ионную силу раствора: |
||||||||
С (Na2SO4)=0,002 |
моль/1000г |
|
|
|
2 |
|
|
2 |
)=0,006. |
|
m |
|
J=1/2(0,002 2 1 |
|
+0,002 2 |
|
|||||
воды. |
|
|
|
+ |
|
- |
|
√ |
||
Найти: f+,-; a(Na+); a(SO42-) |
z |
z |
||||||||
|
|
lgf = - A |
|
|
|
J1/2=-0,5117 1 2 |
0,006=- |
|||
|
|
0,07925 |
|
|
|
|
|
|
|
|
|
|
f+.-=0,8333. |
|
|
|
|
|
|
|
|
Активности ионов вычисляем по уравнению: а =f Сm. a(Na+)=0,8833 0,002 2=3,33 10-3 a(SO42-)=0,8833·0,002=1,67·10-3
Ответ: f=0,8333; a(Na+)=3,33 10-3; a(SO42-)=1,67·10-3
Задания для самостоятельного решения
Вариант 1 1.Вычислите давление пара 3% - ного водного раствора глицерина
C3H8O3, взятого при 25оС. Давление пара воды при этой температуре равно
23,76 мм. рт. ст.
52
2.Раствор 7,252 г глюкозы в 200 г воды замерзает при –0,378оС. Криоскопическая постоянная воды равна 1,86. Определите молекулярную массу глюкозы.
3.Найдите нормальную и моляльную концентрацию 36%-ного раствора серной кислоты (ρ=1,273 г/мл).
4.Какая масса кристаллогидрата Fe2(SO4)3 12H2O и воды потребуется для приготовления 50 г 3% раствора?
5.Определите активность хлорида калия и среднюю активность его ионов в 0,2 моляльном растворе, если средний коэффициент активности 0,718.
Вариант 2 1.Давление пара воды при 80оС равно 355,1 мм рт.ст. Рассчитайте
давление пара над раствором, содержащим 6 г мочевины СО(NH2)2 в 180 г воды?
2.При какой температуре замерзнет раствор 0,022 моль глюкозы в 100 г воды. Криоскопическая постоянная воды равна 1,86.
3.Рассчитайте нормальную и моляльную концентрацию КОН в его 10% растворе (ρ=1,115 г/мл).
4.Сколько г кристаллогидрата Ni(NO3)2 6H2O и воды потребуется для приготовления 72 г 5% раствора Ni(NO3)2?
5.Вычислите ионную силу раствора, содержащего следующие соли в молях на 1000г воды: 0,01 NaCl, 0,2 BaCl2, 0,05 Al(NO3)3.
Вариант 3 1.Определите относительное понижение давления пара над раствором,
содержащим 4,14 г салициловой кислоты С7Н6О3 в 100 г этилового спирта. 2.Определите температуру замерзания раствора 0,625 граммов мочевины
CO(NH2)2 в 50 г воды. Криоскопическая постоянная воды 1,86.
3.Сколько мл 96%-ного (ρ=1,840 г/мл) раствора серной кислоты необходимо для приготовления 500 мл 0,2 н раствора? Определите моляльную концентрацию полученного раствора.
4.Произвести расчет для приготовления 30 г 8% раствора BaCl2 из имеющегося в лаборатории кристаллогидрата BaCl2 2H2O и воды.
5.Определите активность нитрата натрия и среднюю активность его ионов в 0,05 моляльном растворе, если средний коэффициент активности 0,82.
Вариант 4 1.Какова моляльная, концентрация хлорида натрия в растворе,
полученном растворением 5 г этой соли в 45 г воды?
2.Давление пара над водой при 85оС равно 433,6 мм рт.ст. Определите давление пара над раствором, содержащим 12 г мочевины CO(NH2) в 360 г воды.
3.Определите температуру замерзания антифриза – 40% раствора этиленгликоля С2Н6О2, допустив, что закон Рауля справедлив для раствора указанной концентрации. Криоскопическая постоянная воды 1,86.
53
4.Сколько граммов кристаллогидрата Na2B4O7 10H2O потребуется для приготовления 100 мл 0,8 М раствора Na2B4O7?
5.Воспользовавшись уравнением Дебая-Гюккеля, вычислите средний коэффициент активности ионов и их активность в 0,001 моляльном растворе хлорида меди (II). А=0,5117.
Вариант 5.
1.Давление пара бензола (С6Н6) при 20оС равно 75,18 мм рт.ст. Вычислите, давление пара над раствором, содержащим 0,514 г дифениламина (C6H5)2NH в 50 г бензола при этой температуре.
2.Определите температуру замерзания раствора, содержащего 1,205·1023 молекул неэлектролита в 1 л воды. Криоскопическая постоянная воды 1,86.
3.Вычислите массовую долю азотной кислоты в 3,2 н растворе (ρ=1,12
г/мл).
4.Произведите расчет для приготовления 120 г 8% раствора Na2CO3 из имеющегося в лаборатории кристаллогидрата Na2CO3 10H2O и воды.
5.Определите активность сульфата цинка и среднюю активность его ионов в 0,01 моляльном растворе, если средний коэффициент активности 0,387.
Вариант 6 1.Давление пара над водой при 95оС равно 633,9 мм рт.ст. Определите
давление пара над раствором, содержащим 10 г мочевины CO(NH2) в 340 г воды.
2.Какова массовая доля фруктозы С6Н12О6 в водном растворе, который замерзает при –0,524оС? Криоскопическая постоянная воды 1,86.
3.Определите молярную, моляльную и нормальную концентрации 19%- ного раствора серной кислоты (ρ=1,14 г/мл).
4.Сколько граммов кристаллогидрата CoCl2 6H2O и воды потребуется для приготовления 140 г 3% раствора безводной соли?
5.Вычислите ионную силу раствора, содержащего следующие соли в молях на 1000г воды: 0,1 KNO3, 0,01 K2SO4, 0,02 FeCl3.
Вариант 7 1.Давление пара воды при 50оС равно 92, 5 мм рт.ст. Сколько моль
глюкозы надо растворить в 270 г воды, чтобы давление пара над раствором понизилось на 0,5 мм рт.ст.
2.При какой температуре замерзнет раствор, в 100 г которого растворено 0,5 г глюкозы С6Н12О6? Криоскопическая постоянная воды 1,86.
3.Определите молярную, моляльную и нормальную концентрацию 20%- ного раствора серной кислоты (ρ=1,143).
4.Произвести расчет для приготовления 80 г 7% раствора сульфата натрия из имеющегося в лаборатории кристаллогидрата Na2SO4 10H2O и воды.
5.Определите активность хлорида бария и среднюю активность его ионов в 0,1 моляльном растворе, если средний коэффициент активности 0,500.
54
Вариант 8 1.Вычислите давление пара воды над 5%-ным водным раствора глицерина
C3H8O3 при 25оС. Давление пара воды при этой температуре равно 23,76 мм. рт. ст.
2.Определите температуру замерзания раствора 0,8 граммов мочевины CO(NH2)2 в 80 г воды. Криоскопическая постоянная воды 1,86.
3.Определите молярную и моляльную концентрацию раствора, полученного при растворении 42,6 г сульфата натрия в 300 г воды, если плотность полученного раствора равна 1,12 г/мл.
4.Сколько граммов кристаллогидрата CuCl2 2H2O и воды потребуется для приготовления 170 г 15% раствора CuCl2?
5.Воспользовавшись уравнением Дебая-Гюккеля, вычислите средний коэффициент активности ионов и их активность в 0,001 моляльном растворе сульфата калия. А=0,5117.
Вариант 9
1.При 20оС давление пара над чистым сероуглеродом СS2 равно 298 мм рт.ст., а над раствором 5,168 г бензойной кислоты в 100 г сероуглерода, 293,2 мм рт.ст. Определите молекулярную массу бензойной кислоты.
2.Вычислите температуру кипения водного однопроцентного раствора глицерина С3Н8О3. Эбуллиоскопическая постоянная воды 0,512.
3.Какова молярная и моляльная концентрация 24% раствора азотной кислоты (ρ=1,145)?
4.Произведите расчет для приготовления 80 г 10% раствора сульфата магния из имеющегося в лаборатории MgSO4 7H2O и воды.
5.Определите активность сульфата натрия и среднюю активность его ионов в в 0,5 моляльном растворе, если средний коэффициент активности
0,266.
Вариант 10 1.Из 400 г 50%-ного раствора серной кислоты упариванием удалили 100 г
воды. Чему равна моляльная концентрация серной кислоты в оставшемся растворе?
2.Давление пара над водой при 90оС равно 525,7 мм рт.ст. Определите давление пара над раствором, содержащим 8 г мочевины CO(NH2) в 240 г воды при данной температуре.
3.Вычислите молекулярную массу бензальдегида , если раствор 1,612 г его в 100 г эфира С4Н10О кипит при 34,806оС. Температура кипения эфира 34,5оС, а эбуллиоскопическая постоянная его равна 2.
4.Сколько граммов кристаллогидрата Fe2(SO4)3 12H2O потребуется для приготовления 50 мл 0,2 М раствора этой соли?
5.Вычислите ионную силу раствора, содержащего следующие соли в молях на 1000г воды: 0,05CuSO4, 0,01 AlCl3, 0,2 Na2SO4.
55
Вариант 11 1.Давление пара бензола (С6Н6) при 20оС равно 75,18 мм рт.ст.
Вычислите, давление пара над раствором, содержащим 0,257 г дифениламина (C6H5)2NH в 25 г бензола при этой температуре.
2.Вычислите температуру кипения водного 5% раствора сахара С12Н22О11 Эбуллиоскопическая постоянная воды 0,512.
3.Сколько мл 96%-ного раствора серной кислоты (ρ=1,84 г/мл) надо взять для приготовления 1 л 0,5 н раствора? Какова моляльность полученного раствора?
4.Сколько граммов кристаллогидрата Na2S2O3 5H2O и воды потребуется для приготовления 48 г 7% раствора Na2S2O3?
5.Воспользовавшись уравнением Дебая-Гюккеля, вычислите средний коэффициент активности ионов и их активность в 0,002 моляльном растворе хлорида магния. А=0,5117.
Вариант 12 1.Давление пара раствора, содержащего 0,425 г анилина в 100 г эфира
(С4Н10О) при 20оС равно 440,9 мм рт.ст. Давление пара над чистым эфиром при той же температуре - 442,4 мм рт.ст. Определите молекулярную массу анилина.
2.Вычислите температуру кипения водного 3% раствора фруктозы С6Н12О6. Эбуллиоскопическая постоянная воды 0,512.
3.Определите молярную, моляльную и нормальную концентрацию раствора соляной кислоты (ρ=1,08 г/мл).
4.Произведите расчет для приготовления 50 г 13% раствора сульфата натрия из кристаллогидрата Na2SO4 10H2O и воды.
5.Вычислите ионную силу раствора, содержащего следующие соли в молях на 1000г воды: 0,002 Zn(NO3)2, 0,05 NaNO3, 0,001 Al2(SO4)3.
Вариант 13
1.Вычислите давление пара над раствором 5 г глицерина C3H8O3 в 100 г воды при 25оС. Давление пара воды при этой температуре равно 23,76 мм.рт.ст.
2.Вычислите массовую долю мочевины в водном растворе, который кипит при 100,128оС. Эбуллиоскопическая постоянная воды 0,512.
3.Определите молярную, моляльную и нормальную концентрацию 20%- ного раствора сульфата натрия(ρ=1,1 г/мл).
4.Рассчитайте массу воды и массу медного купороса (CuSO4 5H2O), необходимого для приготовления 180 г 8%-ного раствора CuSO4?
5.Вычислите ионную силу раствора, содержащего следующие соли в молях на 1000г воды: 0,01 KCl, 0,2 CuCl2, 0,05 AlCl3.
Вариант 14 1.Давление пара бензола (С6Н6) при 20оС равно 75,18 мм рт.ст. Вычислите,
давление пара над раствором, содержащим 0,4 г анилина С6Н7N в 50 г бензола при этой температуре.
2.Вычислите температуру кипения водного 5% раствора глицерина С3Н8О3. Эбуллиоскопическая постоянная воды 0,512.
56
3.Какой объем раствора серной кислоты с массовой долей 93% и воды потребуется для приготовления 80 г 60% раствора? Какова моляльность полученного раствора?
4.Сколько граммов кристаллогидрата Na2S2O3 5H2O потребуется для приготовления 200 мл 0,3 М раствора Na2S2O3?
5.Воспользовавшись уравнением Дебая-Гюккеля, вычислите средний коэффициент активности ионов и их активность в 0,002 моляльном растворе нитрата меди (II). А=0,5117.
Вариант 15 1.Давление пара над водой при 100оС равно 760 мм рт.ст. Определите
давление пара над раствором, содержащим 5 г мочевины CO(NH2) в 150 г воды. 2.Рассчитайте температуру кипения водного 10% раствора сахарозы
С12Н22О11. Эбуллиоскопическая постоянная воды 0,512.
3.Вычислите моляльность 9,28 н раствора гидроксида натрия (ρ=1,31
г/мл).
4.Произведите расчет для приготовления 76 г 12% раствора хлорида бария из имеющегося в лаборатории кристаллогидрата BaCl2 2H2O и воды.
5.Вычислите ионную силу раствора, содержащего следующие соли в молях на 1000г воды: 0,1 LiNO3, 0,01 K2SO4, 0,02 Fe(NO3)3.
Тестовые задания для самоконтроля
1. Растворы кипят при температуре, которая…
1.выше температуры кипения растворителя;
2.ниже температуры кипения растворителя;
3.выше температуры кипения растворенного вещества.
2. Осмотическое давление раствора на границе раствор-растворитель равно газовому давлению, которое было бы, если бы растворенное вещество находилось в газообразном состоянии и занимало бы объем раствора при той же температуре – закон…
1.Рауля;
2.Вант-Гоффа;
3.Шарля.
3. Число молей растворенного вещества, содержащихся в 1000 г растворителя –
1.мольная доля растворенного вещества;
2.нормальная концентрация;
3.моляльная концентрация.
4. Относительное понижение давления пара растворителя равно мольной доле растворенного вещества – закон…
1.Рауля;
2.Вант-Гоффа;
3.Шарля.
5. Число моль-эквивалентов растворенного вещества, содержащихся в литре раствора –
1.массовая доля растворенного вещества;
57
2.нормальная концентрация;
3.молярная концентрация.
6. lg f = - 0,51 z+ z- J1/2 – уравнение…
1.предельного закона Дебая-Хюккеля;
2.закона Вант-Гоффа;
3 закона Рауля.
7. J=1/2(C1Z2+C2Z2+…CiZi2) – уравнение расчета…
1.активности ионов;
2.осмотического давления.
3.ионной силы раствора.
8. Эффективная концентрация диссоциированной части электролита в растворе, учитывающая взаимное притяжение разноименных ионов –
1.ионная сила;
2.мольная доля;
3.активность ионов.
9. |
p0 |
− p0 |
= |
|
|
n |
- уранение… |
2 |
1 |
|
|
1 |
|||
|
p0 |
n |
2 |
+ n |
|||
|
|
|
|
||||
|
|
2 |
|
|
1 |
|
1.предельного закона Дебая-Хюккеля;
2.закона Вант-Гоффа;
3 закона Рауля.
10. Растворы с большим осмотическим давлением –
1.гипертонические;
2.изотонические;
3.гипотонические.
Ключи к тестовым заданиям
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
№ ответа |
1 |
2 |
3 |
2 |
2 |
1 |
3 |
3 |
3 |
1 |
58
4. ЭЛЕКТРОХИМИЯ Электрохимические процессы
Процессы взаимного превращения химической и электрической форм энергии – электрохимические процессы. Происходят они в гальванических элементах и электролизерах.
Электрохимические системы состоят из 2-х электродов погруженных в ионный проводник (проводник второго рода), который представляет собой раствор или расплав электролита. Электрод, на котором идет окисление – анод, восстановление – катод. Электроды могут быть инертными (Pt, Au, C) или растворимыми. Растворимые аноды окисляются, если анод не растворим, то окисляющееся вещество содержится в растворе. Электрический контакт между растворами электролитов осуществляется с помощью пористой перегородки или солевого «мостика», заполненного раствором электролита (KCl), который проводит ток благодаря наличию ионов, но препятствует смешиванию электролитов. Электроды (проводники первого рада) с включенными в цепь приборами образуют внешнюю цепь, растворы или расплавы электролитов (проводники второго рода) с солевым мостиком – внутреннюю цепь.
Понятие об электродном потенциале. Гальванический элемент.
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Между поверхностными ион-атомами металла, находящихся в узлах кристаллической решетки, и полярными молекулами воды, ориентированными у поверхности электрода, возникает электростатическое взаимодействие. В результате взаимодействия происходит окисление металла, и его гидратированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован:
М + mH2O = М(Н2О)mn+ + пе-
Металл становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл-раствор возникает двойной электрический слой (рис. 4.1).
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода. По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора. Наряду с этой реакцией протекает обратная реакция - восстановление ионов металла до атомов:
М(Н2О)mn+ + пе- = М + mH2O .
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратного процесса, устанавливается равновесие:
М+ mH2O <=> М(Н2О)mn+ + пе-
Или проще
М<=> Мn+ + пе-
59
Равновесие это имеет динамический характер. Процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал,
устанавливающийся в условиях равновесия электродной реакции, называется
равновесным электродным потенциалом. Абсолютные значения электродных потенциалов экспериментально определить невозможно. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов, приведенными в электрохимическом ряду напряжений.
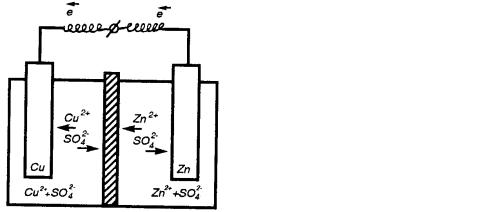
Гальванический элемент Даниэля — Якоби. Рассмотрим систему, в
которой два электрода находятся в растворах собственных ионов. Примером может служить гальванический элемент Даниэля— Якоби (рис. 4.2).
|
|
|
|
|
Рис.4.1.Двойной электрический |
Рис.4.2. Схема гальванического элемента |
|||
слой на границе раздела металл – |
|
Даниэля – Якоби |
||
электролит |
|
|
|
|
Он состоит из медной пластины, погруженной в раствор CuSO4, и цинковой пластины, погруженной в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины
возникает двойной электрический слой и устанавливается равновесие: Zn <=> Zn2+ + 2e-
В результате протекания этого процесса на цинке возникает определенный электродный потенциал. На поверхности медной пластины
также возникает двойной электрический слой и устанавливается равновесие: Cu <=> Cu2+ + 2e-,
поэтому и на меди образуется определенный электродный потенциал. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, в силу большей активности цинка, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
60
