
75 группа 2 вариант / Химия / fischem
.pdfТаким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде (анодный процесс) и выделения меди на медном электроде (катодный процесс). При этом в растворах нарушается соотношение катион – анион, т.к. в первом увеличивается концентрация цинка, а в другом уменьшается концентрация ионов меди. Через пористую перегородку или солевой мостик, заполненный раствором KCl, анионы из раствора, где их больше будут диффундировать туда, где их меньше. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Электродные процессы будут продолжаться до тех пор, пока потенциалы электродов не станут равными, не растворится весь цинк, или не высадится на медном электроде вся медь).
Условно гальванический элемент записывают разделяя металл и раствор одной вертикальной чертой, а растворы двумя:
(–) Zn | ZnSO4 || CuSO4 | Cu (+)
Разность потенциалов катода и анода – электродвижущая сила элемента (ЭДС):
Еэ=Ек - Еа (4.12)
Итак, при работе гальванического элемента Даниэля — Якоби протекают следующие процессы:
1.Реакция окисления цинка
Zn <=> Zn2+ + 2e.
2.Реакция восстановления ионов меди
Cu <=> Cu2+ + 2e.
3.Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов (SO42-) к аноду, катионов (Cu2+) к катоду.
Вследствие этой химической реакции: Zn + Cu2+ = Cu + Zn2+,
в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри гальванического элемента, т.е. электрический ток, поэтому
суммарная химическая реакция, протекающая в гальваническом элементе, называется образующей ток.
Измерение электродных потенциалов
Измерить потенциал одного единственного электрода невозможно, т.к. это означало бы измерить разность потенциалов электрода и раствора. Поэтому практически измеряют разность потенциалов между двумя электродами, то есть ЭДС гальванического элемента, причем потенциал одного электрода должен быть известен. В качестве стандартного электрода, относительно которого сравнивают потенциалы других электродов, служит водородный электрод, потенциал которого при стандартных условиях (а(Н+) = 1, р(Н2) = 1 атм.) международным соглашением принят равным нулю.
Например, потенциал медного электрода равен ЭДС гальванического элемента, в котором водородный электрод является анодом:
(–) Pt,H2 | 2H+ || Cu2+ | Cu (+)
61
Если в гальваническом элементе водородный электрод является катодом, то потенциал второго электрода будет иметь отрицательную величину по
отношению к стандартному водородному электроду: (−) Zn│Zn2+║2H+│H2,Pt (+).
Термодинамика электрохимических процессов.
В гальваническом элементе самопроизвольный химический процесс сопровождается понижением энергии Гиббса, которая равна максимальной полезной работе системы. В то же время производимая системой электрическая энергия равна:
А=nFЕ=- G , |
(4.13) |
где Е – ЭДС элемента, n-число электронов, участвующих в реакции. Из полученного уравнения следует, что
Е=- G/nF. |
(4.14) |
Следовательно, электродвижущая сила элемента (ЕЭ), как и |
потенциал |
Гиббса является мерой химического сродства, реагирующих веществ (т.е. определяет возможность самопроизвольного протекания электрохимического процесса).
Потенциал Гиббса связан с константой равновесия и активностями исходных веществ и продуктов реакции уравнением изотермы Вант-Гоффа:
- G=RTlnKc-RTln |
aCc aDd |
, |
(4.15) |
|
aAa aBb |
||||
|
|
|
подставив значение Е из уравнения (4.14) получим уравнение Нернста:
Е= |
RT |
ln Kc − |
RT |
ln |
aCc aDd |
, |
(4.16) |
|
nF |
aAa aBb |
|||||
|
nF |
|
|
|
|||
где первое слагаемое – ЭДС элемента при единичной активности каждого из веществ. Ее называют стандартной ЭДС и обозначают Е0. Ее нетрудно рассчитать по уравнению (4.14).
Уравнение Нернста показывает зависимость ЭДС от состава раствора. При низкой концентрации электролитов его можно записать в виде:
Е=Е |
0 |
RT |
[Re d]c [Ox ]d |
(4.17) |
||
- |
nF ln |
[Ox]a [Re d1 ]b . |
||||
|
|
|
|
1 |
|
|
Если в реакции участвуют ионы, определяющие среду, то их концентрации также входят во второе слагаемое в качестве сомножителей. Твердые вещества, металлы, концентрация воды, которая в растворах практически не изменяется, в уравнение не входят.
По данному уравнению рассчитывают и потенциалы металлов в растворах их солей (электродные потенциалы). Заменив натуральный логарифм десятичным, и подставив в уравнение, значения R, F, Т=298 К, получим:
Е=Е0+ (0,059/n)lg [Меn+], (4.18)
где Е0 – стандартный электродный потенциал, измеренный относительно водородного электрода при концентрации ионов Н+ равном 1, может быть измерен или рассчитан по термодинамическим данным.
Классификация электродов
62
Электроды подразделяют на электроды первого рода, второго рода, окислительно-восстановительные, ионнообменные.
Электроды первого рода:
1). Металл ионные электроды, обратимые относительно катионов: Меn++ne- Me – потенциал определяющая реакция.
Потенциал этих электродов зависит только от концентрации их ионов в растворе (см. уравнение (4.18)).
Сюда относятся амальгамные электроды: Cd2+/Cd(Hg) – элемент Вестона. Кадмий, как и некоторые другие металлы (Cu,Ag, Au, Zn), растворяется в ртути. В ртути активность металла уже не равна 1, поэтому потенциал амальгамного электрода зависит от активности самого металла в амальгаме и его ионов в растворе. Активность металла не равна его атомной доле в амальгаме, т.к. ртуть взаимодействует с металлом, поэтому потенциалы амальгамного и металл-ионного электродов не равны.
2). Неметалл ионные электроды, обратимые относительно аниона: Нем+ne- Немn- - потенциал определяющая реакция. Se+2e- Se2-.
E(Нем/Немn-)=Ео – (b/n) lg [Немn-], |
(4.19) |
где bo=RT/F
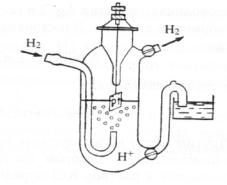
3). Газовые электроды. Примером газового электрода является водородный электрод: Н+/Н2,Pt. Водородный электрод состоит из платинированного платинового электрода, погруженного в одномоляльный раствор H2SO4, через который пропускается очищенный газообразный водород под давлением 1 атмосфера. Платина не принимает участия в электродных реакциях, а играет роль переносчика электрических зарядов и катализатора распада молекул водорода на атомы.
Рис. 4.3. Водородный электрод.
На границе платина – раствор устанавливается равновесие:
2H++2e- H2 адс.
Потенциал газовых электродов зависит как от активности окисленной формы вещества в растворе (Н+), так и от концентрации газообразного вещества (Н2), которая пропорциональна по закону Генри давлению его над раствором. Поэтому в уравнение Нернста подставляют вместо концентрации парциальное давление:
Е=(bo/2) lg[H+]/р (H2) = -bo pH – (bo/2) lgр(H2). (4.20)
Водород пропускают при давлении 1 атм, поэтому: Е=(bo/2) lg[H+].
63
При повышении рН раствора потенциал водородного электрода смещается от 0 к отрицательным значениям. В нейтральной среде (рН = 7) потенциал водородного электрода равен –0,41 В, в щелочной (рН = 14) соответственно –0,82 В.
Чтобы измерить потенциал любого электрода, составляют гальваническую цепь, в котором одним электродом является измеряемый, а другим водородный электрод.
Электроды второго рода.
Системы, в которых металл, покрытый слоем трудно растворимого соединения (соль, оксид, гидроксид), погружен в раствор одноименных анионов: Аn-/МА, М. Электролит необходим для уменьшения сопротивления раствора, а также для поддержания постоянной концентрации катионов, относительно которых обратим электрод. Примером такого электрода может служить хлорсеребряный электрод (Cl-/AgCl,Ag):
AgCl+e-=Ag+Cl-.
Активность катионов серебра определяется произведением растворимости труднорастворимого AgCl, и зависит от концентрации ионов хлора в электролите:
a (Ag+)=ПР(AgCl)/a(Cl-). |
|
E=Eo-bolg[Cl-]. |
(4.21) |
Окислительно-восстановительные электроды
Особый класс электродов, в процессах на которых не участвуют металлы и газы. Они представляют собой платину, погруженную в раствор, содержащий окисленную и восстановленную форму элемента. Платина при этом играет роль проводника. В растворах, содержащих по 1 молю окисленной и восстановленной форм, на платине возникает равновесный потенциал, значение которого приводится в таблице стандартных окислительно-восстановительных потенциалов. Величина потенциала характеризует окислительновосстановительные свойства системы: чем положительнее потенциал, тем сильнее окислительные свойства системы, и чем отрицательнее – тем выше восстановительные.
Ox+ne- Red.
Примеры Ox,Red/Pt: Sn4+,Sn2+/Pt; MnO4-,MnO42-/Pt.
o |
|
RT |
|
aOx |
|
EOx,Red=E |
+ |
|
ln |
|
(4.22) |
nF |
aRe d |
Ионнообменные электроды.
Состоят из ионита (полимер, содержащий ионы, способные обмениваться с ионами раствора) и раствора.
Мембранный потенциал (потенциал Доннана) возникает в системе из двух растворов электролитов, разделенных полупроницаемой мембраной.
Рассмотрим разделенные мембраной растворы 1)RCl и 2)KCl. Катионы R+ не проходят через мембрану, а ионы К+ и Cl- проходят. Примем, что активности анионов хлора изначально равны. В результате диффузии часть катионов калия
64
перейдет в первый раствор, заряжая его положительно, второй раствор зарядится отрицательно.
Потенциал Доннана (φм) связан с равновесными активностями катионов и анионов по обе стороны мембраны уравнением:
ϕм = RT ln a2K zF a1K
= |
RT ln |
a1A |
, |
(4.23) |
|
||||
|
zF a |
|
|
|
|
|
2 A |
|
|
где а1К, а2К – концентрации катионов; а1А, а2А - концентрации анионов, при условии, что заряды катионов и анионов равны по абсолютной величине.
Стеклянные мембраны применяются для создания электрода, который обратим по ионам водорода, подобно водородному электроду. Такие электроды используют для измерения рН, поскольку они удобнее водородных.
Стеклянный электрод содержит в стекле ионы Na+, которые могут обмениваться с Н+ ионами раствора:
Nac++Hp+ Nap++Hc+.
Константа равновесия этого процесса :
Кр= [Na+p][Hc+]/[Nac+][H+p].
Разность электрических потенциалов возникает на границе раствор – стекло в результате перераспределения между фазами обоих ионов. Показано, что величина мембранного потенциала пропорциональна концентрации ионов Н+ в растворе, поэтому его используют для измерения рН растворов:
Ест=Ео - bopH. (4.24)
Мембранные технологии. Процессы мембранного разделения ионов
(электродиализ, обратный осмос, ультрафильтрация) являются экономичными и эффективными процессами химической технологии. Они применяются для обессоливания морской воды до питьевой, очистки сточных вод с целью выделения ценных компонентов, для очистки и разделения растворов высокомолекулярных соединений в фармацевтической и пищевой промышленности.
Электродиализ – процесс разделения ионов солей, осуществляемый в многокамерном мембранном аппарате под действием постоянного электрического тока, направленного перпендикулярно плоскости мембраны. Электродиализный метод применяют для опреснения соленых вод, удаления растворенных солей из шахтных и других сточных вод.
Электродиализатор разделен чередующимися катионитовыми и анионитовыми мембранами, образующими поочередно концентрирующие и обессоливающие камеры. Через систему пропускают постоянный ток, под действием которого катионы, двигаясь к катоду, проникают через катионитовые мембраны, но задерживаются анионитовыми, а анионы, двигаясь к аноду, задерживаются катионитовыми мембранами. В результате ионы обеих знаков выводятся в смежные камеры, где концентрируются.
Мембраны для электродиализаторов изготовляют в виде гибких листов прямоугольной формы, в виде рулонов из термопластичного полимера (полиэтилен, полипропилен и др.) и порошка ионообменных смол. Ионообменные мембраны имеют заряженные группы, связанные с матрицей
65
мембраны. Ионы из состава этих групп обмениваются на ионы того же знака из раствора.
Некоторые мембраны сравнительно инертные в электрическом отношении, как, например, мембраны из ацетата целлюлозы, используют для опреснения воды за счет обратного осмоса.
Обратный осмос – процесс опреснения воды за счет фильтрации через специальные полупроницаемые мембраны, под давлением, превышающем осмотическое.
Электрохимические цепи
Электрохимические цепи делятся на химические и концентрационные.
В химических цепях источником энергии является химическая реакция. ЭДС их зависит от активности участвующих в процессе веществ и их химической природы. ЭДС цепи определяется по уравнению Нернста или как разность потенциалов катода и анода. Примеры:
гальванический элемент Даниэля-Якоби (медно-цинковый),
элемент Вестона (Cd,Hg/CdSO4 8/3H2O/Hg2SO4,Hg),
свинцовый аккумулятор (Pb/H2SO4/PbO2,Pb+) и другие.
Устройство и работа свинцового аккумулятора. Аккумуляторы – обратимые гальванические элементы. Свинцовый аккумулятор в незаряженном виде состоит из решетчатых свинцовых пластин, отверстия которых у отрицательных электродов заполнены губчатым свинцом, а у положительных - PbO2. В качестве электролита в аккумулятор заливается 30-процентный раствор
H2SO4. Pb+SO42- PbSO4+2e-
PbO2+4H++SO42- PbSO4+2H2O-2е-
_______________________________
Pb+PbO2+2H2SO4 2PbSO4+H2O
Работа источника тока - прямая реакция, зарядка аккумулятора – обратная.
В концентрационных цепях электроды и раствор имеют одинаковый качественный химический состав и отличаются тем, что активности окисленной и восстановленной формы одного и того же вещества на электродах неодинакова. На обоих электродах протекает одна и та же реакция, но в различных направлениях:
Red
Протекающий процесс заключается в переносе вещества с одного электрода на другой. Движущей силой процесса является выравнивание концентраций веществ в системе, которое осуществляется электрохимическим путем. Примеры: Zn,Hg/ZnSO4/Zn,Hg; Pt,H2/H2SO4/H2,Pt; Ag/AgNO3//AgNO3/Ag. Разное содержание цинка в амальгаме, разное давление водорода на электродах, разная концентрация соли в растворах ведут к разным значениям электродных потенциалов электродов, при замыкании которых возникает ЭДС цепи.
66
o |
a1Zn(Hg ) |
|
||
E=(b /2) lg |
|
|
, при а1>а2. |
(4.25) |
a2Zn(Hg ) |
||||
E=(bo/2) lg |
p1 |
, при р1>р2 . |
(4.26) |
|
|
||||
|
p2 |
|
||
В общем виде: Е= (bo/n) lg a1/a2 |
при а1>а2. |
|||
Концентрационные цепи без переноса ионов имеют солевой мост.
В концентрационных цепях с переносом ионов соприкасаются растворы различной концентрации, на границе раздела которых происходит перенос ионов из одного раствора в другой, что влияет на ЭДС цепи. Pt,H2/HCl:HCl/H2,Pt Когда активность ионов водорода в растворах различна, например, a1>a2 на
электродах будут соответственно идти реакции:
А(-) 0,5Н2 - е-=Н+ , К(+) Н++е-=0,5Н2 .
В прианодном пространстве будут накапливаться ионы Н+, а в прикатодном Сl-. Ионы оттуда, где их больше будут диффундировать туда, где их меньше. На границе раствор-раствор возникает диффузионный скачок потенциала вследствие неодинаковой подвижности катионов и анионов и градиента их концентраций. Ионы с большей подвижностью диффундируют в сторону второго раствора быстрее и образуют в растворе фронт одноименных ионов. Ионы с меньшей подвижностью образуют второй слой, противоположного знака, т.е. возникает ДЭС со скачком потенциала
Ед=(RT/F) |
la −lk |
ln |
a1 |
, |
(4.27) |
|
la +lk |
a2 |
|||||
|
|
|
|
где а1 и а2 – активности растворов, la , lk - подвижности ионов. Диффузионный потенциал не превышает 40 мВ. При точных измерениях его устраняют солевым мостиком, который содержит электролиты с одинаковой подвижностью катиона и аниона (KCl, NH4NO3).
Измерение ЭДС гальванических элементов
Электродвижущую силу гальванического элемента измеряют в условиях, позволяющих сохранить его обратимость. Это имеет место тогда, когда ток во внешней цепи равен нулю. Такому условию удовлетворяет компенсационный метод. Сущность его заключается в том, что сравнивают ЭДС измеряемого элемента с ЭДС другого источником тока. Когда значения ЭДС равны по абсолютной величине и противоположны по направлению, во внешней цепи отсутствует ток. Можно измерить ЭДС элемента также с помощью высокоомного вольтметра, имеющего большое внутреннее сопротивление.
Химические источники тока
Химические источники тока подразделяют на:
а) гальванические элементы (первичные элементы) – источники тока одноразового действия, после расходования реагентов становятся неработоспособными;
б) аккумуляторы (вторичные элементы), которые можно использовать многократно, так как при пропускании постоянного тока от внешнего
67
источника происходит регенерация израсходованных реагентов (зарядка аккумулятора);
в) топливные элементы способные непрерывно работать в течение длительного времени, пока к электродам подводятся реагенты.
В топливных элементах токообразующей реакцией является окисление водорода:
А(–) – окисление H2:
H2 –2ē → 2H+
K(+) – восстановление О2:
О2 + 4Н+ +4ē → 2H2O
Топливные элементы различаются устройством электродов, и составом электролита. Так твердотопливный элемент имеет пористые катод и анод, активированные платиновыми металлами, и электролит - керамический материал, проводящий ионы O2–, обычно – ZrO2, легированный Y2O3. В карбонатном топливном элементе электролит – смесь карбонатов натрия и калия, содержащаяся в керамической матрице LiAlO2. Фосфорнокислый элемент в качестве электролита содержит 100%-ную фосфорную кислоту, содержащуюся в матрице из карбида кремния. Щелочной элемент – концентрированный раствор КОН. Роль электролита может выполнять и полимерная, проводящая ионы водорода мембрана (топливный элемент с протонпроводящей мембраной). Широта применения определяется их КПД (от 40 до 80%), габаритами, экономичностью. Они используются как небольшие стационарные источники тока, применяются на транспорте в больницах и аэропортах, в качестве резервных, в космических аппаратах.
Кинетика электродных процессов
Когда электрохимическая система находится под током, равновесие
Ox-ne- Red
на электродах нарушается. На катоде: Ox+ne- →Red,
на аноде: Red→Ox+ne-.
Мера скорости электродной реакции – плотность тока (сила тока, отнесенная к единице площади поверхности электрода). В отсутствии тока
ik=ia = i0, (4.27)
где i0 – плотность тока обмена, мера скорости обменного процесса в условиях равновесия, зависит от природы реакции и концентрации, участвующих веществ. При замыкании цепи или наложении электрического тока от внешнего источника равновесие на электродах нарушается, на катоде оно смещается в сторону восстановления, на аноде - окисления. Поскольку электроны от анода к катоду во внешней цепи протекают быстрее, чем происходят электродные реакции, то на катоде электроны накапливаются, а на аноде накапливаются положительные заряды. Потенциалы электродов при этом смещаются в отрицательную и положительную стороны соответственно. Изменение потенциала от равновесного при протекании внешнего тока называется
электрохимической поляризацией электродов:
68

ηк=Ер - Еi (катодная поляризация), |
(4.28) |
ηа=Еi - Ер (анодная поляризация). |
(4.29) |
Электродная поляризация – функция плотности тока, чем выше плотность – тем больше поляризация.
Электродный процесс под током – гетерогенная реакция, состоящая из стадий:
1.Транспорт реагирующих веществ из объема раствора к поверхности электрода и обратный транспорт продуктов.
2.Электрохимическая реакция – переход электронов и ионов через границу раздела раствор – металл (разряд, ионизация).
3.Фазовые превращения. Образование или разрушение кристаллической решетки, формирование и выделение газов.
4.Химические реакции, предшествующие или последующие электрохимической стадии.
Первая и вторая стадии присущи всем электродным процессам, остальные - отдельным процессам.
Скорость электродного процесса определяется скоростью наиболее медленной стадии, которая называется лимитирующей. Если природа лимитирующей стадии известна, то вместо «поляризация» употребляют термин «перенапряжение»: перенапряжение диффузии (ηд), перенапряжение электронного перехода или электрохимическое перенапряжение (ηэ), перенапряжение фазового перехода (ηф), перенапряжение реакции (ηр).
η=ηд+ηэ+ηр+ηф. (4.30)
Хотя в каждом конкретном случае определяющим может быть один вид перенапряжения.
Перенапряжение выделения водорода.
При электролизе водных электролитов часто выделяется водород. а) в кислой среде: 2Н++2е-=Н2;
б) в нейтральной и щелочной: 2Н2О+2е-=Н2 +2ОН-.
Выделение водорода сопровождается значительным перенапряжением, зависящим от природы электрода, состава раствора и условий электролиза (плотности тока). Зависимость перенапряжения от плотности тока выражается уравнением Тафеля:
η=а +blgi . |
|
|
|
|
|
|
|
|
(4.31) |
||
Постоянные а и b отражают влияние материала электрода. |
|
|
|||||||||
|
|
|
|
|
|
|
Ag |
Таблица 4.2 |
|
||
Металл |
Pt |
Au |
Co |
Ni |
Fe |
Cu |
Sn |
Cd |
Hg |
Pb |
|
а |
0,10 |
0,4 |
0,62 |
0,63 |
0,7 |
0,87 |
0,95 |
1,20 |
1,4 |
1,41 |
1,56 |
b |
0,03 |
0,12 |
0,14 |
0,11 |
0,12 |
0,12 |
0,10 |
0,13 |
0,12 |
0,11 |
0,11 |
а – перенапряжение при I=1А/см2, b – 2,3RT/αnF ≈ 0,11 – 0,12, где α=0,5 –
коэффициент переноса. Считается, что перенапряжение водорода определяется стадией замедленного разряда.
Зависимость скорости химического процесса (W) от концентрации реагирующих веществ [H+], энергии активации (Ea0) и температуры (T) в
69
соответствии с законом действия масс и уравнением Аррениуса можно записать:
+ m |
|
E 0 |
|
|
|
a |
|
||
W=k[H ] |
exp( − |
|
) |
(4.32) |
RT |
||||
При изменении потенциала электрода изменяется энергия активации процесса:
Еa = Ea0 - αnη, (4.33)
знак минус указывает на катодную поляризацию в соответствии с уравнением (4.28). Скорость электродного процесса характеризуется величиной тока, поэтому можно записать:
+ m |
|
|
|
E 0 |
−αηF |
|
|
|
|
|
a |
|
|
|
|
ik=n F W = n F k [H ] |
exp( |
|
|
|
|
) |
(4.34) |
|
|
|
RT |
||||
|
|
|
|
|
|
|
|
После преобразований и замены произведения всех постоянных величин |
|||||||
на К- получим уравнение Эрдей –Груза и Фольмера: |
|
||||||
ik=K-[H+]mexp(-αn Fεi/RT) или |
|
|
(4.35) |
||||
ik=K-[H+]mexp(-2,3εi/bk),
где bk = 2,3RT/αn F=0,059/αn - постоянная величина.
Из уравнения Эрдей-Груза и Фольмера следует, что скорость электродного процесса зависит от величины потенциала электрода (εi).
Коррозия металлов
Разрушение металлов под действием факторов окружающей среды называется коррозией.
По механизму протекания различают химическую и электрохимическую коррозию. Химическая коррозия – гетерогенный процесс, протекающий при высоких температурах, в атмосфере агрессивных газов (газовая коррозия), или в среде жидких неэлектролитов. Газовой коррозии подвержена арматура печей, детали двигателей внутреннего сгорания, лопатки турбин. Скорость химической коррозии зависит от свойств пленки продуктов коррозии, которые образуются на металле. Если образующаяся пленка сплошная и плотная, химически стойкая, имеет коэффициент объемного расширения близкий к таковому металла, то она затрудняет диффузию кислорода или другого агрессивного газа к поверхности металла, и таким образом тормозит коррозию. Такие пленки формируются на алюминии, никеле, нержавеющих сталях.
Электрохимическая коррозия - разрушение металла в среде электролита.
Поверхность металлов неоднородна. На поверхности металла имеются дефекты кристаллической решетки, примеси других металлов, включения соединений с неметаллами и интерметаллические соединения, продукты взаимодействия с окружающей средой (оксиды, гидроксиды, соли, грязь), неровности поверхности. Эти участки поверхности металла в растворе электролита будут иметь другой, отличный от основного металла потенциал. Таким образом, на поверхности металлов создается система локальных, коротко замкнутых через металл гальванических элементов. Работа этих
70
