
75 группа 2 вариант / Химия / fischem
.pdf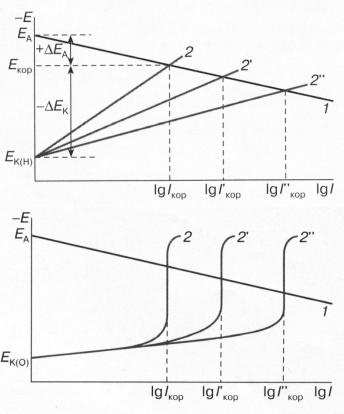
микроскопических элементов сопровождается коррозионным разрушением металла.
Рассмотрим модель гальвано-пары железо-медь в кислой и нейтральной средах. Железо, как более активный металл, имеющий более отрицательный
потенциал будет анодом (-): Fe – 2e- = Fe2+.
Медь, как более положительный металл будет катодом (+). При этом в зависимости от рН среды на катоде могут протекать реакции восстановления водорода (водородная деполяризация) или кислорода (кислородная деполяризация) из раствора, в котором находится металл.
Всреде электролита между катодным и анодным участками потечет ток, что приведет к смещению потенциала железа в положительную, а меди в отрицательную сторону пока значения их потенциалов не сравняются. Потенциал металла примет значение потенциала коррозии. Сказанное интерпретируется диаграммой Эванса. Диаграмма представляет собой графическое изображение взаимосвязи между током и потенциалом реакций ионизации металла и восстановления деполяризатора на электродах гальванического элемента. Эти зависимости линейны в координатах Е – lgi (рис. 4.1).
Вкислой среде на катоде будет протекать процесс:
2Н+ +2е-=Н2↑.
Рис.4.4. А. Диаграмма Эванса для коррозии металла с водородной деполяризацией: 1 – анодная кривая растворения основного металла; 2,2’,2’’ – катодные кривые выделения водорода на катодных участках и соответствующие им токи коррозии при различных рН.
В. Диаграмма Эванса для коррозии металла с кислородной деполяризацией. 2,2’,2’’ – катодные кривые восстановления кислорода при разной скорости перемешивания раствора.
В промышленных центрах атмосфера содержит загрязняющие газы: SO2, NO2, CO2, H2S и др., которые растворяясь в воде, дают кислоты, агрессивные по
71
отношению к металлам. В нейтральной среде (при достаточно чистой
атмосфере) из раствора восстанавливается растворенный в воде кислород:
О2+2Н2О +4е- =4ОН-.
Для того чтобы коррозия имела место необходимо условие –
электродный потенциал металла должен быть отрицательнее потенциала окислителя (деполяризатора).
Потенциал газовых электродов зависит от рН:
Зависимость потенциала газовых электродов от рН |
Таблица 4.3 |
|||
|
||||
pН |
Е(2Н+/Н2,Pt), В |
Окисляющиеся |
Е(О2/2ОН-), В |
Окисляющиеся |
раствора |
|
металлы |
|
металлы |
0 |
0,0 |
← Pb |
1,23 |
← Hg |
7 |
-0,414 |
← Fe |
0,815 |
← Аg |
14 |
-0,828 |
Щелочные и |
0,401 |
← Cu |
|
|
щ-зем., Zn, Al |
|
|
Большинство металлов могут подвергаться коррозии с кислородной деполяризацией, но процесс этот медленный, т.к. кислород мало растворим в воде, и скорость его подвода к металлу невелика. Поступающий к поверхности металла кислород практически весь сразу же восстанавливается. Ток катодной реакции достигает своего максимального значения – предельный ток. Величину предельного тока восстановления кислорода можно изменить перемешиванием электролита, которое ускорит подвод кислорода к поверхности.
Пассивность металла – состояние повышенной коррозионной устойчивости металлов, которое не соответствует их термодинамической устойчивости. Так металлы Fe,Cr, Al устойчивы в концентрированной HNO3, Fe, Ni – в растворе NaOH, Al - на воздухе. Причина – формирование хемосорбированного слоя атомов кислорода на активных центрах поверхности металла. С возможной его трансформацией в фазовый оксид.
Для многих металлов с незавершенным d–слоем при смещении потенциала положительнее потенциала коррозии характерно резкое торможение процесса ионизации металла – переход в пассивное состояние. На этом свойстве металлов основан способ защиты от коррозии – анодная защита.
Защита металлов от коррозии. 1).Электрохимическая защита:
а) Анодная защита – перевод пассивирующихся металлов (Fe, Ni, Cr, Mo, Ti, Zr) в пассивное состояние анодным током высокой плотности (для нержавеющей стали в 66%-ном растворе H2SO4 плотность тока составляет 6 А/м2) и дальнейшее поддержание пассивного состояния незначительным по величине током (10-3 А/м2).
б) Катодная защита - соединение с отрицательным полюсом источника тока защищаемого изделия, анод при этом – вспомогательный инертный электрод. Так защищают буровые платформы, подземные трубопроводы и т.д.
72

Катодная защита протекторами более активных металлов (Mg, Zn, Al, их сплавы). Протектор играет роль анода, его растворение обеспечивает протекание катодного тока через защищаемый металл. Используется для защиты днищ судов, трубопроводов.
2)Легирование сплавов – введение в сплавы добавок, повышающих химическую стойкость металла.
3)Изоляция поверхности металлов от воздействия окружающей среды нанесением различных покрытий (краски, лаки, смазки и т. д.).
4)Ингибирование среды – введение ингибиторов - веществ, которые адсорбируюсь на активных центрах поверхности металла, понижают скорость коррозии. Ингибитор может тормозить катодную реакцию (катодные ингибиторы), анодную (анодные ингибиторы) или обе реакции (катодноанодные ингибиторы). При этом наряду с уменьшением скорости коррозии происходит смещение потенциала соответственно в сторону отрицательных или положительных значений. В присутствии катодно-анодного ингибитора потенциал практически не изменяется. Ингибирование применяется при травлении металлов, при этом тормозится процесс наводораживания металлов (диффузии водорода в кристаллическую решетку металла), что предотвращает ухудшение их механических свойств. Введение ингибиторов в горючесмазочные материалы снижает их коррозионную агрессивность, уменьшает изнашивание деталей при трении. Летучие ингибиторы используют для пропитки упаковочной бумаги, ее помещают в герметизированную тару для транспортировки металлоизделий и т.д.
Электролиз.
Электрохимическим процессом, в котором электрическая энергия превращается в химическую, является электролиз. Электролизер – электрохимическая система, состоящая из электродов и электрохимической ванны с раствором или расплавом электролита. Электродами называются проводники с электронной проводимостью (проводники первого рода), находящиеся в контакте с ионным проводником (второго рода). Для протекания процесса систему соединяют с источником постоянного тока при помощи проводников первого рода (внешняя цепь). Катод электролизера соединяется с отрицательным полюсом источника тока, на нем проходит восстановление ионов электролита избытком электронов от источника тока. Анод соединен с положительным полюсом, на нем проходят процессы окисления.
Анод электролизера может быть инертным, не изменяющимся (C, Pt), или активным, растворяющимся в процессе электролиза: Ме-nе-=Меn+ Так аноды делают из неочищенной меди при ее рафинировании, из никеля и хрома при нанесении покрытий из этих металлов на различные изделия.
При электролизе расплавов солей на катоде восстанавливаются ионы металлов, на аноде – окисляются ионы неметаллов:
ScCl3→Sc3++Cl- |
3 2 |
K(-) Sc3++3e-=Sc |
73

A(+) 2Cl—-2e-=Cl2 2 3
ScCl3→Sc + Cl2
Присутствие воды – особенность электролиза растворов, поскольку вода может подвергаться электролизу.
На катоде восстанавливаются катионы в порядке уменьшения их электродного потенциала. Катионы металлов, стоящих после водорода, полностью восстанавливаются из растворов. Катионы металлов от Mn – до H восстанавливаются параллельно с водородом из-за высокого перенапряжения водорода. Катионы левее Al восстановить из растворов нельзя, т.к. идет восстановление воды: 2H2O+2e-→H2+2OH-.
На инертных анодах окисляются простые анионы в порядке повышения их потенциала: S2– (E° = 0,17 В), I– (E° = 0,536 В), Br– (E° = 1,065 В), Cl– (E° = 1,359 В). или молекулы воды: 2Н2О-4е-→О2+4Н+. Кислородсодержащие анионы (SO42-, NO3-, PO43-, CO32-) в водных растворах практически не окисляются.
Однако, в концентрированных растворах анионы кислородных кислот (SO42–, NO3– и др.) могут при разрядке отдавать кислород или перестраиваться. Например, электролиз концентрированного раствора H2SO4 приводит к образованию надсерной кислоты на аноде:
2H2SO4 –2ē → H2S2O8 + 2H+, E° = +2,01 B.
Рассмотрим электролиз сульфата марганца, который диссоциирует в растворе на ионы марганца и сульфат-ионы. Из-за перенапряжения водорода ионы марганца могут восстанавливаться из раствора на катоде. Кислородсодержащие ионы SO42- не будут окисляться на аноде. На аноде будут окисляться молекулы воды с выделением газообразного кислорода. В прианодном пространстве будут накапливаться ионы водорода, рН раствора
возле анода будет понижаться. |
|
|
|
|
|
|
|
||||
|
|
MnSO4→Mn2++SO42- |
|
|
|
|
|
|
|
||
|
|
K(-) |
Mn2++2e-=Mn |
2 |
2 |
|
|
|
|
|
|
|
|
A(+) |
2Н2О-4е-=О2+4Н+. |
4 |
1 |
|
|
|
|
|
|
|
|
2MnSO4+2H2O→2Mn+O |
2+2H |
2SO4 |
|
|
Таблица4.3 |
||||
|
|
|
|
Электролиз солей с разным типом ионов |
|||||||
|
|
|
|
|
|
|
|||||
|
|
Процесс |
|
|
Пример |
|
Примечание |
|
|||
|
|
|
Концентрация |
соли |
|
||||||
1. Разряжаются катион и |
CuCl2 + (H2O) → Cu + Cl2 |
|
|
||||||||
анион соли |
|
катод (–): Cu2+ +2ē → Cu0 |
|
уменьшается |
|
|
|||||
|
|
|
|
анод (+): 2Cl– –2ē → Cl2 |
|
Изменяется |
|
|
|||
2. |
Разряжаются |
катион |
2CuSO4 + H2O → 2Cu + O2 + SO42– |
|
|
|
|||||
соли и вода |
|
катод (–): Cu2+ +2ē → Cu0 |
|
качественный |
|
|
|||||
|
|
|
|
анод (+): 2H2O –4ē → O2 + 4H+ |
|
состав раствора |
|
|
|||
3. |
Разряжаются |
анион |
2NaCl + 2H2O → 2NaOH + Cl2 + H2 |
|
Изменяется |
|
|
||||
соли и вода |
|
катод (–): 2H2O +2ē → H2 + 2OH– |
|
качественный |
|
|
|||||
|
|
|
|
анод (+): 2Cl– –2ē → Cl2 |
|
состав раствора |
|
|
|||
4. |
Ионы соли не |
Na2SO4) + 2H2O → 2H2 + O2 |
|
Концентрация |
соли |
|
|||||
разряжаются |
|
катод (–):2H2O +2ē → H2 + 2OH– |
|
увеличивается |
|
|
|||||
|
|
|
|
анод (+):2H2O –4ē → O2 + 4H+ |
|
|
|
|
|||
74
Характер течения электродных процессов зависит от состава раствора, концентрации, природы электролита, рН, материала электрода, плотности тока, присутствия добавок.
Напряжение разложения − напряжение, которое необходимо приложить к электролизеру для осуществления электролиза:
Uэ=Ea-Ek+ΣU, |
(4.36) |
где Еа и Ек- потенциалы анода и катода при рабочей плотности тока, ΣU – |
|
падение напряжения на |
преодоление омического сопротивления цепи |
(контактов, раствора, электродов). (Ea-Ek) – напряжение разложения электролита, которое в свою очередь равно сумме обратимого напряжения разложения и перенапряжения на электроде:
Еразл=Еа-Ек=(Еао-Еко)+(ηа+ηк), |
(4.37) |
|
где Еао-Еко=Ео |
разл – обратимое напряжение разложения электролита, численно |
|
равное ЭДС реакции, которое можно рассчитать по термодинамическим данным: nFЕ=- G.
Законы Фарадея. В 1833 г. английский ученый М. Фарадей (1791-1867) открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде.
С учетом современной терминологии законы Фарадея можно записать в следующем виде:
1.Количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2.Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Масса металла, осаждающегося на катоде, рассчитывается по формуле:,
m=AIτ/nF |
(4.38) |
где А –молярная атомная масса металла, I- сила тока в А, τ - время в сек, F – число Фарадея –96500 кул., n-число электронов, принимающих участие в электродной реакции. А/n – молярная масса окислительно-восстановительного эквивалента.
Таким образом, зная количество вещества, испытывающего превращения на электроде, можно рассчитать теоретическое количество электричества, которое должно пройти через электрохимическую ячейку, что используется в физико-химическом методе анализа – кулонометрии.
На практике часто количество выделяющегося вещества бывает меньше, чем это следует из законов Фарадея. Часть электроэнергии в процессе электролиза теряется на восстановление водорода, рассеивается в виде тепла и др. Для оценки потерь энергии на побочные реакции используется понятие - выход по току (η). Выход по току - отношение массы металла, выделившегося
на электроде, к массе металла, рассчитанной по уравнению Фарадея: |
|
η=(mпракт/mтеор)·100%. |
(4.39) |
75
Применение электролиза
Электролиз широко применяется в технике .
1.Получение активных металлов. Щелочные, щелочно-земельные металлы, алюминий, магний получают электролизом расплавов их солей. Цинк, никель, кобальт, свинец и др. – электролизом растворов их солей.
2.Очистка (рафинирование) металлов, например, меди.
2.Электрохимическая очистка поверхностей металлов от загрязнений – электрохимическое травление.
3.Электрополировка металлов при сложных конфигурациях деталей.
4.Анодное оксидирование поверхностей изделий для защиты металлов от коррозии и декоративных целей, например: оксидирование стали, алюминия, медных сплавов.
5.Гальванические покрытия (гальваностегия) одного металла другим с целью защиты от коррозии, упрочнения поверхности (твердое хромирование), а также получения декоративного покрытия (никелирование, хромирование).
6.Получение точных металлических копий (гальванопластика) с рельефных предметов путем осаждения металла (обычно меди).
7.Получение химических веществ: растворов щелочей, фтора, хлора, водорода, перекиси водорода и др.
Экспериментальная часть
Опыт 1. Электролиз раствора сульфата натрия. В U-образный сосуд
(электролизер) налить наполовину раствор Na2SO4 и добавить в раствор несколько капель лакмуса. Зачищенные наждачной бумагой и промытые водой графитовые электроды опустить в электролизер и включить в сеть постоянного тока. Электролиз проводить до изменения окраски лакмуса.
Записать наблюдения, написать уравнения электродных реакций и суммарное уравнение реакции электролиза. Объяснить наблюдаемое изменение окраски индикатора, обозначить роль сульфата натрия.
Опыт 2. Электролиз раствора иодида калия. В электролизер налить раствор KI, опустить электроды, включить их в сеть. В колено электролизера, где раствор приобрел желтую окраску добавить крахмал, в другое колено, где наблюдалось выделение газа, добавить фенолфталеин. Какие продукты образовались в результате электролиза? Напишите уравнения анодной и катодной реакций, суммарное уравнение электролиза. Объясните направленность процесса электролиза.
Опыт 3. Электролиз раствора ацетата свинца. Налить в электролизер раствор Pb(CH3COO)2 и провести электролиз на зачищенных графитовых электродах. Написать уравнения электролиза, объяснить направленность процессов.
76
Переключите полярность электродов. Что наблюдаете? Почему? Напишите уравнения соответствующих процессов.
Опыт 4. Электролиз раствора серной кислоты. В электролизер налить кислоты и опустить графитовый и медный электроды. Сначала медный электрод соединить с отрицательным полюсом источника тока. Записать наблюдения и соответствующие уравнения реакций. Затем поменять полярность медного и графитового электрода. Что наблюдается? Объясните происходящие процессы.
Опыт 5. Коррозия гальванопары цинк – железо. Гранулу цинка зажать железной скрепкой. Опустить полученную гальванопару в раствор соляной или серной кислоты. На каком металле выделяются пузырьки водорода? Отлейте немного кислоты в пробирку, добавьте несколько капель раствора K3[Fe(CN)6]. Соединение, какого цвета образуется? Учитывая, что ферроцианид железа синего цвета, а ферроцианид цинка желтого, объясните наблюдаемые процессы. Какой из металлов является анодом, какой катодом? Какой тип деполяризации имеет место? Напишите уравнения катодного и анодного процессов.
Опыт 6.Пассивация железа. В раствор азотной кислоты добавить раствор K3[Fe(CN)6] (индикатор на ионы железа), опустить зачищенный железный гвоздь. Что наблюдаете? Напишите соответствующие уравнения реакции.
Тот же гвоздь зачистить и опустить в концентрированную азотную кислоту. Наблюдается бурное выделение бурого газа, которое через некоторое время прекращается вследствие образования пассивной пленки FeO3 на металле. Проверьте, будет ли запассивированный металл взаимодействовать с раствором азотной кислоты. Объясните наблюдения.
Опыт 7. Ингибиторы коррозии. В раствор серной кислоты опустить кусочек железа. Наблюдать выделение водорода, затем добавить несколько крупинок уротропина. Что наблюдается? Какую роль играет уротропин?
Контрольные вопросы
1.Дайте определение электрохимическим процессам и системам, в которых они происходят.
2.Опишите механизм возникновения электродного потенциала. Дайте определение равновесного электродного потенциала.
3.Опишите работу гальванического элемента Даниэля-Якоби. Что такое токообразующая реакция и электродвижущая сила гальванического элемента? Охарактеризуйте ЭДС, как меру химического сродства, определяющую возможность самопроизвольного протекания электрохимического процесса.
4.Как рассчитать потенциал металла в растворе его соли (электродный потенциал)? Напишите соответствующее уравнение.
5.Какие электроды относятся к электродам первого рода? Напишите уравнения Нернста для расчета их потенциалов.
6.Охарактеризуйте электроды второго рода, ионнообменные и окислительно-восстановительные электроды. Приведите уравнения Нернста для расчета их потенциалов.
77
7.Электрохимические цепи и их классификация. Приведите примеры химических цепей. Опишите работу свинцового аккумулятора.
8.Охарактеризуйте движущую силу процессов в концентрационных гальванических цепях. Как рассчитать ЭДС таких цепей? В чем отличие концентрационных цепей с переносом и без переноса ионов?
9.Опишите стадии электродного процесса под током. Что такое электрохимическая поляризация и перенапряжение электродов?
10.Сформулируйте законы электролиза М.Фарадея. Приведите пример электролиза расплава соли на инертных электродах.
11.Опишите особенности электролиза растворов солей. Приведите примеры электролиза растворов солей на инертных электродах.
12.Дайте определение химической коррозии. Каков ее механизм? Где встречается этот вид коррозии? Какими свойствами должна обладать защитная пленка на металле?
13.Дайте определение электрохимической коррозии. В чем причина коррозии технических металлов? Опишите механизм электрохимической коррозии с водородной и кислородной деполяризацией.
14.Что такое пассивность и пассивация металла? Опишите методы защиты металлов от коррозии.
Примеры решения задач
Пример 1. В соединении, с каким из полуэлементов: Mn/Mn2+, Pb/Pb2+, электрод Zn/Zn2+ будет анодом? Напишите уравнения соответствующих полуреакций.
Решение: Анодом в электрохимии принято называть электрод, на котором идет процесс окисления. Анодом будет электрод, у которого более отрицательный электродный потенциал, а катодом – электрод с более положительным потенциалом. Таковым в данном случае является свинец (см.
ряд напряжений металлов). |
|
|
|
|
|
Zn0-2e-→Zn2+ − анод; |
Pb2++2e-→Pb0 – катод. |
||||
Пример 2. Вычислите электродный потенциал алюминия в 0,01М |
|||||
растворе AlCl3. |
|
|
|
|
|
Дано: |
Решение: воспользуемся уравнением Нернста |
||||
Е0=- 1,662 В (см. таблицу) |
E=E0+ |
0,059 |
lg[Men+ ] , |
||
|
|
||||
[Al3+]=10-2 моль/л |
|
n |
|||
|
E=-1,662+ |
0,059 |
lg10−2 =-1,702(B) |
||
|
|
||||
|
3 |
|
|||
Найти: Е(Al/Al3+) |
Ответ: Е(Al/Al3+)=-1,702 В. |
||||
Пример 3. Вычислите |
электродный потенциал свинцового электрода в |
||||
насыщенном растворе PbSO4 (ПР=2 10-8), содержащего 0,001 моль/л ионов SO42- |
|||||||
Дано: |
Решение: ПР=[Pb2+][SO42-]; |
||||||
Е0=-0,126 В |
[Pb2+]= |
2 10−8 |
=2 10-5(моль/л) |
||||
|
|
||||||
[SO42-]=10-3 моль/л |
|
10−3 |
|
|
|
||
Е=-0,126+ |
0,059 |
lg2 10 |
-5 |
=-0,126+0,03 (-4,7)=-0,266(B) |
|||
ПР=2 10-8 |
2 |
|
|||||
78

|
Ответ: Е(Pb/Pb2+)=-0,266 B. |
Найти: Е(Pb/Pb2+) |
Пример 4. Допишите предложенную схему реакции. Оцените вероятность протекания процесса в заданном направлении при стандартных условиях. Ответ
подтвердите расчетом: |
|
|
||
|
KMnO4 + H2S + H2SO4 → MnSO4 + S + …. |
|
||
О-ль |
|
MnO4- + 8H+ + 5e- → Mn+2 + 4H2O |
2 |
восстановление |
В-ль |
|
H2S – 2e- → S + 2H+ |
5 |
окисление |
|
2MnO4- + 16H+ + 5H2S = 2Mn2+ + 8H2O + 5S + 10H+ |
|||
|
2MnO4- + 6H+ + 5H2S = 2Mn2+ +5S + 8H2O |
|
||
|
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O |
|||
|
ЭДСор = Еоо-ля- Еов-ля |
|
|
|
|
Ео(MnO4-/Mn2+) = +1,52 B |
|
|
|
|
Eо(S/Н2S) =+0,14 B |
|
|
|
ЭДСpо = 1,52 – 0,14 = 1,38 В |
|
|
||
ЭДСpо > 0, следовательно, при стандартных условиях процесс возможен.
Пример 5. Рассчитайте ЭДС элемента, составленного из медного и кадмиевого электродов в 0,01 М растворах их солей.
Дано: |
Решение: |
|
|
|
|
|
||
Е0(Cd/Cd2+)=-0,40 B |
Е(Cd/Cd |
2+ |
)=-0,40+ |
|
0,059 |
lg 0,01 =-0,46 (B) |
||
E0(Cu/Cu2+)=0,34 B |
|
|
|
2 |
||||
[Cd2+]=0,01 моль/л |
0 |
|
2+ |
|
|
0,059 |
|
|
[Cu2+]=0,01 моль/л |
E (Cu/Cu |
|
|
)=0,34+ |
|
|
lg 0,01 =0,28 (B) |
|
|
|
|
2 |
|||||
Найти: ЭДС |
ЭДС=ЕК - ЕА ; |
ЭДС=0,28+0,46=0,74 (В) |
||||||
|
Ответ: ЭДС=0,74 В. |
|
||||||
Пример 6. Какие |
реакции протекают на графитовых электродах при |
|||||||
электролизе расплава бромида калия? |
|
|
||||||
Решение. В расплаве соль диссоциирует на ионы: KВr→K++Br- Электроды из графита являются инертными, поэтому при электролизе не
изменяются. |
K++e-=K |
|
Катод |
2 |
|
Анод |
2Br- - 2e-=Br2 |
1 |
Реакция электролиза |
2KBr=2K+Br2 |
|
Ответ: в результате реакции образуется металлический калий и пары брома.
Пример 7. Написать уравнения реакций электролиза растворов солей NiCl2, Ba(NO3)2 на инертных электродах.
Решение.
а) Соль NiCl2 растворима, в воде диссоциирует на ионы: NiCl2→Ni2++2Cl-
. Т.к. никель имеет значение стандартного электродного потенциала меньше, чем у водорода, но больше, чем у марганца, то на катоде будут восстанавливаться ионы никеля одновременно с водой. А на аноде будут
разрежаться простые анионы хлора. |
|
|
Катод |
Ni2++2e- =Ni |
1 |
79

Анод |
|
2Cl- - 2e- =Cl2 |
|
1 |
|
|
|
||||
Реакция электролиза |
|
NiCl2=Ni+Cl2 |
|
|
|
б) Ba(NO3)2→Ba2++2NO3- . Катионы бария не будут восстанавливаться на |
|||||
катоде, т.к. стандартный электродный потенциал бария меньше потенциала марганца, поэтому на катоде будут восстанавливаться молекулы воды. На аноде
будет происходить окисление |
молекул воды, т.к. кислородсодержащие анионы |
|||||
азотной кислоты в водных растворах не окисляются. |
||||||
Катод |
|
2Н2О+2е- =Н2+2ОН- |
|
2 |
|
|
Анод |
|
2Н2О-4е- =О2+4Н+ |
|
1 |
|
|
Реакция электролиза |
|
2Н2О=2Н2+О2 |
|
|
|
|
Пример 8. Какие |
|
из |
имеющихся в |
растворе ионов, и в какой |
||
последовательности, будут разряжаться на инертных электродах: Ag+, Cl-, Br-,
Co2+, NO3-, K+?
Решение. На катоде: 1) Ag+,( как металл с наиболее положительным потенциалом); 2) Со2+(будет восстанавливаться одновременно с молекулами воды). Катион К+ из раствора не восстанавливается, т.к. имеет большое отрицательное значение потенциала (левее Mn).
На аноде: 1) Br- (неметалл с наиболее отрицательным равновесным
потенциалом), 2) Cl-. |
3)Кислородсодержащий |
|
анион NO3- |
из растворов не |
||||
восстанавливается. |
|
|
|
|
|
|
|
|
Пример 9. Какова масса металлической меди, выделившейся при |
||||||||
электролизе раствора CuSO4 током 2 А в течении получаса? |
|
|||||||
Дано: |
|
Решение: m= |
A I τ |
|
64 |
2 1800 |
|
|
I=2A |
|
|
; |
m= |
|
|
=1,19 (г), |
|
n F |
2 |
96500 |
||||||
τ |
|
где A(Cu)=64 г/моль, n=2 (ион Cu2+ присоединяет 2 е-) |
||||||
=30 мин=1800 с |
|
Ответ: m(Cu)=1,19 г. |
|
|
|
|
|
|
Найти: m(Cu). |
|
|
|
|
|
|
||
Пример 10. Определите выход потоку, если при электролизе раствора сульфата никеля в течении 1 часа при силе тока 4 А на катоде выделилось 4,2 г
никеля. |
|
|
|
|
|
|
|
|
|
|
Дано: |
Решение: найдем mтеор по формуле m= |
A I τ |
; |
|||||||
I=4A |
n F |
|||||||||
τ=1 ч=3600 с |
mт= |
59 4 3600 |
= 4,4 (г), где А(Ni)=59 г/моль, |
|
||||||
m(Ni)=4,2 г |
2 96500 |
|
|
|||||||
|
n=2 (число принимаемых ионом никеля е-) |
|
||||||||
Найти: η(%) |
η= |
mпркт |
|
4,2 |
|
|
|
|||
|
|
100% |
; η= |
|
100 = 93(%) |
|
|
|||
|
mтеор |
4,4 |
|
|
||||||
Ответ: η=93%
Пример 11. Какой из находящихся в контакте металлов Zn-Co будет подвергаться коррозии в агрессивной среде? Напишите уравнения катодного и анодного процессов в а) кислой, б) нейтральной средах.
Решение. При наличии контакта между металлами коррозии подвергается более активный из них, т.е. имеющий более низкое значение электродного потенциала. Этот металл будет анодом. В данном случае анодом является Zn, а
80
