
75 группа 2 вариант / Химия / fischem
.pdfДля однокомпонентной системы (К=1): 1)при Ф=1 С=2 (С=1-1+2=2) – дивариантная система; 2) при Ф=2 (С=1+2-2=1) –одновариантная; 3) при Ф=3 – инвариантная система. Более 3-х фаз в системе существовать не может.
Зависимость температуры фазового перехода от давления в однокомпонентной системе характеризуется уравнением Клайперона –
Клаузиуса:
|
dT |
= |
T V |
. |
|
(2.23) |
|
dp |
|
||||
|
|
H |
|
|||
Для равновесия фазового перехода кристалл жидкость |
|
|||||
|
dT |
= |
Tпл (Vж −Vк ) |
, |
(2.24) |
|
|
dp |
|
||||
|
|
|
H пл |
|
||
где Тпл, Нпл – температура и молярная теплота плавления. Т.к. для плавления Нпл>0, то dT/dp >0 , если Vж-Vк>0. Т.е. если плавление сопровождается увеличением объема жидкости, то температура плавления увеличивается с повышением внешнего давления (для большинства веществ). Если как у воды объем кристаллической фазы больше объема жидкой, то температура плавления с увеличением давления понижается (см. диаграмму состояния воды).
Для равновесия жидкость пар Нисп>0, Vп>Vж, тогда dT/dp >0 (см. диаграмму).
Термический анализ
Для определения равновесия между кристаллическим веществом и жидкой фазой используют метод термического анализа. В основе этого метода лежит исследование скорости изменения температуры системы по мере ее охлаждения или нагревания. Пока вещество охлаждается, находясь в жидком состоянии, температура понижается равномерно. Когда начинается кристаллизация вещества, протекающая с выделением тепла, падение температуры прекращается, на кривой появляется излом – горизонтальный участок. После окончания кристаллизации, температура вещества плавно понижается. Кривые зависимости температуры от времени – кривые охлаждения. На основании кривых охлаждения чистых веществ и их смесей строят диаграмму плавкости системы, что особенно важно для сплавов металлов (диаграмма состояния сплава).
Сплавы металлов – основной конструкционный материал в современной технике. Они обладают более высокой прочностью и твердостью, более низкими температурами плавления, чем чистые металлы.
31
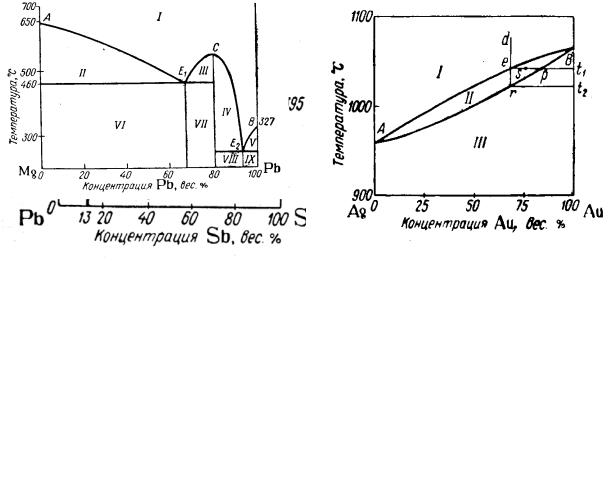
Диаграмма состояния системы Pb-Sb |
Диаграмма состояния системы Ag-Au |
Диаграмма состояния системы Pb-Sn Диаграмма состояния системы Mg-Pb Рис.6. Диаграммы состояния металлических систем
В жидком состоянии металлы могут растворяться друг в друге, образуя жидкий раствор. При кристаллизации могут образовываться: 1)механическая смесь кристаллов металлов, входящих в состав сплава, когда металлы не растворяются и не взаимодействуют друг с другом; 2)химическое соединение металлов; 3)твердый раствор (однородные кристаллы), когда взаимная растворимость металлов сохраняется в твердом состоянии, она может быть ограниченной и неограниченной.
Диаграмма состояния сплава, состоящего из смеси индивидуальных компонентов на примере сплава Pb-Sb. Из расплава сначала кристаллизуется более тугоплавкий металл (Sb), но при этом температура кристаллизации его тем ниже, чем больше добавка другого металла. А так как при кристаллизации сурьмы концентрация олова все время возрастает, то температура кристаллизации первого металла (Sb) понижается. Концентрация Pb повышается вплоть до образования эвтектической смеси. В точке эвтектики кристаллизуются одновременно оба металла в соотношении 13% Sb и 87% Sn (эвтектическая смесь). Область I- расплав сплава, II и III – расплав с кристаллами избыточного по сравнению с эвтектикой компонента, IV и V – эвтектика с кристаллами избыточного компонента. Горизонталь ч/з Е – температура окончания кристаллизации сплава.
32

Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии. При охлаждении жидкого сплава Ag-Au из точки в до температуры t1 начинают выпадать кристаллы сплава, обогащенные тугоплавким золотом (точка p). Жидкая фаза при этом обедняется более тугоплавким компонентом, температура кристаллизации сплава с увеличением содержания серебра понижается. Состав жидкой фазы меняется по верхней кривой, состав твердой – по нижней. При медленном проведении процесса кристаллизация заканчивается по достижении температуры (t2), при которой образующиеся кристаллы имеют состав исходного сплава (точка r).
Диаграмма состояния для сплавов с ограниченной взаимной растворимостью в твердом состоянии. На диаграмме состояния Pb-Sn
имеются следующие области: I - жидкий расплав, II - твердый раствор олова в свинце, III – твердый раствор свинца в олове, IV – жидкий расплав и кристаллы твердого раствора на основе свинца, V – жидкий расплав и кристаллы твердого раствора на основе олова, VI и VII – смеси кристаллов эвтектики с кристаллами твердого раствора на основе свинца и на основе олова соответственно. При температуре 183,3оС наблюдается максимальная растворимость олова в твердом свинце, и свинца в твердом олове. При охлаждении ниже этой температуры кристаллы твердых растворов обогащаются металлом, составляющим основу раствора за счет выделения кристаллов растворенного металла.
Диаграмма состояния для сплавов, образующих химические соединения. Диаграмма характеризуется наличием максимума на кривой начала кристаллизации (С), отвечающего температуре кристаллизации интерметаллического соединения Mg2Pb. На диаграмме имеются эвтектики Е1 – смесь кристаллов Mg и Mg2Pb и Е2 – кристаллов Pb и Mg2Pb. Диаграмма как бы состоит из двух диаграмм первого типа.
Экспериментальная часть
Термический анализ системы нафталин – фенол
Данная работа позволяет познакомиться с методом термического анализа на примере смеси нафталин – фенол.
Таблица 2.1
Изменение температуры смесей со временем
Масса веществ (г) в пробирках
|
1 |
2 |
3 |
4 |
5 |
|
6 |
7 |
Нафталин |
8 |
6 |
5 |
4 |
3 |
|
2 |
0 |
Фенол |
0 |
2 |
3 |
4 |
5 |
|
6 |
8 |
Измерения |
|
|
Температура смеси в пробирке |
|
|
|||
(интервал 30 сек) |
|
|
|
|
|
|
|
|
1-е |
|
|
|
|
|
|
|
|
2-е |
|
|
|
|
|
|
|
|
3-е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оборудование: семь пробирок со смесями фенола и нафталина, закрытые пробками, в которые вставлены термометры со шкалой на 100оС и проволочные
33

мешалки; штатив для пробирок, большая пробирка для использования в качестве воздушного холодильника; стакан емкостью 500 мл, кипятильник.
Ход работы: приготовить семь маркированных пробирок, содержащих по 8 г смеси следующего состава:
Пробирку, закрытую пробкой через которую проходит мешалка и термометр, поместить в стакан с водой, нагретой до кипения. После расплавления вещества пробирку вытереть насухо и поместить в воздушную рубашку. Фиксировать температуру вещества в пробирке каждые 30 секунд, перемешивая содержимое пробирки. То же самое проделать с остальными пробирками. Полученные результаты записывают в таблицу 1.
На основании полученных результатов строят кривые охлаждения, откладывая на оси абсцисс время, а по оси ординат – температуру смеси. По изломам кривых охлаждения определяют температуру начала кристаллизации смесей и температуру отвердевания эвтектики, а также длительность отвердевания эвтектики смесей разного состава. Заполняют таблицу 2.2.
|
|
|
|
Таблица 2.2 |
|
|
Температуры начала кристаллизации смесей и отвердевания эвтектики |
|
|||||
№ смеси |
Состав смеси (%) |
Температура (оС) |
Отвердевание эвтектики |
|||
|
нафталин |
фенол |
начала |
Температура |
|
Время |
|
|
|
кристаллизации |
(оС) |
|
остановки |
|
|
|
|
|
|
(мин) |
1 |
100,0 |
0 |
|
|
|
|
2 |
75,0 |
25,0 |
|
|
|
|
3 |
62,5 |
37,5 |
|
|
|
|
4 |
50,0 |
50,0 |
|
|
|
|
5 |
37,5 |
62,5 |
|
|
|
|
6 |
25,0 |
75,0 |
|
|
|
|
7 |
0 |
100,0 |
|
|
|
|
На основании данных таблицы 2 построить диаграмму плавкости системы нафталин – фенол, откладывая на оси ординат температуру начала кристаллизации, а на оси абсцисс – состав смеси.
Контрольные вопросы
1.Перечислите газовые законы, напишите их математические выражения. Напишите уравнение Клапейрона-Менделеева, укажите физический смысл универсальной газовой постоянной
2.Перечислите особенности состояния идеального газа предполагаемые кинетической теорией газов. Дайте определение и математическое выражение средней квадратичной скорости молекул газа.
3.Приведите основное уравнение кинетической теории газов и уравнение средней кинетической энергии молекул газа.
4.Опишите зависимость скорости движения молекул от их массы и температуры. Охарактеризуйте температуру как статистическую величину.
34
5.Охарактеризуйте особенности жидкого состояния. Дайте определения понятиям: поверхностное натяжение, испарение, конденсация, насыщенный пар, температура кипения.
6.Охарактеризуйте свойства веществ в твердом состоянии, исходя из строения их кристаллических решеток.
7.Дайте определение теплоемкости веществ. Чем отличаются удельная, молярная, изохорная, изобарная, средняя и истинная теплоемкости?
8.Сформулируйте правило Дюлонга и Пти, и закон Кноппа-Неймана.
9.Что такое фазовые равновесия? Дайте определения понятиям: фаза, компонент, независимый компонент, степень свободы.
10.Сформулируйте правило фаз. Рассмотрите моно-, ди-, и инвариантные системы на примере диаграммы состояния воды. Пользуясь уравнением Клапейрона-Клаузиуса, на примере этой диаграммы рассмотрите зависимость температуры фазового перехода от давления.
11.Что такое термический анализ, для чего он применяется? Что такое кривые охлаждения, и как, исходя из них, строятся диаграммы состояния сплава?
12.Рассмотрите диаграмму состояния системы Pb-Sb. Что представляет собой такой спав в твердом состоянии?
13.Рассмотрите диаграмму состояния сплава с неограниченной растворимостью компонентов в твердом состоянии.
14.Какие области имеются на диаграмме сплавов с ограниченной взаимной растворимостью в твердом состоянии? Каков состав металла в этих областях?
15.Охарактеризуйте состав металла в областях I-IX на диаграмме состояния сплава металлов, образующих химические соединения.
|
|
|
Примеры решения задач |
|
|
||
Пример 1. Определите массу углекислого газа, который при 17оС и |
|||||||
давлении 95 кПа занимает объем равный 2 л. |
|
|
|
||||
Дано: |
3 |
|
Решение: воспользуемся уравнением Клапейрона – |
||||
|
Па |
Менделеева: pV=m/MRT , откуда m=pVM/RT |
|||||
p=95 кПа=95 10 |
|
|
|
|
|
||
t=17oС |
|
|
p=95 103 |
Па, |
V=2 10-3 |
м3, |
T=17+273=290K, |
V1=2 л=2 10-3 м3 |
|
R=8,314Дж/моль К, M(CO2)=44 10-3кг/моль |
|||||
Найти: m(СО2) |
|
|
m=95 103 2 10-3 44 10-3/8,314 290=346,75 10-3(кг) |
||||
|
|
|
Ответ : m(CO2)=346,75 г. |
|
|
||
Пример 2. Массовая доля металла в двух его оксидах составляет 77,4% и 63,1%. Удельная теплоемкость металла равна 0,48 Дж/г град. Определите молярную массу металла и его валентность в оксидах.
Дано: |
Решение: определим примерное значение молярной |
W1(Me)=77,4% |
массы металла: Смолярн=Суд М≈26 Дж/град моль. |
W2(Me)=63,1% |
М≈26/0,48≈54,16 (г/моль) |
Cуд(Ме)=0,48 Дж/г град |
|
35

Найти: М(Me). |
Найдем молярные массы эквивалентов металла в его |
||||
|
оксидах. По закону эквивалентов |
m1 |
= |
m2 |
|
|
M Э1 |
M Э2 |
|||
|
|
|
|||
В 100г первого оксида содержится 77,4 г металла и 23,6 г кислорода, МЭ(О)=8
г/моль, отсюда : |
77,4 |
= |
23,6 |
; МЭ(Ме)= 27,4 г/моль-экв |
|
M Э1 (Ме) |
8 |
||||
|
|
|
Для второго оксида МЭ2(Ме)= 83663,9,1 =13,7 (г/моль-экв)
Найдем валентность металла в каждом оксиде: Мэ=М f, f=1/B; B=M/MЭ.
Так как валентность выражается целым числом, вычисления производим с точностью до целого числа: В1=54,16/27,4 ≈ 2; В2=54,16/13,7≈4.
Вычислим уточненное значение молярной массы металла по молярным массам его эквивалентов: М=27,4 2=54,8 (г/моль); М=13,7 4=54,8 (г/моль).
Ответ: М(Ме)=54,8 г/моль, В1=2, В2=4.
Задачи для самостоятельного решения
Вариант 1 1.Вычислите объем 200 г метана СН4 при температуре 50оС и давлении
253,25 кПа.
2.На восстановление 12,8 г металла из его оксида потребовалось 4,48 л водорода при нормальных условиях. Определите молярную массу металла и молярную массу его эквивалента, если удельная теплоемкость металла равна 0,39 Дж/г град.
Вариант 2
1.Вычислите массу 400 м3 оксида углерода (II) при температуре 27оС и давлении 107 кПа.
2.В оксиде металла содержится 7,39% кислорода. Удельная теплоемкость металла 0,13 Дж/г град. Определите молярную массу эквивалента металла и его относительную атомную массу.
Вариант 3 1.Вычислите, какой объем займут 40 м3 газа, взятого при нормальных
условиях, если температура газа станет равной 36оС, а давление 1013 кПа. 2.При взаимодействии 0,224 кг металла с кислотой выделилось 0,448 м3
водорода при нормальных условиях. Вычислите молярную массу эквивалента металла и его относительную молекулярную массу, если удельная теплоемкость металла равна 0,447 Дж/г град.
Вариант 4
1.Какова масса 100 м3 оксида углерода (IV) при температуре 20оС и давлении 100 кПа?
2.Молярная масса эквивалента металла равна 56,2 г/моль, а удельная теплоемкость его 0,23 Дж/г град. Определите относительную атомную массу этого элемента.
36
Вариант 5 1.Вычислите объем 400 г кислорода при температуре 17оС и давлении 300
кПа.
2.Определите относительную атомную массу и валентность металла, если 20,06 г его замещает 0,1936 г водорода, а удельная теплоемкость металла равна 0,13 Дж/г град.
Вариант 6 1.Стальной баллон емкостью 20 л наполнен кислородом при температуре
17оС и давлении 108 Па. Вычислите массу кислорода.
2.При взаимодействии 13 г металла с кислотой выделилось 4,48 л водорода при нормальных условиях. Удельная теплоемкость металла равна 0,38 Дж/г град. Определите его молярную массу и молярную массу эквивалента.
Вариант 7
1.В резервуаре емкостью 15 л находится 5 кг оксида углерода(II) при температуре 20оС. Вычислите давление газа.
2.На восстановление 9,2 г металла из его оксида израсходовалось 3,36 л водорода, взятого при нормальных условиях. Определите молярную массу металла и молярную массу его эквивалента, если удельная теплоемкость металла 0,136 Дж/г град.
Вариант 8 1.Какова масса 1 м3 воздуха при температуре 25оС и давлении 105 Па, если
при нормальных условиях масса 1 л воздуха равна 1,293 г?
2.Оксид металла содержит 15,44% кислорода. Удельная теплоемкость металла равна 0,31 Дж/г град. Определите относительную атомную массу металла.
Вариант 9 1.Какова масса 1 м3 воздуха при температуре 27оС и давлении 105 Па, если
средняя молекулярная масса воздуха равна 29?
2.Удельная теплоемкость металла равна 0,485 Дж/г град, его массовая доля в оксиде 56%. Определите молярную массу металла и его валентность в оксиде.
Вариант 10
1.Вычислите массу 1 л ацетилена С2Н2 при температуре 60о и давлении
106Па.
2.При разложении 80,85 г оксида металла выделилось 11,2 л кислорода при нормальных условиях. Вычислите молярную массу эквивалента металла и его относительную молекулярную массу, если удельная теплоемкость металла равна 0,128 Дж/г град.
Вариант 11 1.Чему равна масса 1 л водорода при температуре равной -123оС и
давлении 80 кПа?
2.Массовые доли металла в двух его оксидах составляют 88,1% и 78,8%. Определите молярную массу металла, если его удельная теплоемкость равна
0,222 Дж/г град.
37
Вариант 12 1.Масса 1 л некоторого газа при температуре 27оС и давлении 121,56 кПа
составляет 0,96 г. Вычислите молекулярную массу газа.
2.Оксид металла содержит 31,58% кислорода. Удельная теплоемкость металла – 0,51 Дж/г град. Определите его относительную атомную массу.
Вариант 13 1.10 г некоторого вещества при температуре 227оС и давлении 86,1 кПа в
парообразном состоянии занимают объем 12 л. Вычислите молярную массу вещества.
2.Удельная теплоемкость меди 0,39 Дж/г град. Определите молярную и относительную атомную массу меди, если известны две молярные массы эквивалентов меди 31,77 г/моль и 63,54 г/моль.
Вариант 14 1.36,95 г некоторого вещества в парообразном состоянии при
температуре 127оС и давлении 95,97 кПа занимают объем 16,4 л. Вычислите молярную массу вещества.
2.Оксид содержит 83,6 металла, вычислите его молярную массу и валентность, если удельная теплоемкость металла равна 0,207 Дж/г град.
Вариант15 1.Масса 380 мл газа при температуре 27оС и давлении 106,3 кПа
составляет 0,455 г. Определите молярную массу газа.
2.При восстановлении оксида водородом образовалось 27 г воды и 48 г металла. Определите молярную массу металла и его валентность в оксиде. Удельная теплоемкость металла равна 0,25 Дж/г град
Тестовые задания для самоконтроля
1.Кинетическая теория газов предполагает следующие допущения:
1 молекулы газов рассматриваются как материальные точки;
2 при столкновении молекул общее количество их кинетической энергии не изменяется;
3.все выше сказанное.
2. Уравнение КлапейронаМенделеева:
1.pV=const;
2.pV=νRT;
3.Vt=kT.
3. Укажите уравнение расчета кинетической энергии 1 моль газа:
1.pV=nRT;
2.ε =3/2 kT;
3.E=3/2 RT.
4.Гомогенная часть системы, имеющая одинаковый состав и свойства, отграниченная от других гомогенных частей системы поверхностью раздела –
1.фаза;
2.компонент;
3.степень свободы;
38

5. Составная часть системы, химически однородное вещество, которое будучи выделенным из системы, может существовать в изолированном виде в течение длительного времени –
1.фаза;
2.компонент;
3.исходное вещество.
6. В равновесной системе число фаз (Ф), число степеней свободы (С) и число независимых компонентов (К) связаны соотношением С+Ф=К+2 –
1.закон Кноппа-Неймана;
2.правило Делонга и Пти;
3.правило фаз.
7. Для однокомпонентной, двухфазной системы число степеней свободы равно:
1.0;
2.1;
3.2.
8. Число условий, которые можно менять произвольно в некоторых пределах без изменения числа фаз –
1.число компонентов;
2число степеней свободы;
3число исходных веществ.
9. dTdp = T HV -
1.уравнение Клапейрона-Клаузиуса;
2.уравнение Менделеева-Клапейрона;
3.- основное уравнение кинетической теории газов.
10. pV = 13 Nmu 2 -
1.уравнение Клапейрона-Клаузиуса;
2.уравнение Менделеева-Клапейрона;
3.- основное уравнение кинетической теории газов.
Ключи к тестовым заданиям
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
№ ответа |
3 |
2 |
3 |
1 |
2 |
3 |
2 |
2 |
1 |
3 |
39
3. РАСТВОРЫ Молекулярные растворы
Растворами называются твердые, жидкие или газообразные гомогенные системы, состоящие из двух или более компонентов.
Жидкие растворы – физико-химические системы. Они занимают промежуточное положение между смесями и химическими веществами. В отличие от смесей в растворах молекулы распределены равномерно по всему объему раствора, в отличие от химических соединений имеют переменный состав. Но растворение сопровождается тепловыми эффектами, продукты взаимодействия растворителя и растворенного вещества – сольваты (гидраты) обладают индивидуальными свойствами, что свидетельствует о химическом характере взаимодействия растворенного вещества и растворителя. Все это нашло свое отражение в гидратной теории Д.И. Менделеева, согласно которой при образовании растворов происходят не только физические, но и химические процессы. При растворении веществ протекают следующие процессы: связь между частицами (молекулами, атомами, ионами) в растворенном веществе и растворителе разрушается, что связано с поглощением теплоты; одновременно происходит образование сольватов (гидратов), сопровождающееся выделением теплоты, а затем идет распределение сольватированых частиц растворенного вещества в растворителе, что связано с поглощением теплоты. Общий тепловой эффект растворения зависит от того какой из тепловых эффектов указанных стадий преобладает.
Данная теория вызвала критику Аррениуса и других представителей «физической теории растворов», которые считали движущей силой процесса растворения возрастание энтропии.
Н.К. Курнаков доказал существование соединений переменного состава в растворах, что явилось развитием идей Менделеева.
Состав раствора выражают массовой долей или концентрацией: молярной, нормальной, моляльной. Последняя используется чаще при рассмотрении закономерностей в физической химии.
Моляльная концентрация– число молей растворенного вещества, содержащихся в 1000 г растворителя:
Сm=nр.в /1000 г р-ля. [моль/1000 г р-ля] (3.1)
Еще одним способом выражения состава раствора является мольная доля. Молярная (мольная) доля растворенного вещества – отношение числа молей растворенного вещества (n1) к общему числу молей растворителя (n2) и
растворенного вещества:
N1= n1/(n1+n2). |
(3.2) |
Свойства разбавленных молекулярных растворов зависят от природы растворителя, растворенного органического вещества и концентрации. Жидкие разбавленные растворы обладают следующими характерными свойствами: 1)давления пара растворителя над раствором ниже, чем над чистым растворителем; 2) растворы замерзают при более низкой температуре, чем растворитель; 3)растворы кипят при более высокой температуре, чем растворитель.
40
