
75 группа 2 вариант / Химия / fischem
.pdfКлючи к тестовым заданиям
|
№ вопроса |
1 |
|
|
2 |
|
3 |
4 |
5 |
|
6 |
|
7 |
|
8 |
|
|
9 |
|
10 |
|
|
|
|
№ ответа |
2 |
|
|
1 |
|
3 |
3 |
2 |
|
2 |
|
1 |
|
2 |
|
|
3 |
|
3 |
|
|
|
|
|
|
Термодинамические константы некоторых веществ. |
Таблица 1.3 |
|||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
Вещество |
|
|
|
o |
f,298, кДж/моль |
|
o |
f,298, кДж/моль |
|
o |
|
|
|
|
|
|||||||
|
|
|
|
|
H |
|
G |
|
S |
298, Дж/моль К |
|
||||||||||||
|
Ag (к) |
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
42,55 |
|
|
|||
|
Ag+(р) |
|
|
|
|
105,58 |
|
|
|
77,12 |
|
|
|
|
|
|
72,80 |
|
|
||||
|
AgCl (к) |
|
|
|
|
-127,1 |
|
|
|
-109,8 |
|
|
|
|
|
|
96,11 |
|
|
||||
|
AgNO3 (к) |
|
|
|
|
-124,5 |
|
|
|
-33,6 |
|
|
|
|
|
|
|
140,9 |
|
|
|||
|
Al (к) |
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
28,35 |
|
|
|||
|
Al3+(р) |
|
|
|
|
-530,0 |
|
|
|
-490,5 |
|
|
|
|
|
|
-301 |
|
|
||||
|
Al(OH)3 (к) |
|
|
|
|
-1315 |
|
|
|
-1157 |
|
|
|
|
|
|
70,1 |
|
|
||||
|
Al2O3 (к) |
|
|
|
|
-1670 |
|
|
|
-1582 |
|
|
|
|
|
|
50,92 |
|
|
||||
|
Ba (к) |
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
67 |
|
|
|
||
|
Ba2+(р) |
|
|
|
|
-538,0 |
|
|
|
-561,0 |
|
|
|
|
|
|
9,6 |
|
|
|
|||
|
BaCO3 (к) |
|
|
|
|
-1219 |
|
|
|
-1139 |
|
|
|
|
|
|
112 |
|
|
|
|||
|
BaO (к) |
|
|
|
|
-558,1 |
|
|
|
-528,4 |
|
|
|
|
|
|
70,3 |
|
|
||||
|
Ba(OH)2 (к) |
|
|
|
|
-950 |
|
|
|
-886 |
|
|
|
|
|
|
|
124,0 |
|
|
|||
|
BaSO4 (к) |
|
|
|
|
-1465,0 |
|
|
|
-1353,0 |
|
|
|
|
|
132,0 |
|
|
|||||
|
C(к) |
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
5,74 |
|
|
|||
|
CH4 (г) |
|
|
|
|
-74,86 |
|
|
|
-50,79 |
|
|
|
|
|
|
186,19 |
|
|
||||
|
C2H2 (г) |
|
|
|
|
226,8 |
|
|
|
200,8 |
|
|
|
|
|
|
209,2 |
|
|
||||
|
C2H4 (г) |
|
|
|
|
52,3 |
|
|
|
219,4 |
|
|
|
|
|
|
68,1 |
|
|
||||
|
C6H6 (ж) |
|
|
|
|
82,9 |
|
|
|
269,2 |
|
|
|
|
|
|
129,7 |
|
|
||||
|
C2H5OH (ж) |
|
|
|
|
-277,6 |
|
|
|
160,7 |
|
|
|
|
|
|
-174,8 |
|
|
||||
|
C6H12O6(глюкоза) |
|
|
|
-1273,0 |
|
|
|
- |
|
|
|
|
|
|
|
-919,5 |
|
|
||||
|
CO (г) |
|
|
|
|
-110,5 |
|
|
|
-137,14 |
|
|
|
|
|
197,54 |
|
|
|||||
|
CO2 (г) |
|
|
|
|
-393,5 |
|
|
|
-394,38 |
|
|
|
|
|
213,68 |
|
|
|||||
|
CO32-(р) |
|
|
|
|
-676,3 |
|
|
|
-528,1 |
|
|
|
|
|
|
-54,9 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Продолжение таблицы 1.3 |
|
||||||||
|
Ca (к) |
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
41,63 |
|
|
|||
|
Ca2+(р) |
|
|
|
|
-542,96 |
|
|
|
-553,0 |
|
|
|
|
|
|
-55,2 |
|
|
||||
|
CaC2(к) |
|
|
|
|
-62,8 |
|
|
|
-67,8 |
|
|
|
|
|
|
|
70,5 |
|
|
|||
|
CaCO3 (к) |
|
|
|
|
-1206,9 |
|
|
|
-1128,8 |
|
|
|
|
|
92,9 |
|
|
|||||
|
CaO (к) |
|
|
|
|
-635,5 |
|
|
|
-604,3 |
|
|
|
|
|
|
39,7 |
|
|
||||
|
Ca(OH)2 (к) |
|
|
|
|
-986,6 |
|
|
|
-896,8 |
|
|
|
|
|
|
76,1 |
|
|
||||
|
Ca3(PO4)2 |
|
|
|
|
-4123,6 |
|
|
|
-3887,6 |
|
|
|
|
|
236 |
|
|
|
||||
|
Cl-(р) |
|
|
|
|
-167,2 |
|
|
|
131,4 |
|
|
|
|
|
|
56,54 |
|
|
||||
21
Cl2 (г) |
0 |
0 |
|
222,9 |
HCl (г) |
-91,8 |
-94,79 |
|
186,8 |
HCl (р) |
-166,9 |
-131,2 |
|
56,5 |
Cr(к) |
0 |
0 |
|
23,6 |
Cr2+(р) |
-139,0 |
-183,4 |
|
41,9 |
Cr3+(р) |
-236,1 |
-223,2 |
|
-215,6 |
Cr2O3 (к) |
-999,98 |
-1059 |
|
81,2 |
Cu(к) |
0 |
0 |
|
33,15 |
Cu+(р) |
71,55 |
50,21 |
|
39,33 |
Cu2+(р) |
66,99 |
65,61 |
|
-92,8 |
CuO (к) |
-162 |
-129,4 |
|
42,63 |
F-(р) |
-331,7 |
-277,9 |
|
-13,8 |
F2 (г) |
0 |
0 |
|
202,9 |
HF (г) |
-270,9 |
-272,8 |
|
173,7 |
HF(р) |
-320,08 |
-296,86 |
|
- |
Fe (к) |
0 |
0 |
|
27,15 |
Fe2+(р) |
-87,17 |
-78,96 |
|
-130,96 |
Fe3+(р) |
-46,39 |
-4,52 |
|
-309,1 |
FeO (к) |
-264,8 |
-244,3 |
|
60,75 |
Fe2O3 (к) |
-822,2 |
-740,3 |
|
87,4 |
Fe3O4 (к) |
-1117,1 |
-1014,2 |
|
146,2 |
H+(р) |
0 |
0 |
|
0 |
H2 (г) |
0 |
0 |
|
130,52 |
KCl (к) |
-435,9 |
-408,0 |
|
82,56 |
KClO3 (к) |
-391,2 |
-289,9 |
|
142,97 |
Mg(к) |
0 |
0 |
|
32,7 |
|
|
|
|
|
Mg2+(р) |
-467 |
-455,1 |
|
138 |
MgO(к) |
-601,8 |
-569,6 |
|
26,0 |
MgCO3 |
-1113 |
-1029,3 |
|
199,9 |
N2 (г) |
0 |
0 |
|
65,7 |
NH3 (г) |
-46,19 |
16,71 |
|
192,6 |
|
|
|
Продолжение таблицы 1.3 |
|
|
|
|
|
|
NH4+(р) |
-132,4 |
-79,5 |
|
114,4 |
NH4Cl (к) |
-134,2 |
-203,2 |
|
95,8 |
NO(г) |
90,25 |
86,58 |
|
210,6 |
NO2 (г) |
33 |
51,5 |
|
240,2 |
NO3-(р) |
-207,5 |
-111,7 |
|
147,3 |
Ni (к) |
0 |
0 |
|
29,9 |
Ni2+(р) |
-53,2 |
-45,59 |
|
-126,13 |
NiO(к) |
-239,7 |
-211,6 |
|
37,99 |
O2 (г) |
0 |
0 |
|
205,04 |
22
|
|
|
|
OH-(р) |
-230,19 |
-157,42 |
-10,86 |
H2O (г) |
-241,82 |
-228,61 |
188,72 |
H2O (ж) |
-285,83 |
-237,24 |
70,08 |
|
|
|
|
P(г) |
314,64 |
-278,28 |
163,1 |
P (белый) |
0 |
0 |
41,1 |
P(к, черный) |
-38,9 |
33,47 |
22,7 |
|
|
|
|
P(к, красный) |
-17,6 |
-11,9 |
22,8 |
P4 (г) |
58,9 |
24,5 |
279,9 |
PH3 (г) |
5,44 |
13,39 |
210,1 |
P4O10 (к) |
-2984,0 |
-2697,8 |
228,8 |
Pb (к) |
0 |
0 |
64,8 |
PbO (к) |
-219,3 |
-189,1 |
66,2 |
PbS (к) |
-100,4 |
-98,8 |
91,2 |
S (г) |
273,0 |
232,4 |
167,7 |
S(к, ромбическая) |
0 |
0 |
31,9 |
SO2 (г) |
-296,9 |
-300,2 |
248,1 |
SO3 (г) |
-396,1 |
-370 |
256,4 |
H2S(г) |
-20,17 |
-33,01 |
205,6 |
Zn (к) |
0 |
0 |
41,63 |
Zn2+(р) |
-153,74 |
-147,26 |
-110,67 |
ZnO(к) |
-350,6 |
-320,7 |
43,64 |
ZnS (к) |
-205,4 |
-200,7 |
57,74 |
23
2. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВ Газы. Газовые законы Уравнение состояния идеального газа
Газообразное состояние характеризуется малыми силами межмолекулярного взаимодействия, вследствие чего газ занимает весь предоставленный объем. Объем молекул составляет ничтожную часть занимаемого объема. Такое разреженное состояние газа - идеальный газ. Идеальные газы описываются газовыми законами. Отклонения от газовых законов наблюдаются при высоких давлениях и низких температурах.
Физическое состояние газа определяется тремя параметрами: температурой (Т), давлением (р), и объемом (V). Зависимость между этими параметрами описаны законами: Бойля-Мариота, Гей-Люссака, Шарля,
Авогадро. |
|
|
1) |
pV=const |
(2.1) |
2) |
Vt=kT |
(2.2) |
3) |
р=kT |
(2.3) |
4) |
ν=N/NА |
(2.4) |
где ν - количество молей газа |
|
|
Объединение указанных законов, сделанное Б.Э.Клапейроном (1834), |
||
позволило получить уравнение состояния идеального газа: |
|
|
p0V0/T0=ptVt/T, |
(2.5) |
|
или |
|
|
pV/T=const. |
(2.6) |
|
Д.И.Менделеев ввел в уравнение универсальную газовую постоянную и |
||
количество молей: |
|
|
PV=νRT, |
(2.7) |
|
где ν=m/M, m – масса газа, М – молярная масса газа. |
|
|
Уравнение (2.7) - уравнение Клапейрона-Менделеева. |
|
|
Универсальная газовая постоянная при нормальных |
условиях равна |
|
R=8,314 Дж/моль К. Физический смысл ее – работа расширения газа против сил внешнего давления при повышении температуры на 1К.
Кинетическая теория газов
Рассмотрим кинетическую теорию газов, которая предполагает следующие допущения:
1). Молекулы газов рассматриваются как материальные точки.
2).Силы взаимного притяжения молекул пренебрежительно малы.
3).Молекулы находятся в непрестанном хаотическом движении.
4).При столкновении молекул общее количество их кинетической энергии не изменяется.
При столкновении молекул изменяется скорость и направление их движения. Для расчетов воспользуемся средней квадратичной скоростью молекул (u) (независимой от направления движения), которая для данной температуры есть величина постоянная:
24

|
U12 |
+U 22 +...Ui2 |
|
u = |
|
|
(2.8) |
|
|
||
|
|
Ni |
|
Давление р газа в кубе с ребром l есть сила F действия всех молекул на единицу поверхности стенки S:
p = |
F |
= |
F |
(2.9) |
|
S |
l 2 |
||||
|
|
|
Как известно, сила равна произведению массы молекулы на ускорение, которое представляет собой изменение скорости в единицу времени:
F = m u |
(2.10) |
||||
|
t |
|
|||
Подставляем (2.10) в (2.9), получаем: |
|
||||
p = |
m u |
. |
(2.11) |
||
|
|
||||
|
l 2 t |
|
|||
Изменение скорости молекулы при ударе о стенку составляет: |
|
||||
u = u – ( - u)=2u. |
(2.12) |
||||
p = |
2um |
|
(2.13) |
||
l 2 t |
|||||
|
|
||||
Для каждой молекулы время между столкновениями с одной и той же стенкой равно расстоянию, проходимому молекулой от одной стенки к другой и
обратно, деленному на скорость молекулы: t = 2ul .
Подставив это выражение в (2.13), и заменяя l3 на объем V получаем:
p = |
2umu |
= |
mu2 |
. |
(2.14) |
2l 3 |
|
||||
|
|
V |
|
||
Если взять 1 моль газа, то в объеме содержится NA молекул. Предположим, что молекулы движутся по трем направлениям, перпендикулярно граням куба. Можно считать, что в среднем только одна треть молекул движется по одному направлению, т.е. перемещается туда и обратно между противоположными гранями куба. В таком случае давление составит:
p = |
1 |
N |
mu2 |
или |
|||
3 |
V |
||||||
|
|
|
- основное уравнение кинетической теории (2.15) |
||||
pV = |
1 |
Nmu 2 |
|||||
|
3 |
|
|
газов |
|||
Рассчитаем кинетическую энергию молекул газа. Для этого умножим и разделим левую и правую часть уравнения на 2. Поскольку для одного моля газа pV=RT, заменим: pV на RT:
2 NA |
|
mu2 |
|
= RT |
(2.16) |
|
|
|
|||||
3 |
2 |
|
|
|
||
Обозначим mu2/2 – среднюю кинетическую энергию молекулы газа ε, |
||||||
тогда для одной молекулы: |
|
|||||
ε = |
3 |
kT , |
|
(2.17) |
||
2 |
|
|||||
|
|
|
|
|
||
где k – постоянная Больцмана (R/NA). Для 1 моль:
25

E = |
3 |
RT |
(2.18) |
|
2 |
||||
|
|
|
Кинетическая энергия молекулы прямо пропорциональна абсолютной температуре и не зависит от природы газа и массы молекулы.
Скорость движения молекул газа зависит от массы молекул и температуры., произведение Nm=M, тогда из уравнения (2.16) следует:
RT = |
|
1 |
Mu2 |
, |
(2.19) |
||
3 |
|||||||
|
|
|
|
|
|||
откуда |
|
|
|||||
u = |
3RT |
. |
|
(2.20) |
|||
|
|
||||||
|
|
M |
|
|
|||
Исходя из уравнения (2.20), можно показать, что отношение скоростей молекул газа при разных температурах равно:
u1 |
= |
T1 |
. |
(2.21) |
|
u |
|
|
|||
2 |
|
T |
|
||
|
|
2 |
|
|
|
А при одной и той же температуре отношение скоростей молекул различных газов зависит от их масс:
|
u1 |
= |
|
M 2 |
. |
(2.22) |
|
||
|
|
|
|
|
|||||
|
u2 |
M1 |
|
|
|||||
Из уравнения (2.18) следует: |
|
|
|||||||
T = |
2 |
E , |
(2.23) |
это |
|||||
3R |
|||||||||
|
|
|
|
|
|
|
|||
означает, что абсолютная температура идеального газа пропорциональна средней кинетической энергии его молекул, т.е. является величиной статистической.
Общая характеристика жидкого состояния.
Жидкости в отличие от газов обладают значительно большей плотностью, силами притяжения между частицами, почти постоянным объемом. Сжимаемость жидкостей очень мала. Коэффициенты объемного расширения жидкостей гораздо меньше, чем у газов. Объем 1 моль жидкостей (V=M/ρ) приблизительно равен сумме объемов атомов элементов, входящих в состав молекулы. При малых расстояниях между молекулами большую роль играет не только их объем, но и их строение. Если молекулы жидкости полярны, то они могут притягиваться противоположными полюсами и образовывать ассоциаты из двух или более молекул. К ассоциированным жидкостям относятся вода, ацетон, сжиженный аммиак. Они отличаются большей теплотой испарения, меньшей летучестью. Ассоциация может быть вызвана также образованием водородных связей между атомами водорода, имеющими частично положительный заряд вследствие поляризации связи, и атомами наиболее электроотрицательных элементов (кислорода, фтора, хлора, азота) в составе соседних молекул. Водородная связь значительно слабее ковалентной.
Жидкости обладают поверхностью раздела. Поверхностный слой молекул обладает особенными свойствами, т.к. на эти молекулы действуют силы притяжения преимущественно со стороны жидкости, вследствие чего они как
26
бы втягиваются внутрь жидкости, возникает поверхностное натяжение, под действием которого поверхностный слой стремится сократиться. Эта особенность поверхностных молекул связана с внутренним давлением жидкостей.
Молекулы жидкости, скорость и кинетическая энергия которых больше средней, могут, достигая поверхностного слоя, переходить в парообразную фазу, преодолев притяжение остальных молекул (испарение). Молекулы из парообразной фаза, сталкиваясь с поверхностью жидкости, могут переходить в жидкость (конденсация). Когда оба процесса протекают с одинаковой скоростью, устанавливается равновесие. Над жидкостью устанавливается постоянная концентрация пара – насыщенный пар. Давление пара, находящегося в равновесии с жидкостью, называется давлением насыщенного пара. Если давление насыщенного пара равно внешнему давлению, то испарение протекает не только с поверхности, но и внутри жидкости, путем образования пузырьков пара во всем объеме жидкости и их выделением. Температура, при которой это происходит – температура кипения.
Характеристика свойств веществ в твердом состоянии
Вещество, имеющее форму и оказывающее сопротивление всякому действию, направленному на изменение формы, называется твердым. Твердые вещества, имеющие постоянную температуру плавления – кристаллические, не имеющие постоянной температуры плавления, а размягчающиеся постепенно при нагревании в некотором интервале температур с переходом в жидкость –
аморфные.
Кристаллы состоят из закономерно расположенных в пространстве молекул, атомов или ионов, которые образуют пространственную кристаллическую решетку.
Ионные решетки построены из ионов, между которыми действуют электростатические силы. Каждый ион окружен атмосферой противоионов, что обеспечивает устойчивость кристаллов, уменьшая силы отталкивания одноименных ионов. При обычных условиях ионные кристаллы – твердые вещества, они имеют высокие температуры плавления. Плавление сопровождается увеличением объема. В полярных растворителях ионные кристаллы растворяются, ионная решетка при этом сравнительно легко разрушается.
Атомные решетки состоят из атомов. Между атомами возникают ковалентные связи, за счет неспаренных электронов. Атомные решетки очень прочны, плавятся при очень высоких температурах (у алмаза tпл=3500оС, у карбида кремния – 3000оС). Эти вещества практически не растворимы. Кристаллы таких веществ обладают большой твердостью. Такие кристаллические решетки характерны для неметаллов – углерода, бора, кремния, их соединений – карбидов, нитридов, фосфидов и др.
Молекулярные решетки образованы молекулами, связанными между собой ван-дер-ваальсовыми силами, которые значительно слабее ковалентных. Это сравнительно легкоплавкие вещества.
27
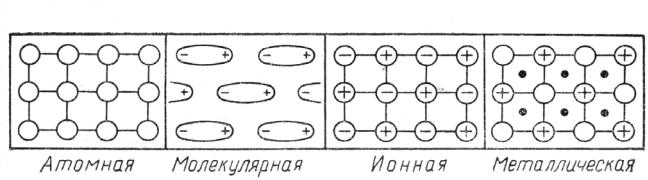
Молекул, имеющие полярные группы, связаны несколько большими межмолекулярными силами. Температуры плавления, кипения, растворимость в полярных растворителях у таких веществ выше, кристаллические решетки прочнее.
Рис.2.1. Типы кристаллических решеток.
Металлические решетки характерны для металлов (см. курс «общей химии»).
Теплоемкость газов, жидкостей и твердых веществ.
Теплоемкостью вещества называют отношение количества теплоты полученного или отданного системой к соответствующему изменению температуры. Различают удельную (с) (на 1 г в-ва) и молярную (С) теплоемкость.
В зависимости от условий проведения опыта различают изохорную (CV) и
изобарную (Cp) теплоемкости. Истинная теплоемкость: |
|
CV=dU/dT, Cp=dH/dT. |
(2.16) |
Средняя теплоемкость:
C=q/T2-T1. (2.17)
Т.к. кинетическая энергия 1 моль газа равна E=3/2RT, следовательно, при нагревании 1 моль газа на 1 градус приращение кинетической энергии составит 3/2R или 12,47 Дж при постоянном объеме. Таким образом молярная теплоемкость идеального газа должна быть равна этой величине, что совпадает с величиной теплоемкости для одноатомных инертных газов.
Поступательное движение одноатомной молекулы может быть разложено на три независимые составляющие по трем взаимно перпендикулярным направлениям, т.е. одноатомная молекула обладает 3 степенями свободы. На одну степень свободы приходится 4,2 Дж/моль К. У двухатомной молекулы добавляется еще 2 степени свободы вращательного движения, CV=21 Дж/мольК. Помимо этого добавляются еще колебательные движения вдоль линии соединяющей атомы (еще 2 степени свободы). С повышением температуры число молекул с колебательными степенями свободы увеличивается, а следовательно теплоемкость изменяется с температурой у дух- и многоатомных газов.
При постоянном давлении часть теплоты превращается в работу: Cp=CV+A (2.18)
Но работа 1 моля газа при нагревании на 1 оС равна R. Следовательно:
28
Cp – CV=R. |
(2.19) |
Сделанные выводы о теплоемкости газов применимы к теплоемкости |
|
жидкостей. Но для жидкостей |
|
Cp – CV<R. |
(2.20) |
Теплоемкость жидкостей |
зависит от температуры. Высокое значение |
теплоемкости имеет вода. Что имеет большое биологическое и планетарное значение.
Теплоемкость твердых веществ. Частицы в кристаллической решетке твердого вещества колеблются относительно определенных точек. Если допустить, что средняя кинетическая энергия атомов в твердом одноатомном веществе равна таковой для идеального одноатомного газа 3/2RT, и учесть потенциальную энергию притяжения соседних атомов, равную по законам механики средней кинетической энергии, то суммарная энергия 1 моль твердого вещества должна быть 3RT. При повышении температуры 1 моль твердого элементарного вещества на 1оС поглощается 25 Дж тепла. Экспериментальным путем П. Дюлонг и А. Пти нашли, что молярная теплоемкость для различных простых веществ в кристаллическом состоянии одинакова и равна приблизительно 26,4 Дж. Она равна произведению удельной теплоемкости на
молярную массу элемента: |
|
Смолярная=Суд М =26,4 Дж. |
(2.21) |
Исключения – легкие элементы, особенно неметаллы имеют теплоемкость значительно меньше (бор, берилий, кремний, алмаз).
Согласно закону Кноппа – Неймана (1831г.) мольная теплоемкость веществ в кристаллическом состоянии равна сумме молярных теплоемкостей входящих в нее элементов.
Для твердых веществ установлено, что:
1)различие между CV и Cp тем меньше, чем ниже температура, и при очень низких уменьшается почти до 0;
2)при нагревании Ср неограниченно растет, а СV стремится к пределу 3R или 3Rn для молекул из n атомов.
Фазовые равновесия
Фаза – гомогенная часть системы, имеющая одинаковый состав и свойства, отграниченная от других гомогенных частей системы поверхностью раздела.
Равновесие процесса перехода вещества из одной фазы в другую без изменения химического состава называется фазовым равновесием. Примеры фазового равновесия: плавление и кристаллизация металла (равновесие твердое в-во/жидкость), испарение и конденсация жидкости (равновесие жидкость/пар). Фазовое равновесие – динамическое равновесие, т.е. скорость прямого и обратного процессов равны. Условием равновесия является G=0. Для фазового равновесия соблюдается принцип Ле-Шателье. Т.е. при повышении температуры равновесие сдвигается в сторону эндотермического процесса (плавление, испарение), при повышении давления – в сторону уменьшения объема системы (конденсация, сублимация).
29
Компонент – составная часть системы, однородное вещество, может быть выделено из системы, и существовать в изолированном виде в течение длительного времени. Если система содержит взаимодействующие вещества, то среди них есть независимые компоненты, число которых достаточно для образования всех фаз системы. Их число меньше общего числа компонентов на число протекающих между ними реакций. Для реакции
HCl+NH3=NH4Cl
два независимых компонента (HCl и NH3), т.к. количество третьего определяется равновесием при известных количествах двух других. По числу компонентов различают одно-, двух-, трехкомпонентные системы.
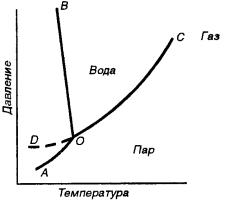
Рассмотрим однокомпонентную систему на примере воды (диаграмма состояния воды).
Рис.2.2. Диаграмма состояния воды.
На диаграмме области, находящиеся между кривыми, являются однофазными. Кривые соответствуют условиям равновесия между фазами: ОС – кипение, ОВ – плавления, ОА – сублимации (переход из твердого состояния в газ, минуя жидкое), ОD – метастабильное состояние переохлаждения.
В точке О все три фазы находятся в равновесии – тройная точка (273,16 К, 6,11 кПа). При изменении значений давления или температуры в системе остается только 2 фазы. Т.е. нельзя изменить ни одно из условий, не изменив числа фаз (система в точке О - инвариантная система).
Равновесие между жидкой водой и паром возможно при различных давлениях и температурах, но при этом каждому значению р соответствует определенное Т. Если изменять один фактор не меняя второго, остается одна фаза. (Повышение Т при р=const ведет к испарению.)
Число условий (Т,р,с), которые можно менять произвольно в некоторых пределах без изменения числа фаз – число степеней свободы. Число степеней свободы (С) характеризует вариантность системы. Так в точке О С=0 –
инвариантная система. С=1 – моновариантная система, С=2 – дивариантная система.
Правило фаз: в равновесной системе число фаз (Ф), число степеней свободы (С) и число независимых компонентов (К) связаны соотношением :
С+Ф=К+2, или С=К-Ф+2 |
(2.22) |
Правило сформулировано американским физиком |
Дж.У.Гиббсом в |
1873/1876 гг. |
|
30
