
- •Вопросы к экзамену по аналитической химии
- •I. Химия и медицина
- •1. Предмет, цели и задачи аналитической химии. Краткий исторический очерк развития аналитической химии. Место аналитической химии среди естественных наук и в системе медицинского образования.
- •II. Качественный анализ
- •2. Основные понятия аналитической химии. Типы аналитических реакций и реагентов. Требования, предъявляемые к анализу, чувствительности, селективности определения состава веществ.
- •3. Физико-химические и физические методы анализа. Макро-, полумикро-, микро- и ультрамикроанализ. Характеристика чувствительности аналитических реакций.
- •4. Аналитическая классификация катионов. Систематический и дробный анализ.
- •Общая характеристика группы
- •6. Систематический анализ смеси катионов I аналитической группы.
- •7. Применение закона действующих масс в аналитической химии. Основные положения теории слабых электролитов Аррениуса. Константа диссоциации, степень диссоциации. Закон разведения Оствальда.
- •Основные положения электролитической теории с. Аррениуса
- •Теория слабых электролитов
- •8. Основные положения теории сильных электролитов Дебая-Гюккеля. Ионная сила раствора. Активность и коэффициент активности.
- •9. Уравнения, применяемые к неидеальным (реальным) растворам. Термодинамическая константа ионизации.
- •Общая характеристика группы
- •12. Систематический анализ смеси катионов II аналитической группы.5
- •13. Протолитическая теория кислот и оснований. Понятие кислоты и основания. Амфолиты.
- •14. Кислотно-основное равновесие. Типы протолитических реакций.
- •15. Кислотные и основные свойства растворителей. Влияние природы растворителя на силу кислот и оснований. Константа кислотности и основности. Нивелирующее и дифференцирующее действие растворителей.
- •16. Диссоциация воды. Ионное произведение воды. Водородный показатель рН как количественная мера активной кислотности и щёлочности. Кислотно-основные индикаторы. Измерения рН растворов (см. 17).
- •19. Теория кислот и оснований Льюиса. Мягкие и жёсткие кислоты и основания.
- •Общая характеристика группы
- •21. Систематический анализ смеси катионов III аналитической группы.
- •22. Систематический анализ смеси катионов I-III аналитических групп.
- •25. Систематический анализ смеси катионов IV аналитической группы.
- •26. Гетерогенные процессы. Равновесие между жидкой и твердой фазами. Константа гетерогенных равновесий – константа растворимости (термодинамическая, реальная, условная).
- •28. Схема образования осадка. Свойства кристаллических и аморфных осадков. Влияние различных факторов на структуру и дисперсность осадков. Способы получения чистых осадков.
- •Реакции катионов железа (III)
- •Реакции катионов железа (II)
- •30. Систематический анализ смеси катионов V аналитической группы
- •31. Комплексные соединения, их строение и классификация. Хелатные и внутрикомплексные соединения.
- •Номенклатура комплексных соединений
- •Название некоторых комплексообразователей
- •32. Металлолигандное равновесие в водном растворе. Константа нестойкости и устойчивости комплексных соединений (полные, ступенчатые, координационные и истинные термодинамические).
- •33. Металлолигандный гомеостаз и способы его коррекции. Лигандообменные процессы в организме в норме и при патологии. Применение комплексных соединений в медицине.
- •34. VI аналитическая группа катионов. Общая характеристика катионов этой группы. Характерные и специфические реакции катионов.
- •Все осадки растворимы в минеральных кислотах, аммиаке и солях аммония
- •35. Систематический анализ смеси катионов VI аналитической группы.
- •36. Систематический анализ смеси катионов IV-VI аналитической группы.
- •Систематический ход анализа смеси катионов
- •Систематический ход анализа смеси катионов
- •IV аналитической группы
- •Систематический анализ смеси катионов VI аналитической группы
- •37. Аналитическая классификация анионов. Первая аналитическая группа анионов. Характерные и специфические реакции анионов so42ˉ, so32ˉ, co32ˉ, SiO32ˉ, s2o32ˉ, b4o72ˉ, po43ˉ.
- •Специфические реакции анионов I аналитической группы
- •Реакции тиосульфат-иона (s2o32‾)
- •38. Вторая аналитическая группа анионов. Характерные и специфические реакции анионов Clˉ, Brˉ, iˉ, scn ˉ, s2ˉ.
- •Реакции хлорид-иона (Cl‾)
- •Реакции иодид-иона (I‾)
- •Реакции роданид-иона (cns‾)
- •39. Третья аналитическая группа анионов. Характерные и специфические реакции анионов no3ˉ, no2ˉ, ch3cooˉ.
- •Реакция нитрат-иона (no3‾)
- •Реакции нитрит-иона (no2‾)
- •Реакции ацетат-иона (ch3coo‾)
- •III. Количественный анализ
- •40. Задачи и методы количественного анализа. Классификация методов количественного анализа. Сущность титриметрических методов анализа.
- •41. Способы выражения состава растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, молярная доля, объёмная доля, титр.
- •42. Закон эквивалентов и его применение в количественном анализе. Способы определения точки эквивалентности. Способы приготовления рабочих растворов. Способы титрования: прямое, обратное, косвенное.
- •Классификация методов анализа по типу реакции
- •Классификация методов анализа по способу титрования
- •43. Сущность метода кислотно-основного титрования. Основные реакции и титранты метода. Ацидиметрия, алкалиметрия. Кислотно-основные индикаторы.
- •Титрование сильной кислоты сильной щелочью:
- •Титрование слабого основания сильной кислотой:
- •Титрование слабой кислоты сильной щелочью:
- •Кислотно-основные индикаторы
- •Кислотно-основные индикаторы
- •44. Кривые кислотно-основного титрования. Расчет, построение и анализ типичных кривых кислотно-основного титрования.
- •45. Окислительно-восстановительные реакции, применяемые в объёмном анализе. Сущность методов оксидиметрии. Классификация редокс-методов, способы установления точки эквивалентности в оксидиметрии.
- •Общая характеристика и классификации методов оксидиметрии
- •46. Метод перманганатометрии, его сущность.Условия проведения перманганатометрического титрования. Титрант, его приготовление и стандартизация. Определение солей железа (II) в растворах.
- •48. Иодометрическое определение меди в растворах. Применение иодометрии в медицине. Определение солей меди (II) в растворах.
- •49. Теоретические основы комплексонометрического титрования. Условия проведения комплексонометрического определения содержания металлов в растворе. Комплексоны, их особенности.
- •Классификация физико-химических методов
- •52. Спектрофотометрический метод. Его сущность. Основные законы светопоглощения – законы Бугера-Ламберта и Бера.
- •Классификация методов оптического анализа
- •55. Потенциометрический метод. Теоретические основы метода, классификация
- •Типы электродов, применяемых в потенциометрии:
- •Потенциометрическое определение рH растворов
- •57. Полярографический метод. Сущность полярографии. Индикаторные электроды и электроды сравнения. Диффузионный ток. Качественный и количественный полярографический анализ.
- •58. Хроматографические методы анализа. Ионообменная, газовая и жидкостная хроматография.
- •Классификация хроматографических методов
- •59. Экстракция. Сущность метода. Закон распределения. Константа экстракции. Коэффициент распределения.
- •60. Важнейшие растворители и реагенты, используемые в экстракции. Хелатные соединения в экстракции. Скорость экстракции. Примеры разделения биологических объёктов методом экстракции.
9. Уравнения, применяемые к неидеальным (реальным) растворам. Термодинамическая константа ионизации.
Понятие “активность”введено в науку для того, чтобы законы, сформулированные для идеальных систем, были применимы к (неидеальным) реальным системам. Подстановка величин активности вместо молярных концентраций в уравнение закона действия масс делает эти уравнения применимыми к нёидеальным (реальным) системам. Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Например, для обратимой реакции А + В↔С + D после замены молярных концентраций их активностями получим;
![]()
или,
заменив активности их значениями а
= с
f, будем
иметь:
![]()
Точно так же при замене в уравнениях констант ионизации равновесных концентраций активностями ионов получаются уравнения, справедливые в отношении растворов сильных электролитов, концентрированных растворов слабых электролитов и растворов слабых электролитов в присутствии сильных электролитов.
Константы электролитической ионизации, определяемые с помощью активностей, называются истинными или термодинамическими константами электролитической ионизации. Величины термодинамических констант не зависят от концентрации растворов и потому подчиняются закону действия масс.
Пользуясь величинами термодинамических констант, можно находить активности ионов в растворе и решать ряд других задач, например находить рН и рОН растворов и т. д.
10. Основные типы равновесий в растворах. Константы химического равновесия (истинная, термодинамическая, концентрационная). Действие одноименного иона.
Типы химических реакций (равновесий):
с переносом протона – кислотно-основные реакции;
с переносом электрона – окислительно-восстановительные реакции;
с переносом электронных пар с образованием донорно-акцепторных связей – реакции комплексообразования.
Химическое равновесие - это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны между собой.
Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
Кинетические кривые обратимой реакции аА↔bВ
Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна концентрации реагирующих веществ.
Отношение констант скорости является постоянной величиной, обозначаемой Kc:
![]()
где Kс – концентрационная константа равновесия.
Таким образом, закон действующих масс для обратимой реакции записывается так:
![]()
![]()
Величина константы равновесия, выраженная через активности реагирующих веществ, называется термодинамической константой равновесия.

Запишем выражения, используя вместо активностей частиц их равновесные концентрации.

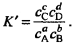
Эти величины называются концентрационными константами равновесия. При этом К – реальная, а К’ – условная константа равновесия.
Действие одноименного иона.
Степень диссоциации слабых электролитов можно искусственно понижать.
СН3СООН
![]() СН3СОО–
+ H+
СН3СОО–
+ H+
Если в раствор добавить CH3COONa, то, являясь сильным электролитом, эта соль дает большое количество ионов CH3COO- => их концентрация увеличивается. Равновесие при этом сместится влево и степень диссоциации кислоты уменьшится, концентрация H+ понизится.
11. II аналитическая группа катионов (Аg+, Pb2+, Hg22+) и их специфические реакции.
