
- •Кафедра «Инженерная химия и естествознание»
- •Методические указания
- •Заполнение электронных состояний в атоме
- •1. Минимум энергии подуровня.
- •2. Принцип запрета Паули.
- •3. Правило Гунда.
- •Сродство к электрону.
- •Электроотрицательность.
- •Энергетика химических реакций. Химическая термодинамика.
- •1 Закон (начало) термодинамики.
- •Термохимические уравнения. Закон Гесса.
- •Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
- •Катодные процессы
- •Анодные процессы При рассмотрении анодных процессов следует различать электролиз с инертным анодом и электролиз с активным анодом, т.Е. Материал которого может окисляться.
- •Законы электролиза
- •Пассивное состояние металлов
- •Некоторые константы и величины
- •Приложение 4 Электродные потенциалы
- •Приложение 5 Произведение растворимости (пр) труднорастворимых
Государственное образовательное учреждение
высшего профессионального образования
«ПЕТЕРБУРГСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ
МИНИСТЕРСТВА ПУТЕЙ СООБЩЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ»
Кафедра «Инженерная химия и естествознание»
Подлежит возврату
Х И М И Я
Методические указания
к выполнению контрольных работ
для студентов заочной формы обучения
специальностей
АТС, ЭТ, ЭС, ЛТ, В
САНКТ-ПЕТЕРБУРГ
2004
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМА.
Современная теория строения электронных оболочек атома базируется на следующих экспериментальных и теоретических данных:
1. Гипотеза Планка о дискретности, квантовании энергии. Энергия излучается и поглощается порциями, которые получили название - кванты. Согласно Планку
∆Е=hν (1) где ∆Е – поглощенная или излученная энергия, h – постоянная Планка, равная 6,63·10-34 Дж·сек, ν – частота излучения.
2. Опыты Резерфорда по облучению тонкой золотой фольги α-частицами. На основании опытных данных, Резерфорд впервые смог оценить размер атома. Эта величина оказалась равной ~10-8см, при этом оказалось, что практически вся масса атома сосредоточена в области ~10-13см. (ядро). Поэтому он назвал атом «видимое ничто».
3. Гипотеза де Бройля о волновых свойствах любой микрочастицы, т.е любой вид движения носит одновременно и волновой и корпускулярный характер. Математическое выражение этой гипотезы имеет вид:
![]() (2)
где λ – длина волны собственных волновых
колебаний частицы, h
–постоянная Планка, v –
скорость и m –масса
частицы.
(2)
где λ – длина волны собственных волновых
колебаний частицы, h
–постоянная Планка, v –
скорость и m –масса
частицы.
Это выражение неоднократно экспериментально подтверждалось и имеет очень большое значение, поскольку оно объединяет волновую и корпускулярную формы движения материи. До этого считалось, что существует волновая форма и корпускулярная, которые никак не связаны друг с другом.
Для электрона со скоростью порядка 106 м/с, длина волны собственных колебаний порядка 10-8 см, т.е. сопоставима с размерами атома. Поэтому, для правильного описания состояния электрона в атоме, необходимо учитывать волновую природу электрона.
В 1926году Эрвин Шредингер предложил уравнение, получившее название волновое уравнение Шредингера. В нем Шредингер исходил из предположения, что устойчивому состоянию электрона в атоме соответствует стоячая волна.
Состояние электрона
в атоме описывает волновая функция
(ψ-функция), являющаяся решением уравнения
Шредингера. Эта функция не имеет ни
какого физического смысла, а дает, точнее
квадрат ее модуля |ψ|2, вероятность
нахождения электрона на данном расстоянии
от центра атома. Поэтому ψ-функция
нормирована на единицу, те.
![]() .
Зная вероятности, можно получить
распределение электронной плотности
от расстояния от ядра. Поскольку ψ-функция
связана с вероятностью, то вводят понятие
орбиталь. Под орбиталью понимают часть
объема атома, в которой сосредоточено
0,9 электрона, т.е.
.
Зная вероятности, можно получить
распределение электронной плотности
от расстояния от ядра. Поскольку ψ-функция
связана с вероятностью, то вводят понятие
орбиталь. Под орбиталью понимают часть
объема атома, в которой сосредоточено
0,9 электрона, т.е.
![]() .
Орбиталь имеет какую-то граничную
поверхность, поэтому говорят о типе
(виде) орбитали, ее форме и т.п.
.
Орбиталь имеет какую-то граничную
поверхность, поэтому говорят о типе
(виде) орбитали, ее форме и т.п.
Непосредственно из уравнения Шредингера вытекают три числа, получившие названия квантовых чисел, описывающих состояние электрона в атоме (n, l, m). Однако скоро выяснилось, что для полного описания состояния электрона в атоме их не хватает. Это связано с тем, что электрон имеет собственный момент количества движения , так называемый спин. Он описывается спиновым квантовым числом (ms), принимающем два условных значения - +1/2 и -1/2. В системе частиц с нецелым значением спина все частицы должны отличаться по энергии. Эта ситуация закреплена принципом запрета Паули, имеющем формулировку: в атоме не может быть двух и более электронов, имеющих одинаковый набор квантовых чисел.
Для учета этого факта в волновую функцию ввели четвертое, спиновое квантовое число, модифицировав волновую функцию, и, в настоящее время, она описывается четырьмя квантовыми числами, т.е. ψ=f(n, l, m, ms).
Значения и смысл квантовых чисел.
Набор квантовых чисел определяет энергетическое состояние электрона в атоме. Когда говорят о смысле квантовых чисел, выделяют физический(энергетический) смысл и геометрический (форма и взаимное расположение орбиталей в пространстве атома).
1. Первое квантовое число называется главное квантовое число и обозначается ‘n’. Принимает целочисленные значения от 1 до ∞, т.е.[1,∞].
Физический смысл. С главным квантовым числом связан основной запас энергии электрона в атоме. С увеличением значения n энергия электрона в атоме увеличивается.
Геометрический смысл. Главное квантовое число определяет энергетический уровень, на котором находится электрон. В этом случае уровни принято обозначать заглавными латинскими буквами, начиная с К, т.е.:
Значения n: 1 2 3 4 5 6 7
Уровень K L M N O P Q.
2. Второе квантовое число называется орбитальное квантовое число и обозначается ‘l’. Оно зависит от главного квантового числа n и при данном значении его принимает целочисленные значения от 0 до (n-1), т.е. [0, n-1].
Физический смысл. Орбитальное квантовое число связано с моментом количества движения электрона в атоме. С ростом l энергия электрона в атоме растет. n и l определяют весь запас энергии электрона в атоме.
Геометрический смысл. Значения орбитального квантового числа определяют подуровень данного уровня и тип и форму орбитали. При этом для орбиталей используются условные обозначения:
Значение l 0 1 2 3 4 5
Тип орбитали s p d f g h
Тип и форма орбиталей приведена на рис.1.
3. Третье квантовое число называется магнитное квантовое число и обозначается ‘m’. Оно зависит от орбитального и при данном значении его принимает целочисленные значения от –l до +l, через единицу, включая 0, всего 2l+1 значений (см. таблицу 1.).
Физический смысл. Магнитное квантовое число связано с энергией магнитного взаимодействия электрона с внешним магнитным полем.
Геометрический смысл. Число значений магнитного квантового числа (2l+1) дает число орбиталей данного типа. Сами значения m определяют пространственное расположение орбиталей данного типа относительно друг друга. Взаимное расположение орбиталей приведено на рис.1.
В отсутствии внешнего магнитного поля все орбитали данного типа имеют одинаковую энергию. В этом случае говорят о вырождении соответствующего подуровня.
4. Четвертое квантовое число называется спиновое квантовое число и обозначается ‘ms’ или ‘s’. Оно определяется внутренними свойствами электрона и может принимать два условных значения +1/2 и -1/2.
Физический смысл. спиновое квантовое число определяет собственный момент количества движения электрона.
Геометрический смысл. считается, что когда ms=+1/2, то электрон вращается относительно оси, совпадающей с направлением движения, по часовой стрелке, когда - -1/2, то – против часовой стрелки.
Количество электронов на данном уровне (емкость уровня) можно определить по формуле N = 2n2, где n – значение главного квантового числа.
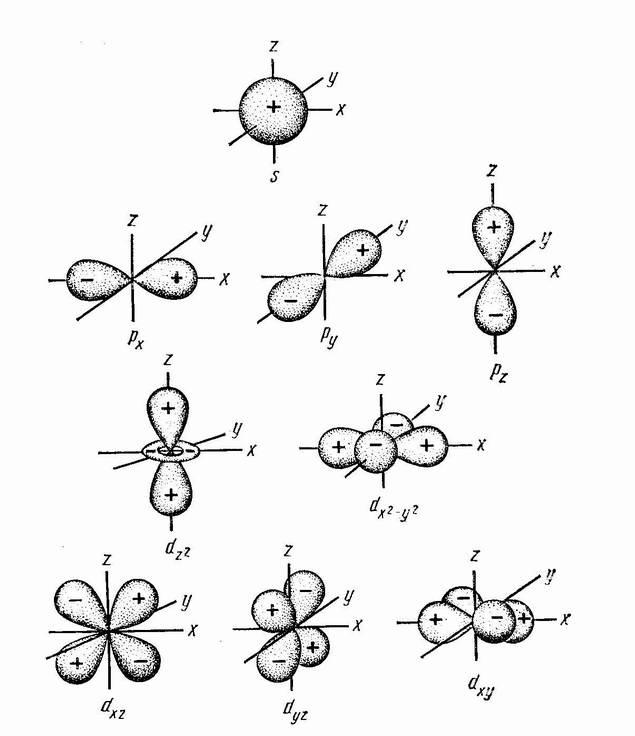
Рис.1. Вид, форма и взаимное расположение орбиталей атома.
Таблица 1. квантовые числа.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
1 |
1 |
K |
2 |
0 |
s |
0 |
1 |
|
2 |
2 |
L |
8 |
0 |
s |
0 |
1 |
|
1 |
p |
-1, 0 +1 |
3 |
||||
|
3
|
3
|
M
|
18
|
0 |
s |
0 |
1 |
|
1 |
p |
-1, 0 +1 |
3 |
||||
|
2 |
d |
-2, -1, 0, +1, +2 |
5 |
||||
|
4
|
4
|
N
|
32
|
0 |
s |
0 |
1 |
|
1 |
p |
-1, 0 +1 |
3 |
||||
|
2 |
d |
-2, -1, 0, +1, +2 |
5 |
||||
|
3 |
f |
-3, -2, -1, 0, +1, +2, +3 |
7 |
||||
|
5
|
5
|
O
|
50
|
0 |
s |
0 |
1 |
|
1 |
p |
-1, 0 +1 |
3 |
||||
|
2 |
d |
-2, -1, 0, +1, +2 |
5 |
||||
|
3 |
f |
-3, -2, -1, 0, +1, +2, +3 |
7 |
||||
|
4 |
g |
-4, -3, -2, -1, 0, +1, +2, +3, +4 |
9 |
||||
|
6
|
6
|
P
|
72
|
0 |
s |
0 |
1 |
|
1 |
p |
-1, 0 +1 |
3 |
||||
|
2 |
d |
-2, -1, 0, +1, +2 |
5 |
||||
|
3 |
f |
-3, -2, -1, 0, +1, +2, +3 |
7 |
||||
|
4 |
g |
-4, -3, -2, -1, 0, +1, +2, +3, +4 |
9 |
||||
|
5 |
h |
-5, -4, -3, -2, -1, 0, +1, +2, +3, +4, +5 |
11 |
В таблице:
1. Номер по порядку.
2. Значение главного квантового числа.
3. Обозначение уровня.
4. Емкость уровня.
5. Значения орбитального квантового числа.
6. Тип орбитали.
7. Значения магнитного квантового числа.
8. Число значений магнитного квантового числа, число орбиталей данного типа, вырождение подуровня.
