
- •Кафедра «Инженерная химия и естествознание»
- •Методические указания
- •Заполнение электронных состояний в атоме
- •1. Минимум энергии подуровня.
- •2. Принцип запрета Паули.
- •3. Правило Гунда.
- •Сродство к электрону.
- •Электроотрицательность.
- •Энергетика химических реакций. Химическая термодинамика.
- •1 Закон (начало) термодинамики.
- •Термохимические уравнения. Закон Гесса.
- •Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
- •Катодные процессы
- •Анодные процессы При рассмотрении анодных процессов следует различать электролиз с инертным анодом и электролиз с активным анодом, т.Е. Материал которого может окисляться.
- •Законы электролиза
- •Пассивное состояние металлов
- •Некоторые константы и величины
- •Приложение 4 Электродные потенциалы
- •Приложение 5 Произведение растворимости (пр) труднорастворимых
Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
![]()
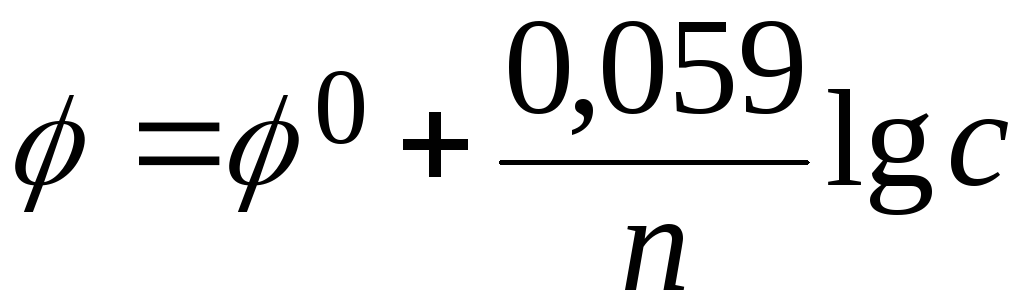
где 0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе каждым атомом или ионом; с – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л.
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (прил. 5). Изменится ли это соотношение, если измерить потенциал никеля в растворе с концентрацией 0,0001 моль/л?
Решение. Стандартные электродные потенциалы металлов для Ni и Co соответственно равны –0,25 и –0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
Ni2+/Ni = 0,25 + 0,059/2lg10-3 = -0339 B
Co2+/Co = -0,277 + 0,059/2lg10-3 = -0,307 В
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Электродные потенциалы и их значение являются характеристиками химических источников постоянного электрического тока (ХИЭТ): гальванических элементов, аккумуляторов и др. ХИЭТ устроены таким образом, что позволяют окислительно-восстановительную реакцию, лежащую в основе работы гальванического элемента, превратить в электрическую энергию.
Для возникновения тока необходимо, чтобы между электродами была разность в значениях потенциалов. Разность потенциалов может быть достигнута использованием либо электродов разной природы, либо электродов одной природы при разных концентрациях растворов солей. В последнем случае элемент называют концентрационным.
Всякий гальванический элемент состоит из двух электродов-металлов, погруженных в растворы электролитов, разделенных пространственной или полупроницаемой перегородкой. Более отрицательный по значению потенциала электрод, на котором в ходе реакции происходит процесс окисления, называют а н о д о м (анод заряжен отрицательно). Электрод с более положительным значением потенциала, на котором осуществляется процесс восстановления, называется к а т о д о м (катод заряжен положительно).Электродвижущая сила (ЭДС) гальванического элемента может быть представлена как разность двух электродных потенциалов – катода (к) и анода –(а): ЭДС = к - а.
Пример 2. В гальваническом элементе электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 0,1 моль/л. Какой металл является анодом, какой – катодом? Написать уравнения окислительно-восстановительной реакции, протекающей в гальваническом элементе, и вычислить его ЭДС.
Решение.
Стандартные электродные потенциалы
(прил. 4) для Mg и Zn равны соответственно
–2,37 и –0,76 В. По уравнению Нернста
определим электродные потенциалы этих
металлов при данных условиях и
концентрациях: Mg2+/Mg![]()
![]()
Zn2+/Zn=![]()
Так как магний имеет меньший потенциал (более отрицательный), то он является анодом, на котором протекает окислительный процесс:
Mgо – 2e = Mg2+
Цинк, имеющий более высокое значение потенциала – катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2e = Znо.
Вычисляем ЭДС гальванического элемента:
ЭДС(Е) = Zn - Mg = -0,79 – (-2,4) = 1,61 В.
Пример 3. Гальванический элемент состоит из стандартного водородного электрода и водородного электрода, погруженного в раствор с pH = 12.На каком электроде водород будет окисляться при работе гальванического элемента, на каком – восстанавливаться? Рассчитать ЭДС элемента.
Решение. Потенциал стандартного водородного электрода на котором осуществляется процесс 2H+ + 2e = H2 при активности (концентрации) ионов водорода, равной 1 (pH = 0), считается равным 0: 1 = 0 (при 25оС). При изменении концентрации (активности) ионов водорода в растворе потенциал водородного электрода определяется выражением, вытекающим из уравнения Нернста:
= -0,059 pH,
т.е. для данного в условии значения pH раствора потенциал водородного электрода
2 = -0,059 * 12 = -0,708 В.
Судя по рассчитанной величине 2, на этом электроде будет идти процесс окисления водорода: H2 – 2e = 2H+, т.е. он будет служить анодом. Находим ЭДС элемента: Е = 1 - 2 = 0,708 В.
Электролиз
Электролизом называется совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Как и в гальваническом элементе, электрод, на котором происходит процесс восстановления, является катодом, а электрод, на котором осуществляется процесс окисления, - анодом. Но в отличие от гальванического элемента катод при электролизе заряжен отрицательно, а анод – положительно, т.к. процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента, и энергия электрическая превращается в энергию химическую.
Химическая реакция при электролизе осуществляется за счет энергии электрического тока, подводимого извне, а при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
При электролизе водных растворов электролитов в отличие то электролиза расплава следует учитывать, что в окислительно-восстановительных процессах может принимать участие вода. На аноде при этом выделяется кислород: 2H2O – 4e = O2 + 4H+, а на катоде выделяется водород: 2H2O + 2e = H2 + 2OH-.Если система, в которой проводят электролиз, содержит окислители, то на катоде будут восстанавливаться ионы или молекулы, имеющие наиболее положительные значения электродного потенциала, а на аноде будут окисляться атомы, ионы или молекулы, характеризующиеся наиболее отрицательными значениями электродного потенциала.
