
- •Кафедра «Инженерная химия и естествознание»
- •Методические указания
- •Заполнение электронных состояний в атоме
- •1. Минимум энергии подуровня.
- •2. Принцип запрета Паули.
- •3. Правило Гунда.
- •Сродство к электрону.
- •Электроотрицательность.
- •Энергетика химических реакций. Химическая термодинамика.
- •1 Закон (начало) термодинамики.
- •Термохимические уравнения. Закон Гесса.
- •Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
- •Катодные процессы
- •Анодные процессы При рассмотрении анодных процессов следует различать электролиз с инертным анодом и электролиз с активным анодом, т.Е. Материал которого может окисляться.
- •Законы электролиза
- •Пассивное состояние металлов
- •Некоторые константы и величины
- •Приложение 4 Электродные потенциалы
- •Приложение 5 Произведение растворимости (пр) труднорастворимых
Термохимические уравнения. Закон Гесса.
Термохимические
уравнения – это уравнения, в которых
указан тепловой эффект (изменение
энтальпии
![]() Н)
реакции и физическое состояние реагентов
и продуктов. Коэффициенты в реакции
могут быть как целыми, так и дробными.
В основе всех термохимических расчетов
лежит закон Гесса (1840г.):
Н)
реакции и физическое состояние реагентов
и продуктов. Коэффициенты в реакции
могут быть как целыми, так и дробными.
В основе всех термохимических расчетов
лежит закон Гесса (1840г.):
Тепловой эффект (изменение энтальпии) реакции определяется только начальным и конечным состоянием системы и не зависит от пути перехода системы из одного состояния системы в другое.
Например, рассмотрим образование СО2
Прямой путь:
С(графит) +О2(г)=СО2(г),
![]() Н1
Н1
Косвенный путь:
С(графит) +1/2 О2(г)=СО(г),
![]() Н2
Н2
СО(г)+1/2
О2(г)=СО2(г),
![]() Н3
Н3
Согласно закону
Гесса:
![]() Н1=
Н1=![]() Н2+
Н2+![]() Н3
Н3
Следствие закона Гесса. Рассчитать в стандартных условиях тепловой эффект (изменение энтальпии) реакции и оценить, сколько энергии потребуется можно по уравнению:
![]() (5)
(5)
где ni,
nj-стехиометрические
коэффициенты, конечных и начальных
реагентов, соответственно.
![]() ,
,
![]() - стандартные энтальпии образования
конечных и начальных реагентов,
соответственно.
- стандартные энтальпии образования
конечных и начальных реагентов,
соответственно.
Для химической реакции в общем виде:
aA+bB => cC+dD
![]() (6)
(6)
В закрытой системе, изменение энтальпии также дает информацию о самопроизвольной направленности процесса, которая осуществляется т.о. чтобы запас внутренней энергии системы «мах» понизился.
Т.е. природе более
«выгодны» «холодные» системы, сбросившие
избыток энергии в окружающую среду.
Такие системы с наинизшей внутренней
энергией являются более устойчивыми.
Действительно, многие химические
реакции, идущие самопроизвольно, являются
экзотермическими (![]() Н<0.)
Н<0.)
В заключение приведем классическую формулировку первого начала термодинамики: вечный двигатель первого рода невозможен. Вечный двигатель первого рода это такое механическое устройство, которое производит работу без изменения внутренней энергии системы, т.е. A>0, ∆U=0. Это, естественно, невозможно по закону сохранения энергии.
Суммируя, можно сказать, что 1-ое начало есть закон сохранения энергии для систем, а в химической термодинамике он наиболее полно проявляется в законе Гесса.
А поскольку закон сохранения энергии выполняется абсолютно, то и 1-ое начало носит абсолютный характер и выполняется всегда, независимо от количества по массе компонентов, т.е. оно одинаково применимо и для отдельных молекул и для молей вещества.
2-й закон (начало) термодинамики.
Здесь вводят три функции составных :
G-энергия Гиббса, F-энергия Гельмгольца, S-энтропия. Размерность энтропии Дж/моль К0, размерность G и F кДж/моль.
Энтропия системы S является мерой неупорядоченности ее состояния, мерой хаоса, а также мерой равновесия системы. В условиях равновесия энтропия системы максимальна.
Энергия Гиббса G (потенциал Гиббса, изобарно-изотермический потенциал, химическое сродство) определяется при P=const и T=const и связана с U следующим выражением:
G=H-TS= U+РV-TS (7)
Энергия Гиббса позволяет судить о возможности или невозможности самопроизвольного протяжения процесса при изобарно-изотермических условиях.
Энергия Гельмгольца F (свободная энергия, изохорно-изотермический потенциал, потенциал Гельмгольца) определяется при T=const и V=const и связям с U следующим выражением:
F=U-TS (8)
Энергия Гельмгольца позволяет судить о возможности или невозможности самопроизвольного протекания процесса при T=const и V=const, т.е. при изохорных процессах. Так как на практике P=const, то энергия Гельмгольца рассматриваться не будет.
Энтропия. Энтропия, как и энтальпия, и внутренняя энергия является функцией состояния системы.
Энтропию системы S можно рассматривать как меру неупорядоченности ее состояния. Энтропия связана с термодинамической вероятностью соотношениям:
S=klgW (9)
где: k – постоянная Больцмана, W – термодинамическая вероятностью, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
Микросостояние определяется параметрами отдельной частицы; макросостояние – усредненными параметрами всей совокупности частиц.
В отличии от H и U для энтропии можно определить абсолютное значение для всех чистых веществ и при любой температуре.
При стандартных
условиях зависит только от природы и
физического состояния вещества и
называется стандартной энтропией . Она
обозначается
![]() и измеряется – Дж/моль·К. Стандартная
энтропия простых веществ не равна
нулю.
и измеряется – Дж/моль·К. Стандартная
энтропия простых веществ не равна
нулю.
Энтропия вещества в аморфном и стеклообразном состоянии больше, чем в кристаллическом. С увеличением степени дисперсности частиц – энтропия возрастает.
Процессы, для
которых
![]() S>0:
S>0:
1. расширение газов
2. растворение кристаллических веществ
3. фазовые превращения, в ходе которых вещество переходит из твердого в жидкое и газообразное состояние.
Процессы, для
которых
![]() S<0:
S<0:
1. сжатие газов
2. конденсация и кристаллизация веществ
В ходе химической
реакции
![]() S>0,
если увеличивается объем системы,
например: C(графит)+СО2(г)
=> 2СО(г).
S>0,
если увеличивается объем системы,
например: C(графит)+СО2(г)
=> 2СО(г).
Если в ходе реакции
![]() V<0,
то и
V<0,
то и
![]() S<0,
например:
S<0,
например:
2C(графит)+3Н2(г) => С2Н6(г).
В ходе реакции
N2(г)+O2(г)=2NO(г)
объем системы не изменяются (2 моля слева
и 2 моля справа), однако
![]() S>0,
т.к. происходит усложнение состава
молекул. В ряду однотипных соединений
абсолютная энтропия растет по мере
усложнения растет по мере усложнения
состава молекул.
S>0,
т.к. происходит усложнение состава
молекул. В ряду однотипных соединений
абсолютная энтропия растет по мере
усложнения растет по мере усложнения
состава молекул.
Вещество S0298 Вещество S0298
CuO 43,5 CO 197,7
Сu2O 100,7 CO2 213,6
Для химической реакции в стандартных условиях изменение энтропии может быть рассчитано так же по уравнению, аналогичном следствию закона Гесса:
![]() (10)
(10)
где ni,
nj-стехиометрические
коэффициенты, конечных и начальных
реагентов, соответственно.
![]() ,
,
![]() - стандартные энтальпии образования
конечных и начальных реагентов,
соответственно.
- стандартные энтальпии образования
конечных и начальных реагентов,
соответственно.
Для химической реакции в общем виде:
aA+bB => cC+dD
![]() (11)
(11)
В изолированных системах изменение энтропии служит критерием, определяющим направление процесса.
Согласно второму
началу термодинамики, в изолированных
системах энтропия самопроизвольно
протекающего процесса возрастает, т.е.
![]() S>0
S>0
При понижении температуры любая система переходит в состояние с большей внутренней упорядоченностью.
Изобарно-изотермический потенциал. Направление химических реакций.
Наблюдения показали, что для процесса, протекающего в любой системе одновременно действуют две тенденции.
С одной стороны система стремиться избавиться от избыточной энергии и перейти в состояние с min энергией. Вторая же тенденция всякого химического процесса стремиться перевести эту систему к максимальному беспорядку, т.е. к max энтропии.
Величиной, отражающей влияние на направление химической реакции этих двух конкурирующих тенденций, является изменение изобарно-изотермического потенциала.
Эта величина была
предложена ученым Гиббсом и , соответственно,
имеет синонимы: энергия Гиббса. Она
является критерием принципиальной
осуществимости процессов, протекающих
в закрытой системе при P
и Т=const и представляет
собой разность между энтальпийным (![]() Н)
и энтропийным (Т
Н)
и энтропийным (Т![]() S)
факторами
S)
факторами
![]() G=
G=![]() H-
Т
H-
Т![]() S
(12)
S
(12)
Условия принципиальной
возможности протекания процесса
![]() G<0,
т.е. реакции могут протекать самопроизвольно
(без затраты работы) в сторону уменьшения
изобарно-изотермического потенциала.
G<0,
т.е. реакции могут протекать самопроизвольно
(без затраты работы) в сторону уменьшения
изобарно-изотермического потенциала.
Процесс принципиально
невозможен при условиях Р и Т=const.,
если
![]() G>0.
G>0.
В системе наступило
химическое равновесие если
![]() G=0
при значении
G=0
при значении
![]() G=0
уравнение превращается в равенство
G=0
уравнение превращается в равенство
![]() H=Т
H=Т![]() S
и T=
S
и T=![]() .
.
Изобарно-изотермический
потенциал, как и энтальпия не имеет
абсолютных значений и при стандартных
условиях зависит только от природы и
физического состояния вещества и
называется стандартным изобарно-изотермическим
потенциалом, обозначается
![]() и измеряется кДж/моль.
и измеряется кДж/моль.
Для простых веществ
в стандартном состоянии
![]() .
Изменение изобарного потенциала в ходе
химической реакции рассчитывается
(аналогично энтальпии и энтропии) по
уравнению:
.
Изменение изобарного потенциала в ходе
химической реакции рассчитывается
(аналогично энтальпии и энтропии) по
уравнению:
![]() (13)
(13)
где ni,
nj-стехиометрические
коэффициенты, конечных и начальных
реагентов, соответственно.
![]() ,
,
![]() - стандартные энтальпии образования
конечных и начальных реагентов,
соответственно.
- стандартные энтальпии образования
конечных и начальных реагентов,
соответственно.
Для химической реакции в общем виде:
aA+bB => cC+dD
![]() (14)
(14)
Из нескольких
возможных реакций, т.е. имеющих
отрицательный знак
![]() реакции, наиболее предпочтительна та,
значение
реакции, наиболее предпочтительна та,
значение
![]() которой наиболее отрицательно, т.к. при
этом достигается минимальное значение
энергии.
которой наиболее отрицательно, т.к. при
этом достигается минимальное значение
энергии.
Чем более отрицательно
значение
![]() G,
тем дальше система от состояния
равновесия, тем более она реакционноспособна.
G,
тем дальше система от состояния
равновесия, тем более она реакционноспособна.
Как следует из
выражения (11), изменение изобарно-изотермического
потенциала отражает влияние на направление
протекания процесса как энтальпийного
(![]() Н),
так и энтропийного (Т
Н),
так и энтропийного (Т![]() S)
факторов.
S)
факторов.
В зависимости от
температуры влияние одного из этих
факторов на значение и знак
![]() G,
и следовательно, на направление процесса
может быть определяющим.
G,
и следовательно, на направление процесса
может быть определяющим.
Tак
при достаточно высоких температурах
│T∆S│ >
│∆H│, следовательно
![]() и
и
![]() G<0,
если ∆S > 0. Таким образом,
критерием принципиальной осуществимости
процесса при достаточно высоких
температурах является изменение
энтропии. При высоких температурах
самопроизвольно могут протекать только
реакции, сопровождающиеся увеличением
энтропией.
G<0,
если ∆S > 0. Таким образом,
критерием принципиальной осуществимости
процесса при достаточно высоких
температурах является изменение
энтропии. При высоких температурах
самопроизвольно могут протекать только
реакции, сопровождающиеся увеличением
энтропией.
При низких
температурах для реакций со значительным
тепловым эффектом │∆H│≥│T∆S│
и
![]() G
G![]() , следовательно,
, следовательно,
![]() G<0
если
G<0
если
![]() Н<0.
Таким образом, возможность самопроизвольного
протекания реакции при низких температурах
определяется изменением энтальпии. При
низких температурах самопроизвольно
могут протекать только экзотермические
реакции.
Н<0.
Таким образом, возможность самопроизвольного
протекания реакции при низких температурах
определяется изменением энтальпии. При
низких температурах самопроизвольно
могут протекать только экзотермические
реакции.
Для большинства
реакций, идущих при обычной температуре
и атмосферном давлении, │∆H│
> │T∆S│,
т.е. в обычных условиях эндотермические
реакции (![]() Н>0.)
редко протекают самопроизвольно, в
отличии от экзотермических (
Н>0.)
редко протекают самопроизвольно, в
отличии от экзотермических (![]() Н<0.).
Н<0.).
Особое значение имеет связь между изменением изобарно-изотермического потенциала и константой равновесия химической реакции:
![]() (15)
(15)
где Kp-константа равновесия.
Обычно определяют изменение стандартного изобарного потенциала реакции при температуре 298 К:
![]() (16)
(16)
Практическая
необратимость реакции определяется
значением
![]() .
Кроме этого ∆Gх.р
является максимальной полезной
работой, которую, в равновесных
условиях, может совершать система т.е.
.
Кроме этого ∆Gх.р
является максимальной полезной
работой, которую, в равновесных
условиях, может совершать система т.е.
∆Gх.р. = -Amax (17)
И в заключении приведем классическую формулировку II начала термодинамики: вечный двигатель II рода невозможен. Вечный двигатель II рода – это механическое устройство, полностью превращающее полученное тепло в полезную работу. Существует и другая формулировка II начала: нельзя всю полученную теплоту обратить в работу.
В отличии от I-го начала, II-ое носит статистический характер, т.е. оно не абсолютно и надежно работает, если система состоит из большого числа частиц. Это связано с энтропией, которая является функцией термодинамической вероятности.
III-е начало термодинамики.
Приведем лишь формулировки III закона.
1-ая. Абсолютный нуль температуры не достижим.
2-ая. Энтропия простого классического вещества при абсолютном нуле равна нулю.
Последняя формулировка и позволяет определять абсолютные значения энтропии любых веществ и при любых температурах.
Список литературы.
-
Суворов А.В. Никольский А.Б, Общая химия, СПб, Химиздат,2000 г.
-
Коровин В.Н. Общей химия, М. Высшая школа, 2000 г.
-
Глинка Н.Л. Общая химия – Л. Химия, 1985 г.
-
Глинка Н.Л. задачи и упражнения по общей химии – Л. Химия, 1985 г
ВАРИАНТЫ КОНТРОЛЬНОГО ЗАДАНИЯ
|
№ вари-анта |
Определите возможность самопроиз-вольного прохождения химической реакции, подсчитайте изменение величин H298 и S298 реакции. Определите, экзо- или эндотермической является реакция (ответ мотивируйте). |
Определите, какая из реакций пройдет предпочтительнее. Условия стандартные (ответ мотивируйте). |
Дайте ответ на теоретический вопрос. |
|
31 |
CaO (к) + CO2 (г) = CaCO3 (к) |
Fe (к) + 0,5О2 (г) = FeO (к) 2Fe (к) + 1,5O2 (г) = Fe2O3 (к) 3Fe (к) + 2O2 (г) = Fe3O4 (к) |
От каких факторов зависит внутренняя энергия вещества? |
|
32 |
2NO (г) + O2 (г) = 2NO2 (г) |
S (к) + O2 (г) = SO2 (г S (к) + 1,5O2 (г) = SO3 (г) |
Сформулируйте законы термоди-намики. Объясните их смысл. |
|
33 |
СaCO3 (к) = CaO (к) + CO2 (г) |
C (графит) + 0,5O2 (г) = CO (г) C (графит) + O2 (г) = CO2 (г) |
Сформулируйте закон Гесса. |
|
34 |
H2 (г) + CO2 (г) = CO (г) + H2O(г) |
FeO (к) + C (графит) = Fe (к) + CO (г) FeO(к)+0,5C(графит)=Fe(к)+0,5CO2(г) FeO (к) + CO (г) = Fe (к) + CO2 (г) |
Объясните физический смысл термодинамических функций. |
|
35 |
SrCO3 (к) = SrO (к) + CO2 (г) |
Sn (к) + 0,5O2 (г) = SnO (к) Sn (к) + O2 (г) = SnO2 (к) |
От каких факторов зависит энергия вещества? |
|
36 |
BaO (к) + CO2 (г) = BaCO3 (к) |
Fe2O3(к) + 3H2(г) = 2Fe (к) + 3H2O(г) Fe2O3(к)+3C(графит)=2Fe(к)+3CO(г) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2 (г) |
Какими двумя способами можно рассчитать свободную энергию Гиббса для реакций? |
|
37 |
2H2S(г) + CO2(г) = 2H2O(г) + CS2(г) |
Sn (к) + 0,5O2 (г) = SnO (к) Sn (к) + O2 (г) = SnO2 (к) |
По какой формуле можно рассчитать H реакции? |
|
38 |
BaCO3 (к) = BaO (к) + CO2 (г) |
Pb (к) + 0,5O2 (г) = PbO (к) Pb (к) + O2 (г) = PbO2 (к) |
По какой формуле можно рассчитать S реакции? |
|
39 |
C2H4 (г) + H2O (г) = C2H5OH (ж) |
S (к) + O2 (г) = SO2 (г S (к) + 1,5O2 (г) = SO3 (г) |
Условие принципиальной осуществимости процесса. |
|
40 |
Сu(к) + ZnO(к) = CuO(к) + Zn(к) |
C (графит) + 0,5O2 (г) = CO (г) C (графит) + O2 (г) = CO2 (г) |
Условие равновесия. |
|
41 |
C2H5OH(ж)+3O2(г)= =2CO2 (г)+3H2O(ж) |
FeO (к) + C (графит) = Fe (к) + CO (г) FeO(к)+0,5C(графит)=Fe(к)+0,5CO2(г) FeO (к) + CO (г) = Fe (к) + CO2 (г) |
Условие принципиальной неосуществимости процесса. |
|
42 |
SrO (к) + CO2 (г) = SrCO3 (к) |
Sn (к) + 0,5O2 (г) = SnO (к) Sn (к) + O2 (г) = SnO2 (к) |
От каких факторов зависит внутренняя энергия вещества? |
|
43 |
CO (г) + 2H2 (г) = СH3OH (ж) |
Fe (к) + 0,5О2 (г) = FeO (к) 2Fe (к) + 1,5O2 (г) = Fe2O3 (к) 3Fe (к) + 2O2 (г) = Fe3O4 (к) |
Сформулируйте три закона термодинамики. Объясните их смысл. |
|
44 |
C2H4(г)+3O2(г)=2CO2(г)+2H2O(ж) |
S (к) + O2 (г) = SO2 (г S (к) + 1,5O2 (г) = SO3 (г) |
Сформулируйте закон Гесса |
|
45 |
CO (г) + 3H2 (г) = СH4(г) + H2O(г) |
FeO (к) + C (графит) = Fe (к) + CO (г) FeO(к)+0,5C(графит)=Fe(к)+0,5CO2(г) FeO (к) + CO (г) = Fe (к) + CO2 (г) |
Условие принципиальной неосуществимости процесса. |
|
46 |
FeO (к) + H2 (г) =Fe (к) + H2O(г) |
Fe2O3(к) + 3H2(г) = 2Fe (к) + 3H2O(г) Fe2O3(к)+3C(графит)=2Fe(к)+3CO(г) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2 (г) |
Какими двумя способами можно рассчитать свободную энергию Гиббса для реакций? |
|
47 |
Fe (к) + H2O(г) = FeO (к) + H2 (г) |
C (графит) + 0,5O2 (г) = CO (г) C (графит) + O2 (г) = CO2 (г) |
Условие принципиальной осуществимости процесса. |
|
48 |
3Fe2O3(к)+H2 (г)=2Fe3O4(к)+H2O(г) |
Pb (к) + 0,5O2 (г) = PbO (к) Pb (к) + O2 (г) = PbO2 (к) |
Сформулируйте закон Гесса |
|
49 |
Fe2O3 (к)+3H2 (г) = 2Fe (к)+3H2O (г) |
Fe (к) + 0,5О2 (г) = FeO (к) 2Fe (к) + 1,5O2 (г) = Fe2O3 (к) 3Fe (к) + 2O2 (г) = Fe3O4 (к) |
По какой формуле можно рассчитать H реакции? |
|
50 |
2Fe (к) + 3H2O(г)=Fe2O3(к) + 3H2(г) |
S (к) + O2 (г) = SO2 (г S (к) + 1,5O2 (г) = SO3 (г) |
Объясните физический смысл термодинамических функций. |
|
51 |
8Al(к)+3Fe3O4(к)=9Fe(к)+4Al2O3(к) |
C (графит) + 0,5O2 (г) = CO (г) C (графит) + O2 (г) = CO2 (г) |
По какой формуле можно рассчитать H реакции? |
|
52 |
9Fe (к)+4Al2O3(к) =8Al(к)+3Fe3O4(к) |
Fe2O3(к) + 3H2(г) = 2Fe (к) + 3H2O(г) Fe2O3(к)+3C(графит)=2Fe(к)+3CO(г) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2 (г) |
По какой формуле можно рассчитать G реакции? |
|
53 |
C2H4(г)+3O2(г)=2CO2(г)+2H2O(ж) |
Fe (к) + 0,5О2 (г) = FeO (к) 2Fe (к) + 1,5O2 (г) = Fe2O3 (к) 3Fe (к) + 2O2 (г) = Fe3O4 (к) |
По какой формуле можно рассчитать S реакции? |
|
54 |
Fe2O3 (к)+3H2 (г) = 2Fe (к)+3H2O (г) |
Fe2O3(к) + 3H2(г) = 2Fe (к) + 3H2O(г) Fe2O3(к)+3C(графит)=2Fe(к)+3CO(г) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2 (г) |
Сформулируйте законы термодинамики. Объясните их смысл. |
|
55 |
CaO (к) + H2O (ж) = Ca(OH)2 (к) |
Sn (к) + 0,5O2 (г) = SnO (к) Sn (к) + O2 (г) = SnO2 (к) |
Условие принципиальной осуществимости процесса. |
|
56 |
CaCO3 (к) = CaO (к) + CO2 (г) |
S (к) + O2 (г) = SO2 (г S (к) + 1,5O2 (г) = SO3 (г) |
Условие равновесия. |
|
57 |
BaO (к) + CO2 (г) = BaCO3 (к) |
Pb (к) + 0,5O2 (г) = PbO (к) Pb (к) + O2 (г) = PbO2 (к) |
Условие принципиальной неосуществимости процесса. |
|
58 |
3Fe2O3(к)+H2 (г)=2Fe3O4(к)+H2O(г) |
C (графит) + 0,5O2 (г) = CO (г) C (графит) + O2 (г) = CO2 (г) |
По какой формуле можно рассчитать H реакции? |
|
59 |
8Al(к)+3Fe3O4(к)=9Fe(к)+4Al2O3(к) |
Fe (к) + 0,5О2 (г) = FeO (к) 2Fe (к) + 1,5O2 (г) = Fe2O3 (к) 3Fe (к) + 2O2 (г) = Fe3O4 (к) |
Какими двумя способами можно рассчитать свободную энергию Гиббса для реакций? |
|
60 |
SrO (к) + CO2 (г) = SrCO3 (к) |
FeO (к) + C (графит) = Fe (к) + CO (г) FeO(к)+0,5C(графит)=Fe(к)+0,5CO2(г) FeO (к) + CO (г) = Fe (к) + CO2 (г) |
Сформулируйте законы термо-динамики. Объясните их смысл. |
Химическая кинетика
Химической кинетикой называется учение о скорости химических реакций и химическом равновесии. Скоростью химической реакции называют величину изменения концентрации одного из веществ – участников реакции в единицу времени. Химическое равновесие – это такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Зависимость скорости реакции (прямой или обратной) определяется законом действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед ними в уравнении реакции. Так, в равновесии 2NO(г) + CI2(г) ↔ 2NOCI(г) для прямой реакции скорость V = k·[NO]2· [CI2], где k – коэффициент пропорциональности, называемый константой скорости, квадратные скобки означают «концентрацию вещества». Если реакция гетерогенная, т.е. между веществами, находящимися в разных фазах, то в выражение включаются только те вещества, которые распределены в объёме системы. например, в равновесии С(тв.) + CO2(г) ↔ 2CO(г) для прямой реакции V = k [СО2].
Если концентрации реагирующих веществ меняются, то скорость реакции меняется тоже, в соответствии с законом действующих масс. Так, увеличение концентраций веществ в 2 раза, приведёт к увеличению скоростей прямой реакции в первом равновесии – в 8 раз (22 ·2), во втором равновесии – в 2 раза. Скорости обратных реакций при этом тоже возрастают: в обоих равновесиях – в 4 раза. Эта неодинаковость возрастания скоростей прямой и обратной реакций приведёт к сдвигу химического равновесия вправо (в первом случае) и влево (во втором). Это будет происходить при увеличении давления в 2 раза в обоих равновесиях.
Направление сдвига (смещения) химического равновесия в системе определяется принципом Ле Шателье. При внешнем воздействии на систему, равновесие в ней смещается так, чтобы уменьшить это воздействие. Как действует изменение давления, видно из рассмотренных выше примеров. Изменение концентрации также легко объясняется: увеличение концентрации только исходных веществ увеличивает скорость только прямой реакции, что вызовет сдвиг равновесия вправо, и т.д.
Влияние изменения температуры на сдвиг равновесия связано с тепловым эффектом (изменением энтальпии, ∆Η) реакции. так, для прямой реакции С(тв.) + H2O(г) = CO(г) + H2(г) величина ∆Η = + 131,4 кДж, т.е. поглощается тепловая энергия. Обратная реакция идёт, соответственно, с выделением энергии. Если в этой системе, в состоянии равновесия, увеличивать температуру, то сдвиг будет происходить вправо. Таким образом эндотермический эффект прямой реакции уменьшит воздействие температуры.
Зависимость
скорости химической реакции от температуры
даётся правилом Вант – Гоффа: изменение
температуры на каждые 100
соответственно изменяет скорость
химической реакции в 2![]() 4
раза. Это правило выражается формулой:
4
раза. Это правило выражается формулой:
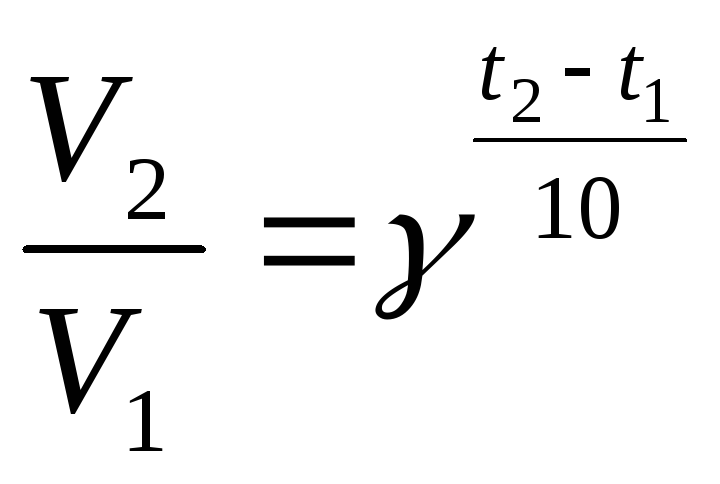 (1)
(1)
Где: V2 и V1 – конечная и исходная скорости, t2 и t1 – конечная и исходная температура, γ - температурный коэффициент скорости реакции (который и находится в диапазоне от 2 до 4).
Так, если некоторая химическая реакция имеет γ = 2,5, а температура меняется от 400 до 20 0С, то скорость реакции уменьшится в 6,25 раза (2,540-20/10 = 2,52,0).
Исходя из равенства скоростей прямой и обратной реакции, выводится выражение для константы химического равновесия. Так, для системы:
mA(г) + nB(г) ↔ pC(г) + qD(г)
имеем:
![]()
Если система гетерогенная, то в эту дробь будут входить только концентрации веществ, распределённых во всём объёме системы. Величина константы характеризует степень смещения равновесия. Так, если k>>1, то равновесие сильно смещено вправо.
Вопросы контрольного задания (см. таблицу)
-
Как изменится скорость некоторой химической реакции, если температура системы меняется в диапазоне ∆t0 при температурном коэффициенте скорости γ.(графа 2)
-
Написать выражение закона действующих масс для прямых и обратных реакций (учитывая возможность наличия гетерогенных систем). (графа 3)
-
Во сколько раз и как изменится скорость химической реакции (прямой или обратной) при изменении концентраций и давления в системе. (графа 4)
-
Сформулируйте принцип, описывающий направление смещения химического равновесия. В какую сторону и почему сместится равновесие в указанных случаях? (графа 5)
-
Рассчитайте величину константы химического равновесия для указанной системы, если концентрации всех газообразных веществ одинаковы и равны указанной величине. (графа 6)
Список литературы.
-
Суворов А.В. Никольский А.Б, Общая химия, СПб, Химиздат,2000 г.
-
Коровин В.Н. Общей химия, М. Высшая школа, 2000 г.
-
Глинка Н.Л. Общая химия – Л. Химия, 1985 г.
-
Глинка Н.Л. задачи и упражнения по общей химии – Л. Химия, 1985 г
Варианты контрольного задания
-
№
вари- анта
Δt, 0С и γ
Равновесие системы и знак изменения энтальпии
Во сколько раз и как изменится скорость реакции
смещение равновесия в результате:
Величины концен-
траций, моль/л
61
от 250 до 600
при γ = 2,1
N2(г) + 3H2(г) ↔NH3(г) ; ∆H<0 (1)
Fe(кр.)+H2O(г)↔FeO(кр.) +H2(г) ; ∆H<0 (2)
Обратной (схема 1) при увеличении концентрации продуктов реакции в 4 раза, и прямой при возрастании давления в системе в 3 раза
Понижения температуры в системе (1); уменьшения давления в системе (2)
0,1
62
от 950 до 650
при γ = 4,0
2H2S(г)+3O2(г) ↔2SO2(г)+ 2H2O(г) ; ∆H<0 (1)
2Na(кр.)+ 2H2O(ж)↔2NaOH(ж)+ H2(г) ∆H<0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 2 раза, и обратной при возрастании давления в системе в 3 раза
Повышения температуры в системе (1); увеличения давления в системе (2)
0,6
63
от 300 до 1000
при γ = 2,5
2SO2(г) + O2(г) ↔2SO3(г) ; ∆H<0 (1)
AI2O3(кр.)+ 3H2O(г) ↔AI(OH)3(кр.) ; ∆H<0 (2)
Прямой (схема 2) при увеличении концентрации исходных веществ в 3 раза, и обратной при возрастании давления в системе в 2 раза
Понижения температуры в системе (1); увеличения давления в системе (2)
0,02
64
от 850 до 450
при γ = 3,2
2HCI(г)+ Br2(г)↔2HBr(г)+CI2(г) ; ∆H<0 (1)
FeSO4(р-р)+Сu(кр.)↔ Fe(кр)+CuSO4(р-р) ;
∆H>0 (2)
Прямой (схема 2) при увеличении концентрации исходных веществ в 4 раза, и обратной при возрастании давления в системе в 3 раза
Понижения температуры в системе (1); уменьшения давления в системе (2)
1,0
65
от 450 до 1050 при γ = 3,8
4HCI(г)+ O2(г)↔2H2O(г)+2CI2(г) ; ∆H<0 (1)
P2O5(ж) ↔ P2O3(ж) + O2(г) ; ∆H>0 (2)
Обратной (схема 1) при увеличении концентрации продуктов реакции в 2 раза, и прямой при уменьшении давления в системе в 3 раза
Повышения температуры в сис-теме (2); уменьшения давления в системе (1)
0,3
66
от 850 до 1150
при γ = 3,4
С2H5OH(г) +3O2(г)↔2CO2(г)+3H2O(г) ; ∆H<0
(1)
FeO(кр.)+H2(г)↔ Fe(кр.)+H2O(кр.) ; ∆H>0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 2 раза, и обратной (схема 2) при возрастании давления в системе в 4 раза
Повышения температуры в системе (1); уменьшения давления в системе (2)
1,1
67
от 750 до 250
при γ = 3,1
H2(г)+ CO2(г)↔CO(г)+H2O(г) ; ∆H>0 (1)
C(кр.) + CO2(г) ↔ 2CO(г); ∆H>0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 4 раза, и прямой (схема 2) при возрастании давления в системе в 3 раза
Понижения температуры в систе- ме (1); уменьшения давления в системе (2)
0,06
68
от 450 до 650
при γ = 2,7
2Fe(кр.)+3CO2(г)↔Fe2O3(кр.)+ 3CO(г) ; ∆H<0
(1)
2N2(г) + O2(г) ↔2N2O(г) ; ∆H>0 (2)
Прямой (схема 1) при уменьшении концентрации исходных веществ в 2 раза, и обратной (схема2) при уменьшении давления в системе в 4 раза
Понижения температуры в систе- ме (1); увеличения давления в системе (2)
0,9
69
от 600 до 900
при γ = 3,2
2NO2(г) ↔2NO(г) +O2(г) ; ∆H>0 (1)
CuO(кр.)+CO(кр.) ↔Сu(г) +CO2(г) ; ∆H<0 (2)
Обратной (схема 2) при увеличении концентрации продуктов реакции в 3 раза, и прямой (схема 1) при уменьшении давления в системе в 10 раз
Понижения температуры в системе (2); понижения давления в системе (1)
0,5
70
от 650 до 850
при γ = 3,6
Са(кр.)+ 2H2O(г) ↔Са(OH)2(г)+H2(г);∆H<0 (1
SO2CI2(г) ↔SO2(г) +CI2(г) ; ∆H>0 (2)
Прямой (схема 1) при увеличе-нии концентрации исходных веществ в 3 раза, и обратной (схема 2) при возрастании давления в системе в 4 раза
Повышения температуры в систе- ме (2); понижения давления в системе (2)
0,8
71
от 950 до 750
при γ = 3,9
SF6(г) +3H2O(г) ↔SO3(г) +6HF(г) ; ∆H<0 (1)
2BaSO4(кр.) ↔2BaSO3(кр.)+O2(г) ; ∆H>0 (2)
Обратной (схема 1) при увеличении концентрации продуктов реакции в 2 раза, и обратной (схема 2) при возрастании давления в системе в 3 раза
Понижения температуры в системе (1); повышения давления в системе (2)
0,04
72
от 100 до 1000
при γ = 2,3
2Fe(кр.) +3CI2(г) ↔2FeCI3(кр) ; ∆H<0 (1)
2NOCI(г) ↔2NO(г)+CI2(г) ; ∆H>0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 3 раза, и обратной (схема 2) при возрастании давления в системе в 2 раза
Повышения температуры в системе (1); повышения давления в системе (2)
0,7
73
от 750 до 350при γ = 3,6
Ca(OH)2(кр.) ↔СаO(кр.)+H2O(г); ∆H>0 (1)
3C2H2(г) ↔C6H6(г) ; ∆H<0 (2)
Обратной (схема 1) при увеличении концентрации продуктов реакции в 3 раза; при возрастании давления в системе в 2 раза
Повышения температуры в системе (1); уменьшения давления в системе
(2)
0,4
74
от 500 до 1100
при γ = 3,4
CS2(г)+3O2(г) ↔CO2(г) +2SO2(г) ; ∆H<0 (1)
2S(ж)+2H2O(г) ↔2H2S(г)+O2(г); ∆H>0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 2 раза, и обратной (схема 2) при уменьшении давления в системе в 2 раза
Понижения температуры в системе (1); увеличения давления в системе (2)
0,07
75
от 550 до 1150
при γ = 2,9
CS2(ж)+3CI2(г) ↔CCI4(ж)+S2CI2(ж); ∆H<0 1
2Na(г)+ CI2(г) ↔2NaCI(ж); ∆H<0 (2)
Прямой (схема 2) при увеличе-нии концентрации исходных веществ в 3 раза, и обратной (схема 1) при возрастании давления в системе в 2 раза
Повышения температуры в системе (1); увеличения давления в системе (2)
0,1
76
от 700 до 1000
при γ = 3,0
S(г)+O2(г) ↔SO2(г) ; ∆H<0 (1)
2TiCI3(кр.) ↔TiCI2(кр.)+ TiCI4(кр.); ∆H>0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 4 раза, и обратной (схема 2) при возрастании давления в системе в 3 раза
Понижения
температуры в системе (1); уменьшения давления в системе
(2)
0,7
77
от 150 до 950
при γ = 2,4
2BH3(г) ↔B2H6(г) ; ∆H<0 (1)
СаSO4(кр.) ↔CaO(кр.)+SO3(г) ; ∆H>0 (2)
Обратной (схема 2) при увеличении концентрации продуктов реакции в 4 раза, и прямой (схема 1) при возрастании давления в системе в 2 раза
Повышения температуры в системе (1); увеличения давления в системе (2)
0,09
78
от 900 до 400
при γ = 3,3
Рb(кр.)+ CO2(г)↔PbO(кр)+ CO(г); ∆H>0 (1)
C4H10(г) ↔C4H6(г) + 2H2(г) ; ∆H<0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 2 раза, и обратной (схема 2) при уменьшении давления в системе в 4 раза
Повышения температуры в системе (1); увеличения давления в системе (2)
0,8
79
от 400 до 700
при γ = 3,8
2C2H6(г)+7O2(г)↔4CO2(г)+6H2O(г); ∆H<0 (1)
CaO(кр.)+CO2(г) ↔CaCO3(кр.) ; ∆H<0 (2)
Прямой (схема 2) при увеличении концентрации исходных веществ в 5 раз, и обратной (схема 1) при увеличении давления в системе в 2 раза
Повышения температуры в системе (2); увеличения давления в системе (1)
0,6
80
от 700 до 500
при γ = 2,8
2NO(г) ↔N2(г)+O2(г) ; ∆H<0 (1)
NH4CI(кр.) ↔NH3(г)+HCI(г) ; ∆H>0 (2)
Обратной (схема 1) при увели-чении концентрации продуктов реакции в 2 раза, и обратной (схема 2) при увеличении давления в системе в 2 раза
Понижения
температуры в системе (1); уменьшения давле-ния в системе (2)
0,03
81
от 800 до 300
при γ = 3,7
4P(г)+5O2(г)↔2P2O5(ж) ; ∆H<0 (1)
N2O4(г) ↔2NO2(г) ; ∆H>0 (2)
Обратной (схема 2) при увеличении концентрации продуктов реакции в 5 раз, и прямой (схема 1) при уменьшении давления в системе в 2 раза
Понижения температуры в системе (1); увеличения давления в системе (2)
0,25
82
от 200 до 800
при γ = 2,2
С3H8(г)↔ С3H6(г)+H2(г) ; ∆H<0 (1)
2MgO(кр.) ↔2Mg(г)+O2(г) ; ∆H>0 (2)
Обратной (схема 1) при увеличении концентрации продуктов реакции в 4 раза, и обратной (схема 2) при возрастании давления в системе в 2 раза
Понижения температуры в системе (1); повышения давления в системе (2)
0,2
83
от 650 до 850
при γ = 3,3
SiO2(кр.)+4F2(г) ↔SiF4(г)+2OF2(г) ; ∆H<0 (1)
2H2O(г) ↔2H2(г)+O2(г) ; ∆H>0 (2)
Прямой (схема 1) при увеличении концентрации исходных веществ в 5 раз, и обратной (схема 2) при возрастании давления в системе в 3 раза
Повышения температуры в систе- ме (1); повышения давления в системе (2)
0,9
84
от 900 до 600
при γ = 3,9
PCI5(г) ↔ PCI3(г)+СI2(г) ; ∆H>0 (1)
Fe2O3(кр.)+4H2(г)↔3Fe(кр.)+4H2O ; ∆H<0 (2)
Обратной (схема 1) при уменьшении концентрации продуктов реакции в 2 раза, и прямой при возрастании давления в системе в 2 раза
Понижения температуры в системе (1); повышения давления в системе (2)
0,5
85
от 500 до 200
при γ = 3,1
2Fe(кр.) +3CI2(г) ↔2FeCI3(кр) ; ∆H<0 (1)
2N2(2) + 6H2O(г) ↔4NH3(г)+3O2(г) ; ∆H>0 (2)
Прямой (схема 1) при уменьшении концентрации исходных веществ в 3 раза, и обратной (схема 2) при умень-шении давления в системе в 2 раза
Повышения температуры в системе (1); повышения давления в системе (2)
0,05
86
от 550 до 950
при γ = 3,0
2HCI(г) ↔H2(г)+CI2(г) ; ∆H>0 (1)
2H2S(г)+SO2(г) ↔3S(ж)+2H2O(г) ; ∆H<0 (2)
Прямой (схема 1) при увеличе-нии концентрации исходных веществ в 4 раза, и обратной (схема 2) при увеличении давления в системе в 3 раза
Понижения температуры в системе (1); понижения давления в системе (2)
1,0
87
от 350 до 1050
при γ = 3,5
2KOH(кр.)+Cr2O3(кр.)↔2KCrO2(кр.)+H2O(г);
∆H<0 (1)
H2O(г)+C2H4(г) ↔C2H5OH(г) ; ∆H<0 (2)
Прямой (схема 2) при увеличе-нии концентрации исходных веществ в 2 раза, и обратной (схема 1) при увеличении давления в системе в 5 раз
Понижения температуры в системе (1); повышения давления в системе (2)
0,3
88
от 1000 до 600
при γ = 2,6
2K(ж)+2H2O(г)↔2KOH(ж)+H2(г); ∆H<0 (1)
C2H4CI2(г) ↔ C2H4(г)+CI2(г) ; ∆H>0 (2)
Прямой (схема 1) при увеличе-нии концентрации исходных веществ в 3 раза, и обратной (схема 2) при уменьшении давления в системе в 2 раза
Повышения температуры в системе (1); понижения давления в системе (2)
0,08
89
от 800 до 1100
при γ = 3,5
SO2(г)+СаO(кр.) ↔CaSO3(кр.) ; ∆H<0 (1)
CCI4(г)+4HCI(г) ↔СH4(г)+4CI2(г); ∆H>0 (2)
Прямой (схема 1) при увеличе-нии концентрации исходных веществ в 4 раза, и обратной (схема 2) при увеличении давления в системе в 3 раза
Понижения температуры в системе (1); повышения давления в системе (2)
0,4
90
от 600 до 900
при γ = 2,9
2Fe(кр.) +3CI2(г) ↔2FeCI3(ж) ; ∆H<0 (1)
CO2(г)+H2(г) ↔CO(г)+H2O(г) ; ∆H>0 (2)
Прямой (схема 1) при увеличе-нии концентрации исходных веществ в 2 раза, и прямой (схема 2) при уменьшении давления в системе в 4 раза
Повышения температуры в системе (1); повышения давления в системе (2)
0,01
ЭЛЕКТРОХИМИЯ МЕТАЛЛОВ
Электродные потенциалы. Гальванический элемент
Металлы составляют большую часть таблицы Д.И.Менделеева. Наиболее распространенными являются: Al – 7,45%, Fe – 4,2%, Ca – 3,25%, Na – 2,4%, Mg – 2,35%, K – 2,35%.
Все характерные свойства металлических твердых тел обусловлены Природой металлов, особенностью химической связи и строением кристаллической решетки. Для металлических твердых тел характерны высокая теплопроводность, электропроводность, пластичность, деформируемость, высокая плотность, а также способность терять электроны – восстановительная активность.
Величиной, характеризующей восстановительную способность металлических твердых тел, а также окислительные свойства ионов металлов в водных растворах, является электродный потенциал, который обозначается и измеряется в вольтах (В).
Электрод – это в данном случае металл, в твердом состоянии, погруженный в воду или в водный раствор своей соли. Электродный потенциал (Ме) описывается общим уравнением на его границе с окружающей средой: Ме – ne + mH2OМеn+.mH2O – гидратированный ион металла. Стандартным электродным потенциалом (о) называют электродный потенциал металла, возникающий при погружении его в раствор соли собственного иона с активностью (или концентрацией), равной 1 молю на литр (1 моль/литр), измеренный по сравнению со стандартным водородным электродом, потенциал которого при Т = 293 К и Р = 1,01 * 105 Па условно принимается равным 0 (о = 0, Gо = 0). Стандартные электродные потенциалы описывают процесс равновесия описывают процесс равновесия Ме – ne = Меn+; являются характеристикой окислительно-восстановительного равновесия и характеризуют природу металла. Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (о), получаем ряд напряжений, который дает следующую информацию (прил. 4):
-
чем более отрицательное значение потенциала, тем более активен металл, тем легче он окисляется;
-
чем более положительное значение потенциала, тем легче идет восстановление иона металла;
-
каждый вышестоящий металл способен вытеснять нижестоящий из раствора его соли.
