
- •Кафедра «Инженерная химия и естествознание»
- •Методические указания
- •Заполнение электронных состояний в атоме
- •1. Минимум энергии подуровня.
- •2. Принцип запрета Паули.
- •3. Правило Гунда.
- •Сродство к электрону.
- •Электроотрицательность.
- •Энергетика химических реакций. Химическая термодинамика.
- •1 Закон (начало) термодинамики.
- •Термохимические уравнения. Закон Гесса.
- •Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
- •Катодные процессы
- •Анодные процессы При рассмотрении анодных процессов следует различать электролиз с инертным анодом и электролиз с активным анодом, т.Е. Материал которого может окисляться.
- •Законы электролиза
- •Пассивное состояние металлов
- •Некоторые константы и величины
- •Приложение 4 Электродные потенциалы
- •Приложение 5 Произведение растворимости (пр) труднорастворимых
Заполнение электронных состояний в атоме
Набор квантовых чисел определяет энергетическое состояние электрона в атоме. В атоме число электронов равно номеру элемента или, точнее, заряду ядра атома. В дальнейшем будет говориться о числе электронов, подразумевая соответствующий заряд ядра атома или номер элемента. При заполнении электронных состояний атома всегда заполняется вначале то состояние, которое имеет меньшую энергию.
Когда имеем один электрон, то он будет занимать самый низший по энергии уровень с n=1. В этом случае l=0, m=0, а ms может принимать два значения +1/2 или -1/2.
Запись электронной структуры производят, руководствуясь следующими правилами: сначала пишут значение главного квантового числа, затем тип орбитали, показателем которой является число электронов на данном подуровне. Возможно и графическое представление. В этом случае строят график, ординатой которого является энергия, абсциссой – значение главного квантового числа. На этом графике каждой орбитали соответствует черточка, на которой стрелочками рисуют электроны (стрелочка вверх – ms=+1/2, стрелочка вниз - ms = -1/2).
Когда имеется один электрон, то он занимает самый низший по энергии первый уровень. Электронная структура атома водорода имеет вид: 1s1 или в графическом виде:
Е Е
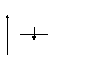
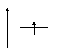
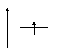
n 1 или n 1
В
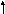 дальнейшем, для простоты будут приводится
графическое представление только
последних орбиталей и без указания на
рисунке координаты энергии и значений
главного квантового числа. Для следующего
элемента (Не) электронная структура
имеет вид 1s2. на этом
уровне все места заняты и следующий
электрон у лития приходит уже на второй
(L) уровень, так как согласно
принципа запрета Паули третьего электрона
на первом уровне быть не может (он
обязательно будет иметь набор квантовых
чисел, совпадающий с уже имеющимся).
Соответственно, электронная структура
лития имеет вид:Li 1s22s1.
У следующего элемента : Be
1s22s2.
И на этом места на первом подуровне
второго уровня кончились. Поэтому
следующий электрон у бора помещается
на р-подуровне, и электронная структура
имеет вид: B 1s22s22p1.
заполнение р-подуровня будет продолжаться
до неона, имеющего электронную структуру
1s22s22p6.
И на этом элементе места на втором уровне
будут все исчерпаны. Интересная ситуация
возникает у азота (1s22s22p3).
Размещение электронов на р-орбиталях
может быть
дальнейшем, для простоты будут приводится
графическое представление только
последних орбиталей и без указания на
рисунке координаты энергии и значений
главного квантового числа. Для следующего
элемента (Не) электронная структура
имеет вид 1s2. на этом
уровне все места заняты и следующий
электрон у лития приходит уже на второй
(L) уровень, так как согласно
принципа запрета Паули третьего электрона
на первом уровне быть не может (он
обязательно будет иметь набор квантовых
чисел, совпадающий с уже имеющимся).
Соответственно, электронная структура
лития имеет вид:Li 1s22s1.
У следующего элемента : Be
1s22s2.
И на этом места на первом подуровне
второго уровня кончились. Поэтому
следующий электрон у бора помещается
на р-подуровне, и электронная структура
имеет вид: B 1s22s22p1.
заполнение р-подуровня будет продолжаться
до неона, имеющего электронную структуру
1s22s22p6.
И на этом элементе места на втором уровне
будут все исчерпаны. Интересная ситуация
возникает у азота (1s22s22p3).
Размещение электронов на р-орбиталях
может быть

![]() или
или
 .
Для первой структуры суммарное значение
ms=3/2,
а для второй - +1/2. Возникает вопрос, какая
структура более правильна? На этот
случай имеется правило Гунда,
имеющего формулировку: заполнение
электронных состояний протекает таким
образом, чтобы суммарное значение спина
(ms)
было максимальным. Согласно этому
правилу будет правильной первая
структура, т.к. суммарное значение
спинового квантового числа для нее
больше.
.
Для первой структуры суммарное значение
ms=3/2,
а для второй - +1/2. Возникает вопрос, какая
структура более правильна? На этот
случай имеется правило Гунда,
имеющего формулировку: заполнение
электронных состояний протекает таким
образом, чтобы суммарное значение спина
(ms)
было максимальным. Согласно этому
правилу будет правильной первая
структура, т.к. суммарное значение
спинового квантового числа для нее
больше.
Последовательное заполнение электронных состояний в атоме уже обнаруживает следующую закономерность: кончились места на первом уровне, и закончился первый период периодической системы элементов Д.И.Менделеева, кончились места на втором уровне – закончился второй период. Таким образом, можно утверждать, что строение и структура периодической таблицы элементов целиком и полностью обусловлено порядком заполнения электронных состояний.
У следующего элемента (Na) начинает заполняться третий уровень, и он имеет электронную структуру: 1s22s22p63s1. Поскольку на третьем уровне могут разместиться 18 электронов, то могли бы ожидать, что в третьем периоде будет 18 элементов. В то время как их на самом деле только 8 . Почему это происходит? Причина следующая. Энергия состояния характеризуется двумя квантовыми числами: n и l. Поэтому энергия 4s подуровня оказывается, в момент заполнения, меньше чем энергия 3d подуровня. Устойчивое состояние любой системы характеризуется минимально возможным значением энергии системы. Это и приводит к тому, что сначала происходит заполнение 4s состояний, а лишь потом 4d. Соотношение энергий подуровней в момент заполнения имеет вид: Ens<E(n-1)d≈E(n-2)f.
Учесть эти соотношения помогают правила Клечковского:
1-ое правило. Электронные состояния в атоме заполняются по мере роста суммы главного и орбитального квантовых чисел.
2-ое правило. При одинаковом значении этой суммы заполнение протекает по мере роста главного квантового числа.
Эти правила эмпирические и имеют отклонения, связанные, прежде всего с тем, что конфигурации nd5, nd10, nf7, nf14 имеют энергетические преимущества. Так, например, у Cr должна была быть конфигурация 1s22s22p63s23p64s23d4, а на самом деле реализуется конфигурация 1s22s22p63s23p64s13d5., так как ее энергия меньше. Таким образом, заполнение протекает не только по минимуму энергии уровня или подуровня, но и по минимуму реализующейся конечной электронной конфигурации атома.
Последовательность заполнения электронных состояний в атоме можно представить в виде:
1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s25d14f145d96p6 7s26d15f146d97p6 (3). Конец периода – пробел.
Обратите внимание, что в 6-ом и 7-ом периодах сначала один электрон занимает d-состояние, затем происходит полное заполнение f-подуровня, и лишь после этого протекает заполнение d-подуровня до 10 электронов, т.е. d-электронов 10 , а не 9! Следует отметить, что после полного заполнения d- и f-подуровней они «проваливаются» по энергии и соотношение по энергии имеет вид: Ens>E(n-1)d>E(n-2)f.
ПРИМЕР 1. напишите электронную структуру элемента с №85.
Решение. Так как № элемента 85, то у него 85 электронов и, пользуясь схемой заполнения (3), имеем Э(85) 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p5. И здесь и в схеме заполнения орбитали расположены по возрастанию энергии.
И последнее. При заполнении электронных состояний атома последовательно реализуются следующие принципы:
