
- •5.Общая схема организации растительной клетки.
- •6.Методы исследования.
- •7.Основные закономерности поглощения воды клеткой.(Ксения Копылова)
- •8.Осмос и его законы.
- •9.Растительная клетка - осмотическая система.
- •10.Водный режим растений.(Дарья Тимофеева)
- •12.Поглощение воды растением
- •13.Транспорт воды по растению.
- •14.Механизмы передвижения воды по растению
- •12. Валовой химический состав пахотных горизонтов почв (% на прокаленную навеску) в сравнении с зольным составом растений (% на золу)
- •18.Классификации элементов, необходимых для растений.
- •19.Механизмы поглощения и транспорта минеральных элементов
- •25.Фосфорилирование на уровне субстрата и фосфорилирование в дыхательной цепи.
- •26.Мембраны как структурная основа биоэнергетических процессов.
- •27.Электро-химический потенциал – движущая сила фосфорилирования.
- •28.Регуляция электронного транспорта и фосфорилирования
- •29.Роль дыхания в продукционном процессе.
- •30.Составляющие дыхания.
- •32.Структурная организация фотосинтетического аппарата. (Быкова Татьяна)
- •33.Роль фотосинтеза в процессах энергетического и пластического обмена растительного организма.
- •34.Фотосинтетические пигменты
- •35.Хлорофилл-белковые комплексы. (Климова к)
- •36.Первичные процессы фотосинтеза. Поглощение света и передача энергии возбуждения
- •37.Регуляция электрон-транспортной цепи фотосинтеза.Основные функциональные комплексы этц
- •38.Темновая стадия фотосинтеза. (Татьяна Евсеева)
- •39.Экология фотосинтез
- •41. Активный транспорт ионов. Механизм поглощения ионов растениями
- •45. Каротиноиды. Химическое строение и функции.
- •46. Кинетика процессов поглощения ионов. Участие мембранных структур клетки в поглощении и компартментации ионов.
- •47. Корень как орган поглощения минеральных элементов и воды.(Дарья Тимофеева)
- •48. Корневая система как орган потребления воды. Корневое давление: значение, механизм и методы определения.
- •52. Основные соединения серы в растении, их метаболизм и функции.
- •53. Основные соединения фосфора в растении, их метаболизм и функции.
- •54. Особенности водного обмена различных групп растений (ксерофиты, мезофиты, гидрофиты). Механизмы адаптации растений к дефициту влаги.
- •55. Поступление, метаболизм и функции калия в растениях.
- •56. Поступление, метаболизм и функции кальция в растениях. (Тимофеева Даша)
- •57. Почва как источник минеральных элементов для растений.
- •59. Реакция растений на высокое содержание солей в почве.
- •60. Ростовые и тургорные движения растений .
- •61. Транспирация, ее формы и физиологическое значение. Количественные показатели
- •62. Цикл Кребса. Механизмы регуляции цикла.
- •63. Цикл Хэтча-Слэка-Карпилова
- •64. Электрон-транспортная цепь митохондрий
- •65. Кислотный метаболизм Толстянковых (сам-фотосинтез)
- •66. Гликолатный цикл
- •67.Фоторазложение воды.
41. Активный транспорт ионов. Механизм поглощения ионов растениями
Большинство ионных насосов для мембранного транспорта использует энергию АТФ или пирофосфата. Первично-активный транспорт ионов в клетках растений осуществляется за счет транспортных АТФаз, пирофосфатаз и АВС-переносчиков. Транспортные АТФазы делят на F-, Р - и V-типы. АТФазы F-типа называют также АТФ-синтазами, которые участвуют в синтезе АТФ на сопрягающих мембранах митохондрий и тилакоидов.
Протонные АТФазы плазматической мембраны.
Протонные помпы плазмалеммы (H- ATФаза) играют центральную роль в процессах мембранного транспорта растительной клетки, обеспечивая АТФ-зависимую секрецию ионов H в экстра-клеточную среду, что приводит к созданию на плазматической мембране электро-химического градиента ионов H. Работа протонных помп плазмалеммы играет важную роль в поддержании рН цитоплазмы, регуляции роста клеток растяжением, открывании устьиц, загрузке флоэмных окончаний и солеустойчивости. Энергия электрохимического градиента ионов H обеспечивает работу большинства белков-переносчиков, участвующих в процессах вторично-активного транспорта.
Ca-АТФазы. Система активного транспорта ионов 2Ca необходима для осуществления по крайней мере четырех важных функций растительной клетки: во-первых, пополнения запасов кальция в клеточных компартментах для последующего его высвобождения через Са-каналы в ходе проведения сигналов; во-вторых, поддержания низкой концентрации ионов 2Ca в цитоплазме для формирования пространственно-временных параметров Са-сигнала; в третьих, снабжения кальцием биохимических процессов в органеллах клетки; в-четвертых, обеспечения ионами 2Ca межмембранных взаимодействий, например таких, как транспорт везикул,их слияние и секрецию.
P1B-тип транспортных АТФаз — транспортеры тяжелых металлов. Переходные металлы, такие как Fe, Cu, Mn, Zn и Мо, являются обязательными микроэлементами, необходимыми для нормального роста и развития растений. При этом следует иметь в виду, что они могут быть токсичными, если присутствуют в избыточных количествах. Поэтому содержание переходных металлов в растении строго контролируется как на уровне клетки, так и клеточных компартментах за счет системы мембранного транспорта этих металлов. Выявлены десятки белковых переносчиков, обеспечивающих поглощение, распределение и гомеостаз переходных металлов в растениях. К ним относятся белки Nramps, семейство CDF-белков, ZIP-белки, катион/H антипортеры, АВС-переносчики, а также АТФазы — транспортеры тяжелых металлов (HMA, heavymetal ATPases), относящиеся к P1B-типу транспортных АТФаз.
Протонные АТФазыV-типа. Протонные помпы вакуолярного типа (V-АТФазы, VHA) функционируют не только на вакуолярной мембране, но и на эндомембранах и закачивают протоны не только в вакуоль, но также и внутрь эндоплазматического ретикулума и везикул аппарата Гольджи. АТФазы V-типа блокируются нитратом, бафиломицином А, хаотропными (KSCN) и блокирующими SH-группы реагентами. Ингибитор АТФаз Р-типа ванадат на V-АТФазы не действует. Энергия электрохимического градиента протонов, создаваемая на эндомембранах V-АТФазами, может использоваться для работы переносчиков, обеспечивающих вторично-активный транспорт.
Транспортные пирофосфатазы— H+-PPазы. H-пирофосфатазы (H-PPазы) представляют собой самые простые первичные протонные помпы. Они найдены у высших растений, а также у некоторых простейших и прокариот. Для мембранного транспорта протонов H-PPазы используют богатую энергией фосфоангидридную связь пирофосфата. У растений имеются два типа H-PPаз, один из которых зависит от уровня ионов K в цитоплазме, а второй — нет. Для функционирования обоих типов H-пирофосфатаз требуются ионы 2Mg, как кофактор.
H-PPазы катализируют электрогенный транспорт протона из цитозоля в вакуоль, эндоплазматический ретикулум, цистерны аппарата Гольджи, создавая на эндомембранах электрохимический градиент ионов H. Эта энергия используется в процессе вторичного активного транспорта ионов и органических молекул. На долю H-PPаз приходится от 1 до 10% белков тонопласта, поэтому H-PPазы способны создавать почти такой же, как и V-АТФазы, градиент протонов на вакуолярной мембране. H-пирофосфатазы обеспечивают поддержание рН-гомеостаза в отделенных эндомембранами клеточных компартментах, играют важную роль в эндоцитозе и везикулярной секреции, а также в процессах роста и развития.
АВС-переносчиками. АВС-переносчики представляют собой особое суперсемейство систем активного транспорта, найденное у архей, эубактерий и практически всех эукариотических организмов. Большинство АВС-белков являются помпами, некоторые обладают рядом свойств, присущих ионным каналам, или белков, способных модулировать работу каналов и других ионных помп. Часть из них не обладает транспортными функциями. АВС-переносчики осуществляют мембранный транспорт пептидов, аминокислот, сахаров, липидов, ионов металлов, полисахаридов, вторичных соединений, неорганических кислот и конъюгатов трипептида глутатиона. АВС-переносчики обеспечивают активные потоки вышеперечисленных веществ как в экстраклеточное пространство, так во внутриклеточные компартменты. Многие АВС-транспортеры относительно специфичны, однако имеются и такие, которые способны транспортировать различные химические соединения. В растениях этот тип переносчиков функционирует на плазматической мембране, тонопласте, мембранах митохондрий и хлоропластов.
Имеются три главные особенности мембранного транспорта, опосредованного АВС-белками. Во-первых, для него необходима Мg-АТФ. Во-вторых, работа АВС-транспортеров нечувствительна к электрохимическому градиенту ионов H, и протонофоры или ионофоры на него не влияют. И в-третьих, этот тип транспорта сильно подавляется ванадатом, который, связываясь с каталитическим центром, блокирует гидролиз АТФ и транспортную активность АВС-белка.
Переносчики катионов
Мембранный транспорт большинства катионов у растений осуществляется за счет энергии электрохимического градиента ионов H. Таким путем в растительную клетку могут транспортироваться такие катионы, как K, 4NH, Na, 2Ca и 2Mg.
Поглощение ионов растениями.
Наземные растительные организмы в естественных условиях получают необходимые минеральные вещества из почвы. В этом случае корни оказываются в сложной системе биологических и физико-химических взаимоотношений между почвенными частицами, почвенным раствором, почвенными микроорганизмами и грибами. Необходимо также учитывать активность почвенных беспозвоночных и позвоночных животных.
Ионы минеральных солей могут поступать в клетки корневой системы растений как из почвенного раствора, так и в результате контактного обмена с почвенными частицами. Оба эти процесса обычно связаны с обменом ионов H на катионы и анионов 3HCO, OH и органических кислот на минеральные анионы. Бόльшая часть питательных минеральных веществ находится не в почвенном растворе, а адсорбирована на почвенных частицах. Поэтому в минеральном питании растений большее значение имеет процесс обменной адсорбции, которая осуществляется как на органической (гумус), так и на неорганической (алюмосиликаты) части почвы. Почвы, в основном, обладают свойствами катионообменников, хотя в них имеются и анионсвязывающие группы.
Из почвы минеральные элементы поглощаются в виде катионов и анионов. Поступление элементов минерального питания в растение осуществляется с помощью системы ионных помп, обменников и каналов, локализованных на плазматической мембране клеток корня. Попадая в клетку, одни элементы участвуют в метаболизме в форме свободных ионов, другие связываются с органическими соединениями, не претерпевая при этом никаких изменений, третьи же включаются в состав органических молекул только после ряда окислительно-восстановительных превращений. В последние годы удалось выявить механизмы адаптации растений к уровню питательных веществ в почвенном растворе, особенно для азота и калия.
42. Гликолитический путь окисления: основные стадии, механизмы регуляции.Данный путь дыхательного обмена является наиболее распространенным и, в свою очередь, состоит из двух фаз. Первая фаза — анаэробная (гликолиз), вторая фаза — аэробная. Эти фазы локализованы в различных компартментах клетки. Анаэробная фаза гликолиз — в цитоплазме, аэробная фаза — в митохондриях. Обычно химизм дыхания начинают рассматривать с глюкозы. Вместе с тем в растительных клетках глюкозы мало, поскольку конечными продуктами фотосинтеза являются сахароза как основная транспортная форма сахара в растении или запасные углеводы (крахмал и др.). Поэтому, чтобы стать субстратом дыхания сахароза и крахмал должны гидролизоваться с образованием глюкозы.
Анаэробная фаза дыхания (гликолиз).Гликолиз осуществляется во всех живых клетках организмов. В процессе гликолиза происходит преобразование молекулы гексозы до двух молекул пировиноградной кислоты: С6Н1206-> 2С3Н402 + 2Н2. Этот окислительный процесс может протекать в анаэробных условиях (в отсутствие кислорода) и идет через ряд этапов. Прежде всего, для того чтобы подвергнуться дыхательному распаду, глюкоза должна быть активирована. Активация глюкозы происходит путем фосфорилирования шестого углеродного атома за счет взаимодействия с АТФ:

Далее происходит еще одно фосфорилирование при участии АТФ. Фосфорная кислота присоединяется к первому углеродному атому молекулы фруктозы, процесс катализируется ферментом фосфофруктокиназой:
![]()
Дальнейшие реакции, составляющие процесс гликолиза, складываются следующим образом: фруктозо-1,6-дифосфат расщепляется с образованием двух триоз, реакция катализируется ферментом альдолазой, которая состоит из четырех субъединиц и содержит свободные SH-группы. Реакция протекает по уравнению:

Молекула фосфодиоксиацетона при участии фермента триозофосфатизомеразы превращается также в 3-фосфоглицериновый альдегид (ФГА). Дальнейшим превращениям подвергается именно ФГА, окисляясь до 1,3-дифосфоглицериновой кислоты (ДФГК). Это важнейший этап гликолиза. Процесс идет с участием неорганического фосфата (Н3Р04) и фермента глицеральдегид-3-фосфатдегидроге н азы. Молекула этого фермента состоит из четырех идентичных субъединиц. Каждая субъединица представляет одиночную полипептидную цепь приблизительно из 220 аминокислотных остатков. Фермент содержит SH-группы и кофермент НАД, который взаимосвязан с ферментом на всем протяжении процесса. Сущность процесса заключается в окислении альдегидной группы ФГА в карбоксильную ДФГК. Окисление идет с выделением энергии. За счет энергии окисления при участии неорганического фосфата (Н3Р04) в молекуле ДФГК образуется макроэргическая фосфатная связь. Одновременно происходит восстановление кофермента НАД.

Таким образом, на этом этапе энергия окисления аккумулируется в форме энергии фосфатной связи АТФ. Затем 3-ФГК превращается в 2-ФГК, иначе говоря, фосфатная группа переносится из положения 3 в положение 2. Реакция катализируется ферментом фосфоглицеромутазой и идет в присутствии магния:
 гликолиза
носит название субстратного
фосфорилирования, поскольку макроэргические
связи возникают на молекуле окисляемого
субстрата. Если считать, что при распаде
АТФ из АДФ и Фн выделяется 30,6 кДж, то за
период гликолиза накапливается в
макроэргических фосфатных связях всего
61,2 кДж. Прямые определения показывают,
что распад молекулы глюкозы до
пировиноградной кислоты сопровождается
выделением 586,6 кДж. Следовательно,
энергетическая эффективность гликолиза
невелика. Кроме того, образуются 2
молекулы НАДН, которые вступают в
дыхательную цепь, что приводит к
дополнительному образованию АТФ.
Образовавшиеся две молекулы пировиноградной
кислоты участвуют в аэробной фазе
дыхания.
гликолиза
носит название субстратного
фосфорилирования, поскольку макроэргические
связи возникают на молекуле окисляемого
субстрата. Если считать, что при распаде
АТФ из АДФ и Фн выделяется 30,6 кДж, то за
период гликолиза накапливается в
макроэргических фосфатных связях всего
61,2 кДж. Прямые определения показывают,
что распад молекулы глюкозы до
пировиноградной кислоты сопровождается
выделением 586,6 кДж. Следовательно,
энергетическая эффективность гликолиза
невелика. Кроме того, образуются 2
молекулы НАДН, которые вступают в
дыхательную цепь, что приводит к
дополнительному образованию АТФ.
Образовавшиеся две молекулы пировиноградной
кислоты участвуют в аэробной фазе
дыхания.
Аэробная фаза дыхания. Вторая фаза дыхания — аэробная—локализована в митохондриях и требует присутствия кислорода. В аэробную фазу дыхания вступает пировиноградная кислота. Общее уравнение этого процесса следующее:
![]() Процесс
можно разделить на три
основные стадии:
1) окислительное декар- боксилирование
пировиноградной кислоты; 2) цикл
трикарбоновых кислот (цикл Кребса); 3)
заключительная стадия окисления —
электронтранспортная цепь (ЭТЦ) требует
обязательного присутствия 02. Первые
две стадии происходят в матриксе
митохондрий, элекгронтранспортная цепь
локализована на внутренней мембране
митохондрий.
Процесс
можно разделить на три
основные стадии:
1) окислительное декар- боксилирование
пировиноградной кислоты; 2) цикл
трикарбоновых кислот (цикл Кребса); 3)
заключительная стадия окисления —
электронтранспортная цепь (ЭТЦ) требует
обязательного присутствия 02. Первые
две стадии происходят в матриксе
митохондрий, элекгронтранспортная цепь
локализована на внутренней мембране
митохондрий.
Первая стадия — окислительное декарбоксилированне пировиноградной кислоты. Общая формула данного процесса следующая:
![]()
Процесс этот состоит из ряда реакций и катализируется сложной мультифер- ментной системой пируватдекарбоксилазой. Пируватдекарбоксилаза включает в себя три фермента и пять коферментов (тиаминпирофосфат, липоевая кислота, коэнзим А — KoA-SH, ФАД и НАД). Вся эта система имеет молекулярную массу 4,0*10^6. В результате этого процесса образуется активный ацетат — аце- тилкоэнзим А (ацетил-КоА), восстановленный НАД (НАДН + Н+), и выделяется углекислый газ (первая молекула). Восстановленный НАД поступает в цепь переноса электронов, а ацетил-КоА вступает в цикл трикарбоновых кислот. Важно отметить, что пируватдегидрогеназная система ингибируется АТФ. При накоплении АТФ выше определенного уровня превращение пировиноградной кислоты подавляется. Это один из способов регуляции интенсивности протекания аэробной фазы.
Вторая стадия — цикл трнкарбоновых кислот (цикл Кребса). В 1935 г венгерский ученый А. Сент-Дьердьи установил, что добавление небольших количеств органических кислот (фумаровой, яблочной или янтарной) усиливает поглощение кислорода измельченными тканями. Продолжая эти исследования, Г. Кребс пришел к выводу, что главным путем окисления углеводов являются циклические реакции, в которых происходит постепенное преобразование ряда органических кислот. Эти преобразования и были названы циклом трнкарбоновых кислот или циклом Кребса. Сам исследователь за эти работы в 1953 г. был удостоен Нобелевской премии.
Общая схема цикла представлена на рисунке 70. В цикл вступает активный ацетат, или ацетил-КоА. Сущность реакций, входящих в цикл, состоит в том, что ацетил-КоА конденсируется с щавелевоуксусной кислотой (ЩУК). Далее превращение идет через рад ди- и трнкарбоновых органических кислот. В результате ЩУК регенерирует в прежнем виде. В процессе цикла присоединяются три молекулы Н20, выделяются две молекулы С02 и четыре пары водорода, которые восстанавливают соответствующие коферменты (ФАД и НАД). Суммарная реакция цикла выражена уравнением:

Отдельные реакции протекают следующим образом. Ацетил-КоА, конденсируясь с ЩУК, дает лимонную кислоту, при этом КоА выделяется в прежнем виде. Этот процесс катализируется ферментом цитратсинтазой. Лимонная кислота превращается в изолимонную. На следующем этапе происходит окисление изолимонной кислоты, реакция катализируется ферментом изоцитратде- гидрогеназой. При этом протоны и электроны переносятся на НАД (образуется НАДН + Н+). Для протекания этой реакции требуются ионы магния или марганца. Одновременно происходит процесс декарбоксилирования. За счет одного из атомов углерода, вступившего в цикл Кребса, первая молекула С02 выделяется. Образовавшаяся а-кетоглутаровая кислота подвергается окислительному декарбоксилированию подобно тому, которое разбиралось по отношению к пи- ровиноградной кислоте. Этот процесс также катализируется мультиферментным комплексом кетоглутаратдегидрогеназой, содержащим тиаминпирофосфат, липоевую кислоту, коэнзим А, ФАД и НАД. В результате за счет второго атома углерода, вступившего в цикл, выделяется вторая молекула С02. Одновременно происходит восстановление еще одной молекулы НАД до НАДН и образуется сукцинил-КоА. На следующем этапе сукцинил-КоА расщепляется на янтарную кислоту (сукцинат) и HS—КоА. Выделяющаяся при этом энергия накапливается в макроэргической фосфатной связи АТФ. Такой этап важен, так как выделяющаяся энергия непосредственно накапливается в АТФ. Этот тип образования АТФ, подобно ее образованию в процессе гликолиза, относится к субстратному фосфорилированию. Образовавшаяся янтарная кислота окисляется до фумаровой кислоты. Реакция катализируется ферментом сукцинатдегидрогеназой, про- стетической группой которого является ФАД. Одновременно выделяется третья пара водородов, образуя ФАДН2. На следующем этапе фумаровая кислота, присоединяя молекулу воды, превращается в яблочную кислоту с помощью фермента фумаратдегидрогеназы. На последнем этапе цикла яблочная кислота окисляется до ЩУК. Эту реакцию катализирует фермент малатдегидрогенеза, активной группой которого является НАД, и происходит выделение четвертой пары протонов — образуется НАДН + + Н+. Таким образом, ЩУК регенерирует в прежнем виде и может реагировать со следующей молекулой активного ацетата, поэтому практически ЩУК в процессе цикла не расходуется. Одновременно в ходе каждого цикла выделяются две молекулы С02 и образуются три молекулы НАДН + Н+ и молекула ФАД Н2. Многие реакции цикла Кребса обратимы. Важно также отметить, что образовавшиеся в рассмотренных реакциях органические кислоты могут служить материалом для построения аминокислот, жиров и углеводов. В этом случае они выводятся из цикла. Вместе с тем соединения, входящие в цикл, могут образовываться в ряде других реакций (например, при декарбоксилировании аминокислот) и вступать в цикл. Таким образом, рассмотренные превращения не отделены от других реакций метаболизма, а тесно с ними взаимосвязаны.
Для реакций цикла Кребса кислород не требуется. Кислород необходим для регенерации или окисления восстановленных коферментов (НАДН + Н+ и ФАД Н2). Количество окисленных форм этих коферментов ограничено. В анаэробных условиях, когда регенерация коферментов невозможна, они быстро оказываются исчерпанными и весь процесс прекращается. Окисление коферментов осуществляется в дыхательной цепи, или цепи переноса водорода и электронов. Конечным акцептором в этой цепи является кислород воздуха. Энергия, высвобождаемая при окислении коферментов, накапливается в макроэргиче- ских фосфатных связях АТФ.
Подводя итог, можно отметить, что в результате распада 1 молекулы ПВК в аэробной фазе (декарбоксилирование ПВК + цикл Кребса) выделяется ЗС02, 4 молекулы НАДН + Н+ и 1 молекула ФАДН2. Таким образом, 5 пар Н2, образующихся из ПВК и воды, поступают в дыхательную цепь.
Третья стадия — электровггранспортная цепь (ЭТЦ). В процессе окисления пи- ровиноградной кислоты в цикле Кребса образовались пары водорода 2Н, которые мы можем рассматривать как 2Н+ + 2е. Именно в таком виде они, акцептированные НАД и ФАД, передаются по цепи переносчиков. В процессе переноса протонов и электронов важную роль играют ферменты, относящиеся к классу оксидоредуктаз. Оксидоредуктазы, участвующие в дыхательной цепи, делятся на следующие основные группы. Пиридиновые дегидрогеназы, у которых коферментом служит НАД или НАДФ, отнимают два протона и два электрона от субстрата. При этом к коферментам присоединяются один протон и два электрона. Протон и один электрон связываются с атомом углерода в молекуле НАД, а второй электрон нейтрализует положительный заряд атома азота. Один протон выделяется в среду (рис. 71). НАД+ и НАДН хорошо растворимы в воде и присутствуют в цитоплазме и митохондриях. Коферменты НАД и НАДФ связаны с ферментом с помощью ионов металла и сульфгидрильных группировок. В зависимости от белкового носителя, к которому присоединен кофермент (НАД или НАДФ), различают более 150 пиридиновых дегидрогеназ. Каждая из них специфична по отношению к определенному субстрату. Необходимо учитывать, что НАД и НАДФ могут воспринимать протоны и электроны лишь в том случае, если субстрат имеет более отрицательное значение потенциала по сравнению с ними.

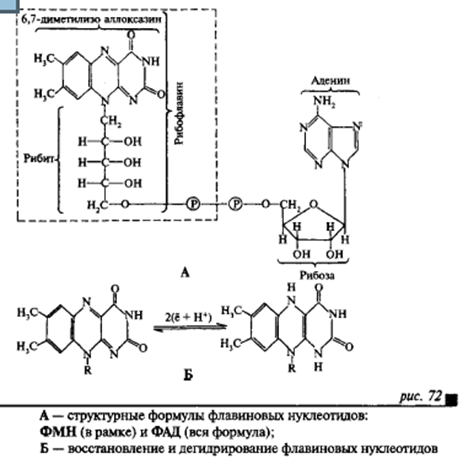
Флавиновые дегидрогеназы. Это также большая группа ферментов, катализирующая отнятие двух протонов и двух электронов от различных субстратов. Простетической группой этих ферментов служат производные витамина В2 (рибофлавин) — флавинадениндинуклеотид (ФАД) и флавин мононуклеотид (ФМН). Активной частью флавиновых дегидрогеназ служит иэоаллоксазиновое кольцо. В процессе восстановления именно к этой группировке присоединяется 2Н (2Н+ + 2е) (рис. 72). Простетическая группа у флавиновых дегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
Цитохромы. Простетическая группа цитохромов представлена железопорфи- ринами. Железопорфириновая группа (гем) в цитохромах прочно связана с белком через атомы серы аминокислоты цистеина. Известно около 20 цитохромов, которые делят на четыре главных класса: a, Ь, с, d, отличающихся между собой природой простетической группы: цитохромы а содержат железоформилпорфи- рины, цитохромы Ъ — железопротопорфирины, цитохромы d — железогидро- порфирины. В каждую группу цитохромов входит по нескольку различающихся между собой ферментов. Роль цитохромов заключается в переносе электронов. Содержащееся в цитохромах железо способно к обратимым окислительно-восстановительным реакциям. Воспринимая электрон, железо восстанавливается, теряя его, окисляется: Fe3+ ± е <-> Fe2+. В ЭТЦ митохондрий направление транспорта электронов определяется величиной окислительно-восстановительного потенциала цитохромов: цит.b ->цит.c1-> цит.с -> цит.аа3 -> O2. Непосредственно с кислородом воздуха может реагировать только цитохромоксидаза (цитохром аа3), которая кроме железа содержит атомы меди. Помимо перечисленных ферментов в переносе электронов по дыхательной цепи принимают участие кофермент Q и железосерные белки. Кофермент Q — это производное бензохинона, получившее название убихинон. Убихинон представляет собой кольцевую молекулу с двумя присоединенными к ней атомами кислорода, для которой возможны три состояния. В полностью окисленном состоянии или хиноновой форме оба атома кислорода связаны с кольцом двойными связями. Присоединение одного атома водорода к одному из атомов кислорода дает полухиноновую форму QH. В полностью восстановленной форме атомы водорода присоединяются к обоим атомам кислорода. Эта форма носит название гидрохиноновой — QH2 (рис. 73). Таким образом, кофермент Q может присоединять 2 протона и 2 электрона. Убихинон растворим в жирах и в связи с этим подвижен в липидной фазе мембран. Железосерные белки содержат FeS — это переносчики электронов подобно цитохромам. Содержащееся в них железо обратимо восстанавливается и окисляется.

Путь переноса протонов и электронов от одной молекулы переносчика к другой представляет собой окислительно-восстановительный процесс. При этом молекула, отдающая электрон или (и) протон, окисляется, а молекула, воспринимающая электрон или (и) протон, восстанавливается. Движущей силой транспорта электронов в дыхательной цепи является разность потенциалов. В связи с этим расположение отдельных переносчиков в дыхательной цепи, так же как и в цепи фотосинтетической, определяется величиной их окислительно-восстановительного потенциала (О/В). В начале цепи расположен НАД, обладающий наибольшей отрицательной величиной О/В потенциала (—0,32 В), а в конце—кислород с наиболее положительной величиной (+0,82 В). Остальные переносчики ФАД, КоQ цитохромы расположены между ними в порядке последовательного повышения потенциала. Это и позволяет электронам передвигаться по направлению к кислороду (наивысший положительный потенциал). Таким образом, роль ферментов дыхательной цепи состоит не только в выполнении каталитической функции, но, что особенно важно, в обеспечении упорядоченного
транспорта электронов от одного компонента к другому на кислород, что сопровождается запасанием энергии.
43. Дыхание как центральное звено обмена веществ. Значение дыхания в конструктивном метаболизме.Дыхание — это совокупность координированных последовательно протекающих экзергонических (греч. ekso — вне, снаружи; gon — происхождение) окислительно-восстановительных реакций, ведущих к освобождению энергии сложных органических веществ и фиксированию ее в богатых энергией связях АТФ, используемых клеткой для выполнения работы. Места синтеза АТФ — сопрягающие мембраны крист в митохондриях.
При дыхании органические вещества, прежде всего сахара (глюкоза), окисляются в результате дегидрирования (потери водорода), а углекислый газ образуется при декарбоксилировании органических кислот. Углекислый газ выделяется, а водород восстанавливает коферменты.
Кислород воздуха нужен для окисления восстановленных ко- ферментов, а не для самого дыхательного субстрата, он нужен как акцептор электронов, транспортируемых от восстановленных ко- ферментов. Углерод дыхательного субстрата не соединяется с кислородом воздуха.
Дыхание — поставщик энергии и восстановленных коферментов для работы клетки. При окислении восстановленных коферментов в дыхательной цепи образуется АТФ. Восстановленные коферменты могут быть донорами водорода для восстановительных реакций.
Энергия освобождается и при гидролизе полисахаридов, белков, но в значительно меньшем количестве. Для корней, клубней, незеленых частей стеблей дыхание является главным источником энергии.
Независимо от того, по какому пути идет расщепление углеводов, промежуточные продукты этого расщепления часто используются для синтеза других веществ, а не превращаются обязательно в углекислый газ и воду. Следовательно, дыхание одновременно является источником промежуточных веществ.
Дыхание — центральный процесс обмена веществ, объединяющий обмен углеводов, жиров и белков. Промежуточные продукты цикла Кребса, образующиеся в результате окисления глюкозы: а-кетоглутарат, фумарат, оксалоацетат — могут в результате восстановительного аминирования превращаться соответственно в глутамат, аланин или аспартат. Участие одних и тех же веществ в различных циклах делает возможным переключение с одного цикла на другой в зависимости от потребностей клетки. Некоторые промежуточные продукты гликолиза могут участвовать в темновой фазе фотосинтеза.
Поставляя в клетку АТФ, дыхание является регулятором процессов, идущих с затратой энергии, таких как поглощение и транспорт воды и солей, синтез и транспорт органических веществ. Чем быстрее происходят превращения веществ в цикле, тем больше может синтезироваться АТФ, тем быстрее пойдут указанные процессы.
Регуляторная роль дыхания хорошо видна при прорастании семян. Сначала при поглощении воды активируются ферменты пентозофосфатного окислительного цикла, увеличивается интенсивность дыхания, а уже потом начинает расти корешок. Интенсивность дыхания прорастающих семян в сотни раз больше, чем покоящихся. Для роста нужен строительный материал — органические вещества, а для их синтеза — АТФ и восстановленные кофер- менты.
Скорость образования АТФ и других макроэргических соединений влияет на интенсивность биосинтезов. Чем больше содержание ацетил-КоА, тем быстрее может идти синтез жиров. Существует тесная связь между активностью дыхательных ферментов, например цитохром-оксидазы, и синтезом хлорофилла.
Итак, главные функции дыхания — освобождение энергии, необходимой для работы клетки; образование промежуточных веществ, используемых для синтеза других соединений, и регуляция различных процессов.
В зеленых клетках одновременно происходят дыхание и фотосинтез. Если сравнить суммарные уравнения этих двух процессов:
![]() то
они кажутся противоположными.
то
они кажутся противоположными.
Однако в действительности между этими процессами много общего. Так, во время фотосинтеза и дыхания идет транспорт электронов, переносчики которых локализованы в мембранах. Транспорт электронов сопряжен с образованием АТФ, т. е. с превращением энергии. Дыхание и фотосинтез имеют одинаковые промежуточные вещества: ФГК, ФГА, рибулозу, ПВК, ФЕП, малат и др. Это говорит о возможности переключения с одного процесса на другой. И дыхание, и фотосинтез — это процессы окисления и восстановления, распада и синтеза веществ. Обязательным участником обоих процессов является вода.
Однако между дыханием и фотосинтезом существуют и различия. Фотосинтез происходит только днем, дыхание — круглосуточно. В процессе фотосинтеза образуются органические вещества, а в процессе дыхания они распадаются. Укорочение углеродной цепи при дыхании происходит в результате декарбоксилирования вещества, а для фотосинтеза характерна обратная реакция — карбокси- лирование. При фотосинтезе АТФ образуется за счет поглощенного света (фотосинтетическое фосфорилирование), при дыхании — за счет энергии, освобождающейся при окислении тех или иных веществ (субстратное и окислительное фосфорилирование). Конечные продукты фотосинтеза, например углеводы, являются дыхательным субстратом. Митохондриальный АТФ используется для реакций, протекающих в разных частях клетки; хлоропластный АТФ расходуется главным образом (97 %) на процессы, идущие в них самих.Фотосинтез — процесс уникальный, локализованный в зеленых клетках; дыхание — процесс универсальный, характерный для всех живых организмов Земли. Исключение составляет небольшая группа анаэробов.
Дыхание идет во всех живых клетках. Физиолого-биохимические механизмы дыхания являются общими для растений, животных, человека, для одноклеточных и многоклеточных организмов. Это лишний раз подтверждает мысль А. Сент-Дьсрдьи (Венгрия, 1960) о том, что жизнь при всем ее многообразии строится на небольшом количестве принципов.
Итак, несмотря на огромное многообразие растений и животных, населяющих нашу планету, способы добывания ими энергии одинаковы: фотосинтез, гликолиз, цикл Кребса, пентозофосфат- ный окислительный цикл. Это лишний раз подчеркивает единство происхождения органического мира. Гликолиз — анаэробный процесс — филогенетически, вероятно, был первым поставщиком энергии для клетки. Фотосинтез, появившись в эволюции позднее, обогатил атмосферу кислородом и стало возможным аэробное дыхание. Гликолиз идет в цитозоле и нуклеоплазме, для фотосинтеза и других процессов дыхания нужны мембраны. Следовательно, усложнение строения клетки шло одновременно с эволюцией способов добывания энергии.
44. История становления физиологии растений как науки. Физиология растений сначала развивалась как составная часть ботаники. Превращение ее в самостоятельную науку относят к 1800 г., когда швейцарским аббатом Ж. Сенебье была написана первая книга о жизни растения, названная им «Физиология растений». Отсюда пошло и название самой науки. Первые ученые для изучения жизни растений использовали наблюдения в естественных и искусственных условиях. Поскольку физиологи должны не просто описать идущие в организме процессы, а изучить их механизмы и взаимодействие, то необходимо не только простое наблюдение, но и проведение разных опытов. Физиология растений является экспериментальной наукой. Эксперимент — ее главный метод. Первый опыт был поставлен еще в 1600 г. голландцем Яном Ван Гельмонтом. Эксперименты проводили и проводят в естественных или искусственных условиях. Часто для проведения того или иного опыта растения специально выращивают в полевых условиях или в теплицах, оранжереях. В 1837 г. француз Ж.Б. Буссенго (1802—1887) разработал метод выращивания растений в специальных сосудах, заполненных почвой, песком или водой, в которые добавляли разные вещества. Этот метод получил название вегетационного.
Физиология растений возникла как наука о питании растений. Основные этапы ее развития в XIX в. связаны с изучением открытого в конце XVJI1 в. Д. Пристли, Я. Ингенгаузом фотосинтеза (Ж. Сенебье, Н.Т. Сосюр, Ж.Б. Буссенго, Ю. Сакс, Д. Майр, А.С. Фа- минцын, К.А. Тимирязев); выяснением значения листьев и корней как органов питания; установлением необходимости минеральных веществ для поддержания жизни; разработкой теории минерального питания растений (Н.Т. Сосюр, Ж.Б. Буссенго, И.А. Кноп, Ю. Сакс, Ю. Либих); обнаружением у растений дыхания, сходного с дыханием животных (Н.Т. Сосюр, Ж.Б. Буссенго, В.И. Палладии); началом изучения поступления, передвижения и выделения воды и растворенных веществ (Т. Найт); изучением раздражимости, движений растений (Т. Найт, Ч. Дарвин) и роста (Ю. Сакс). Превращению физиологии растений в самостоятельную науку в большой степени способствовали также успехи физики и химии. Физиологи стремились объяснить сложные жизненные процессы, сводя их к более простым, уже изученным физическим процессам и химическим реакциям. Однако для объяснения всей совокупности процессов, совершающихся в организме, необходимо, возможно, более полное знание их исторического прошлого. К.А. Тимирязев указывал, что свойства каждого организма создаются не только под влиянием настоящего, но и всего прошлого. В своей структуре и функциях вид отражает среду, в которой шло его формирование, а так как внешние условия изменяются, то для понимания особенностей физиологии данного вида нужно изучить его историю, т. е. применить исторический метод — изучить процесс во времени. Только исторические причины помогут объяснить нам, почему клетки должны быть насыщены водой; почему корни растут к почве, а побеги — от почвы; почему одни растения цветут, когда длинный день, а другие, — когда короткий. Следовательно, физиология растений должна рассматривать жизнь как результат длительного исторического развития, опираться на эволюционное учение. XX в. — время наиболее бурного и многостороннего развития физиологии растений. Если в XIX столетии в центре внимания физиологов находились вопросы воздушного и минерального питания, водного обмена и дыхания, то такие проблемы, как физиология клетки, рост, развитие, раздражимость, устойчивость к неблагоприятным факторам в то время только зарождались. Дальнейшее развитие физиологии растений связано с успехами смежных наук. В 30—50-х годах XX в. успешно развивались биохимия, цитология, генетика, совершенствовались их методы. Началось проникновение научной информации из этих смежных, более молодых наук в физиологию растений. Например, полученные биохимиками в 40 — 50-х годах данные о ферментных системах дыхания, фотосинтеза, азотного обмена, о принципах передачи энергии открыли перед физиологами новые возможности в исследовании этих процессов. С 50-х годов XX в. физиологи растений наряду со своими классическими методами (полевой и вегетационный, водная культура и т. д.) стали использовать в своих исследованиях методы этих наук. Первый из них — электронная микроскопия. С помощью электронного микроскопа, имеющего значительно большую разрешающую способность, чем световой микроскоп, детальнее изучили строение органелл. Еще один метод — дифференциальное центрифугирование — применили для выделения органелл. За вторую половину XX в. физиологией растений накоплен огромный материал по физико-химической организации, интеграции и регуляции функциональных систем и адаптации растительного организма. В 70-е годы стали расширяться контакты физиологии растений с генетикой и молекулярной биологией, что позволило изучить многие механизмы роста, развития растений, действие на эти процессы веществ регуляторного типа. Использование физико-химических методов привело к сближению во второй половине прошлого века физиологии растений, с одной стороны, и биохимии, биофизики, молекулярной биологии, генетики и микробиологии — с другой. Этот период можно назвать периодом ассимиляции. Он пришел на смену периоду обособления и продолжается до сегодняшнего дня. Физико-химические методы широко используются физиологами и в настоящее время. Однако применение этих методов в физиологии растений связано с рядом трудностей, так как они разрушают клетки, а физиологический объект должен оставаться живым.
России основателем физиологии и биохимии растений справедливо считается Андрей Сергеевич Фаминцын (1835–1918) – автор первого учебника (1887), создатель первой университетской кафедры и академической лаборатории физиологии растений (1889), которая в последующем была преобразована в Институт физиологии растений. А.С. Фаминцын основал ряд направлений в области эволюционной физиологии и биохимии растений. Наиболее известны его взгляды на симбиотическую эволюцию, единство принципов жизнедеятельности растительных и животных организмов.
(Татьяна Долгова)
