
- •Физика нефтяного и газового пласта
- •1. Природные коллекторы нефти и газа и их физические свойства
- •1.1. Газонефтяное месторождение
- •1.2. Виды неоднородности строения нефтяных залежей
- •1.3. Геометрические параметры горных пород-коллекторов
- •1.4. Фильтрационно-ёмкостные параметры коллекторов.
- •Параметры трещинной среды.
- •1.5. Насыщенность коллекторов
- •1.6 Проницаемость
- •1.7. Зависимость проницаемости от насыщенности коллекторов
- •1.8. Методы определения относительной проницаемости
- •2. Состав и физико-химические свойства нефти
- •2.1. Состав нефти
- •2.2. Классификация нефтей
- •2.3. Физико–химические свойства нефти
- •2.3.1. Плотность нефти
- •2.3.2. Вязкость нефти
- •2.3.3. Сжимаемость нефти
- •2.4. Различие свойств нефти в пределах нефтеносной залежи
- •Классификация природных газов
- •3.2. Основные параметры
- •2.2.1.Газовые законы
- •3.2.2. Параметры газовых смесей
- •3.2.3. Критические и приведённые термодинамические параметры
- •3.3. Уравнения состояния
- •3.3.1. Уравнения состояния природных газов
- •3.3.2. Обобщённое уравнение состояния
- •3.4. Физико-химические и теплофизические свойства природных газов
- •3.4.1. Вязкость
- •3.4.2. Качественная зависимость вязкости газов и жидкостей от температуры.
- •3.4.3. Теплоёмкость
- •3.4.4. Дросселирование газа. Коэффициент Джоуля-Томсона
- •3.4.5. Влажность природных газов
- •4. Фазовые состояния углеводородных систем
- •4.1. Схема фазовых превращений однокомпонентных систем
- •4.2. Фазовые состояния углеводородных смесей
- •4.3. Фазовые переходы в нефти, воде и газе
- •5 Пластовые воды
- •5.1. Физическое состояние воды в горных породах
- •1) Природы воздействующих на воду сил;
- •5.2 Физические свойства пластовых вод
- •5.3 Минерализация пластовой воды
- •5.4 Состояние остаточной (связанной) воды в нефтяных и газовых коллекторах
- •6. Поверхностно–молекулярные свойства системы пласт–вода–нефть–газ
- •6.1. Роль поверхностных явлений в фильтрации
- •6.2. Поверхностное натяжение
- •6.3. Смачивание и краевой угол
- •6.4. Работа адгезии и когезии, теплота смачивания
- •6.5. Кинетический гистерезис смачивания
- •7. Физические основы вытеснения нефти водой и газом из пористых сред
- •7.1. Силы, противодействующие вытеснению нефти из пласта
- •7.2. Схема вытеснения из пласта нефти водой и газом
- •7.3. Использование теории капиллярных явлений для установления зависимости нефтеотдачи от различных факторов
- •2.3.3. Сжимаемость нефти
Классификация природных газов
Природные газы подразделяют на три группы.
Газы, добываемые из чисто газовых месторождений. Они представляют собой сухой газ, практически свободный от тяжелых углеводородов.
Газы, добываемые вместе с нефтью. Это физическая смесь сухого газа, пропан - бутановой фракции (сжиженного газа) и газового бензина.
Газы, добываемые из газоконденсатных месторождений. Они состоят из сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых углеводородов, из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции. Кроме того, присутствуют N2, СО2, H2S, Не, Аr и др.
Искусственные газы получают из твердых топлив (горючие сланцы, бурый уголь) в газогенераторах, ретортах, тоннельных и прочих печах при высоких температурах, а иногда и при повышенных или высоких давлениях.
3.2. Основные параметры
2.2.1.Газовые законы
Термодинамическое состояние природного газа описывается в целом через средние параметры и компонент через парциальные параметры
Парциальные
параметры.
Парциальное
давление компонента смеси
![]() — давление, которое он бы имел при
удалении из объёма, занимаемого смесью
остальных компонент при неизменных
величинах начального объёма и температуры;
парциальный объем, компонента смеси
— давление, которое он бы имел при
удалении из объёма, занимаемого смесью
остальных компонент при неизменных
величинах начального объёма и температуры;
парциальный объем, компонента смеси
![]() — объём, который он бы имел при удалении
из объёма, занимаемого смесью, остальных
компонент при неизменных величинах
начального давления и температуры.
— объём, который он бы имел при удалении
из объёма, занимаемого смесью, остальных
компонент при неизменных величинах
начального давления и температуры.
Газовые законы. Связь между парциальными и средними параметрами устанавливается через следующие законы:
закон
Авогадро
— 1кмоль газа при нормальных условиях
(![]() мм
рт. ст.;
мм
рт. ст.;
![]() 0С)
занимает объём 22.41м3;
0С)
занимает объём 22.41м3;
закон Дальтона — аддитивности парциальных давлений :
![]() ; (3.1)
; (3.1)
закон Амаги — аддитивности парциальных объёмов :
![]() . (3.2)
. (3.2)
3.2.2. Параметры газовых смесей
Массовая доля — масса i-го компонента, отнесенная к общей массе системы:
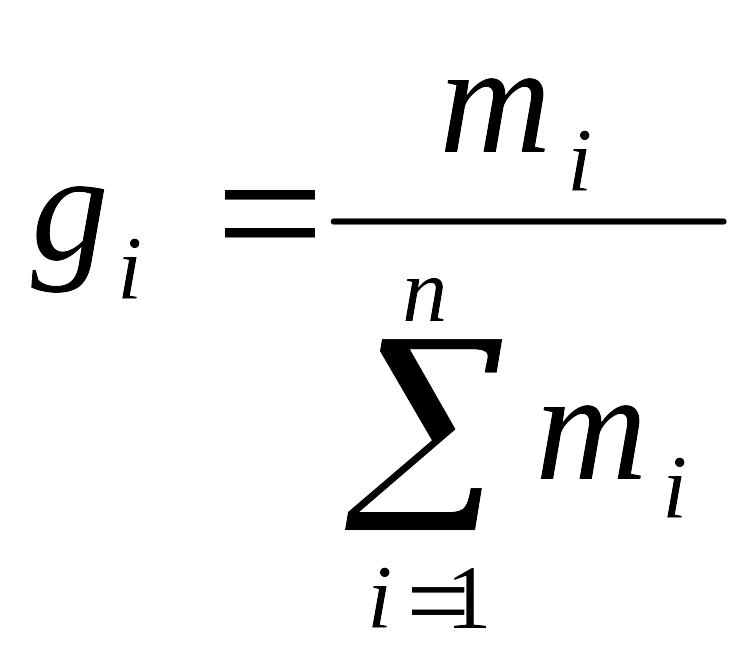 . (3.3)
. (3.3)
Молярная (мольная) доля – число молей i-го компонента, отнесенное к общему числу молей в системе:
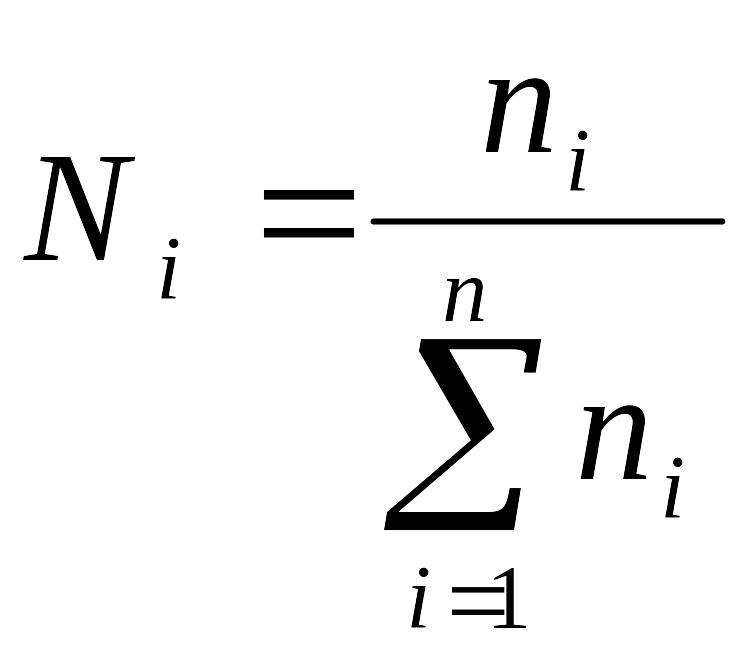 . (3.4)
. (3.4)
Моль – количество вещества в граммах, численно равное его молекулярной массе.
Число
молей
равно массе вещества
![]() ,
деленной на молекулярную массу
,
деленной на молекулярную массу
![]() :
:
![]() . (3.5)
. (3.5)
Тогда:
 . (3.6)
. (3.6)
О![]() бъемная
доля
– отношение объема i-го
компонента в системе к общему объему
системы:
бъемная
доля
– отношение объема i-го
компонента в системе к общему объему
системы:
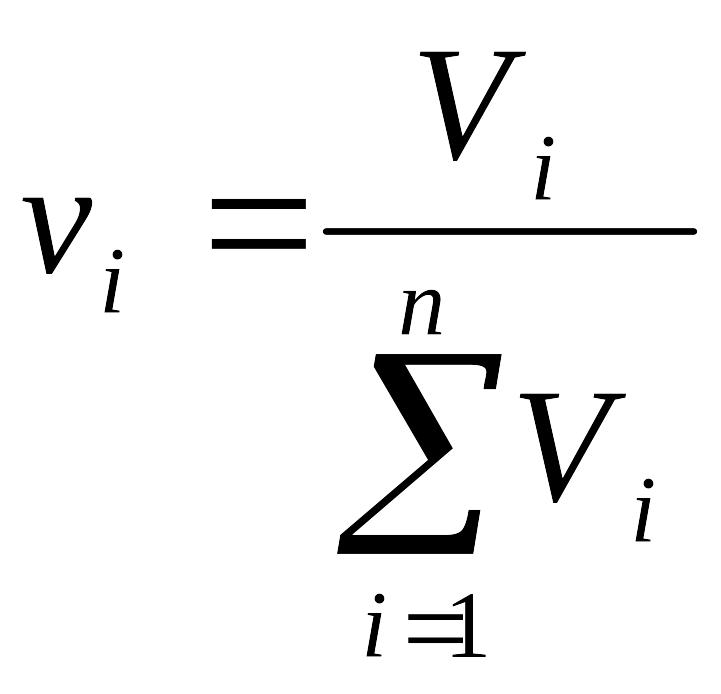 . (3.7)
. (3.7)
Т![]() огда:
огда: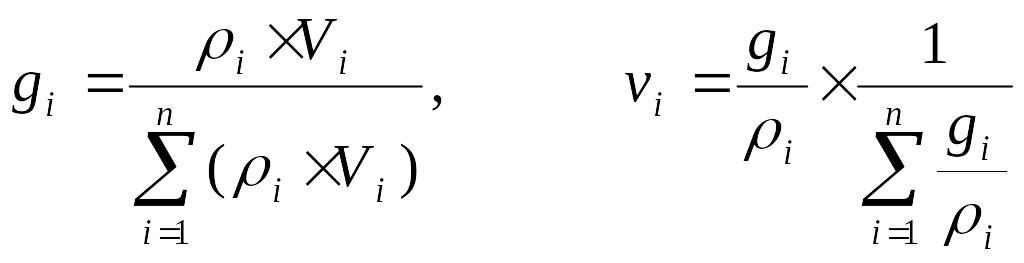 . (3.8)
. (3.8)
По закону Авогадро при одинаковых давлении и температуре 1 моль любого газа занимает одинаковый объем:
при Н.У. — 273 К и 0.101 МПа — 22.414 л,
при С.У. — 293 К и 0.101 МПа — 24.055 л,
отсюда для газовых смесей
![]() (3.9)
(3.9)
объемный состав является и молярным составом.
Средняя молекулярная масса газовой смеси может быть вычислена по составу:
![]() , (3.10)
, (3.10)
где
![]() или
или
![]() в долях единицы и
в долях единицы и
![]() , (3.11)
, (3.11)
где или в процентах.
Тогда весовая доля компонента:
![]() . (3.12)
. (3.12)
Кроме того:
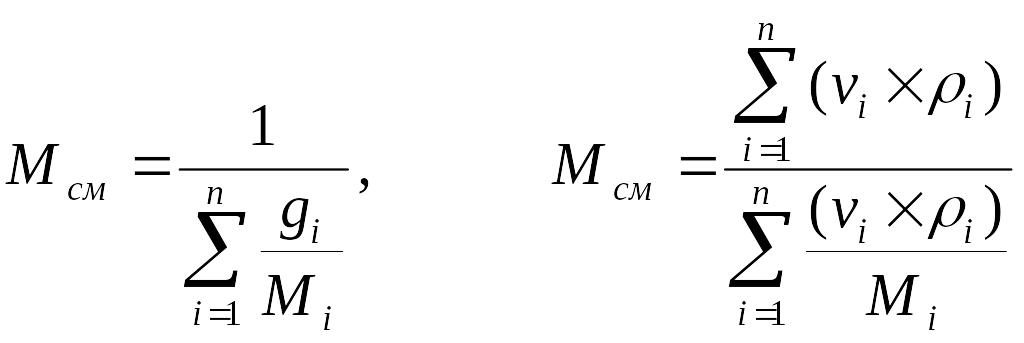 . (3.13)
. (3.13)
Плотность газовой смеси, как аддитивное свойство, можно рассчитать по составу газа и плотности каждого компонента:
![]() , (3.14)
, (3.14)
где
![]() или
или
![]() в долях единицы;
в долях единицы;
![]() — плотность компонента.
— плотность компонента.
Плотность компонентов газа можно взять из справочников или рассчитать через молярный объем — объем 1 моля газа:
при нормальных условиях (Н.У.):
![]() (3.15)
(3.15)
при стандартных условиях (С.У.):
![]() (3.16)
(3.16)
относительная плотность газа представляет собой отношение массы газа к массе такого же объема воздуха:
![]() , (3.17)
, (3.17)
где 1.293 и 1.205 плотность воздуха, кг/м3, при НУ и СУ, соответственно.
