
- •1.Основные понятия и законы химии
- •2.Основные понятия и законы химии
- •3.Основные понятия и законы химии
- •4.Основные понятия и законы химии
- •5.Основные понятия и законы химии
- •6.Строение и св-ва атомов
- •7.Строение и св-ва атомов
- •8.Строение и св-ва атомов
- •9.Строение и св-ва атомов
- •10.Строение и св-ва атомов
- •11.Химическая связь и строение молекул
- •12.Химическая связь и строение молекул
- •13.Химическая связь и строение молекул
- •14.Химическая связь и строение молекул
- •15.Химическая связь и строение молекул
- •16.Энергетика химических процессов
- •17.Энергетика химических процессов
- •18.Энергетика химических процессов
- •19.Энергетика химических процессов
- •21.Химическая кинетика и химическое равновесие
- •23.Химическая кинетика и химическое равновесие
- •24.Химическая кинетика и химическое равновесие
- •25.Химическая кинетика и химическое равновесие
- •27.Растворы. Дисперсные системы.
- •28.Растворы. Дисперсные системы.
- •29.Вопрос: Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •30.Растворы. Дисперсные системы.
- •31.Растворы. Дисперсные системы.
- •32.Растворы. Дисперсные системы.
- •33.Растворы. Дисперсные системы.
- •34.Растворы. Дисперсные системы.
- •35.Растворы. Дисперсные системы.
- •36.Растворы. Дисперсные системы.
- •41.Окислительно-восстановительные реакции. Электрохимические системы.
- •42.Окислительно-восстановительные реакции. Электрохимические системы.
- •43.Окислительно-восстановительные реакции. Электрохимические системы.
- •44.Окислительно-восстановительные реакции. Электрохимические системы.
- •45.Окислительно-восстановительные реакции. Электрохимические системы.
- •46.Окислительно-восстановительные реакции. Электрохимические системы.
- •47.Окислительно-восстановительные реакции. Электрохимические системы.
- •48.Окислительно-восстановительные реакции. Электрохимические системы.
- •49.Окислительно-восстановительные реакции. Электрохимические системы.
- •50.Окислительно-восстановительные реакции. Электрохимические системы.
- •51.Полимерные органические материалы
- •52.Полимерные органические материалы
- •53.Полимерные органические материалы
- •54.Полимерные органические материалы
- •55.Полимерные органические материалы
- •56.Полимерные органические материалы
- •57.Полимерные органические материалы
- •58.Полимерные органические материалы
10.Строение и св-ва атомов
Окислительно-восстановительные и кислотно-основные св-ва элементов и веществ.
О.В. св-ва.
Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а принимающий электроны - восстанавливается.
Если в результате реакции получается ионное соединение, то положительно заряженный ион образовался из того элемента, который отдал свои электроны, а отрицательный ион - из элемента, который электроны принял.
Например, натрий активно взаимодействует с хлором (внешне это напоминает горение с выделением белого дыма - очень мелких кристаллов NaCl). В образовавшейся соли Na+Cl– натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор - восстановился. Чуть позже мы объясним, как легче запомнить новые термины.
Благодаря передаче электронов от атома к атому многие ионы, образующиеся в таких реакциях, имеют электронную конфигурацию инертных газов. Приобретение устойчивых “завершенных” оболочек дает большой выигрыш в энергии. Такие одинаковые электронные оболочки ионов называются изоэлектронными.
Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле.
Степень окисления – это условный заряд атома в молекуле или кристалле. Его определяют, условно считая все полярные связи полностью ионнымии.
СТЕПЕНЬ ОКИСЛЕНИЯ выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении.
Есть несколько полезных правил, которые касаются степеней окисления:
1). Степень окисления атома любого элемента в свободном состоянии равна нулю.
2). Степень окисления любого простого одноатомного иона равна его заряду.
3). Степень окисления водорода в его соединениях с другими элементами равна +1.
4). Степень окисления кислорода равна -2 во всех соединениях, где кислород не образует простой ковалентной связи О—О.
5). Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю.
6). Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
К.О. св-ва.
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
![]()
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
![]()
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
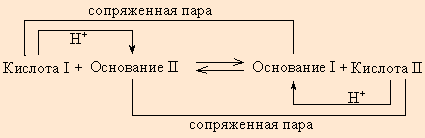
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
