
- •Часть 1
- •Одесса – 2004
- •Содержание
- •Введение
- •I. Механика
- •1. Кинематика материальной точки
- •1.1. Основные понятия кинематики
- •1.2. Нормальное и касательное ускорения
- •1.3. Движение точки по окружности. Угловые скорость и ускорение
- •2. Динамика поступательного движения
- •2.1. Законы Ньютона
- •2.2. Закон сохранения импульса
- •3. Работа и энергия
- •3.1. Работа
- •3.2. Связь между работой и изменением кинетической энергии
- •3.3. Связь между работой и изменением потенциальной энергии
- •3.4. Закон сохранения механической энергии
- •3.5. Соударения
- •4. Вращательное движение твёрдого тела
- •4.1. Кинетическая энергия вращательного движения. Момент инерции
- •4.2. Основной закон динамики вращательного движения
- •4.3. Закон сохранения момента импульса
- •4.4. Гироскоп
- •II. Механические колебания и волны
- •5. Общая характеристика колебательных процессов. Гармонические колебания
- •6. Колебания пружинного маятника
- •7. Энергия гармонического колебания
- •8. Сложение гармонических колебаний одинакового направления
- •9. Затухающие колебания
- •10. Вынужденные колебания
- •11. Упругие (механические) волны
- •12. Интерференция волн
- •13. Стоячие волны
- •14. Эффект Допплера в акустике
- •III. Молекулярная физика
- •15. Основное уравнение молекулярно-кинетической теории газов
- •16. Распределение молекул по скоростям
- •17. Барометрическая формула
- •18. Распределение Больцмана
- •Іv. Основы термодинамики
- •19. Основные понятия термодинамики
- •20. Первое начало термодинамики и его применение к изопроцессам
- •21. Число степеней свободы. Внутренняя энергия идеального газа
- •22. Классическая теория теплоёмкости газов
- •23. Адиабатный процесс
- •24. Обратимые и необратимые процессы. Круговые процессы (циклы). Принцип действия тепловой машины
- •25. Идеальная тепловая машина Карно
- •26. Второе начало термодинамики
- •2. Невозможен процесс, единственным результатом которого была бы передача теплоты от холодного тела к горячему.
- •27. Энтропия
- •V. Электростатика
- •28. Дискретность электрического заряда. Закон сохранения электрического заряда
- •29. Закон Кулона. Напряжённость электростатического поля. Вектор электрического смещения
- •30. Силовые линии. Поток вектора . Теорема Остроградского-Гаусса
- •31. Применения теоремы Остроградского-Гаусса для расчёта полей
- •32. Работа по перемещению заряда в электростатическом поле. Циркуляция вектора
- •33. Связь между напряжённостью поля и потенциалом
- •34. Электроёмкость проводников. Конденсаторы
- •35. Энергия электростатического поля
- •VI. Постоянный электрический ток
- •36. Основные характеристики тока
- •37. Закон Ома для однородного участка цепи
- •38. Закон Джоуля - Ленца
- •39. Правила Кирхгофа
- •40. Контактная разность потенциалов
- •41. Эффект Зеебека
- •42. Эффект Пельтье
22. Классическая теория теплоёмкости газов
Различают молярную теплоёмкость С (количество теплоты, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на 1 К) и удельную теплоёмкость (рассчитывается на единицу массы). Между молярной С и удельной С0 теплоёмкостью существует связь C=C0, где — молярная масса.
Для газа существенно, каким образом происходит его нагревание, поэтому различают:
теплоёмкость при изотермическом процессе

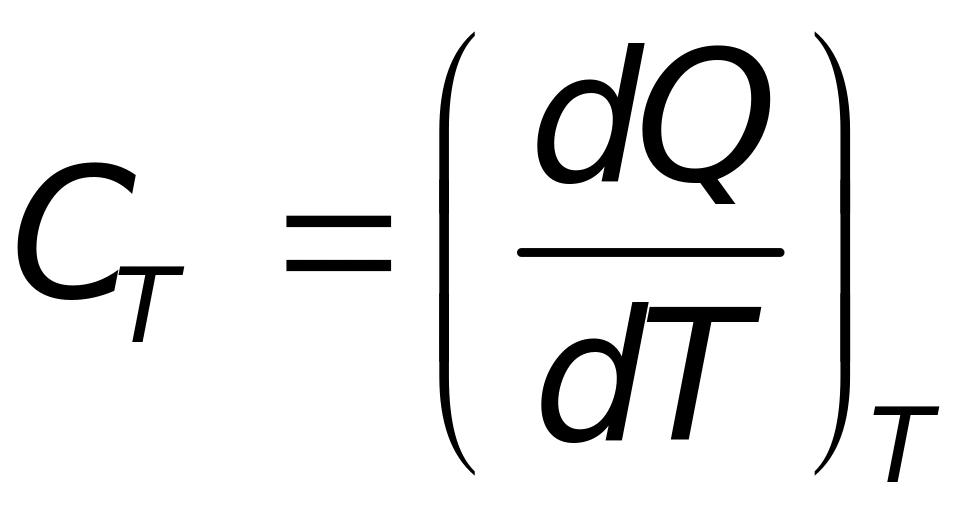 ;
;теплоёмкость при изохорном процессе
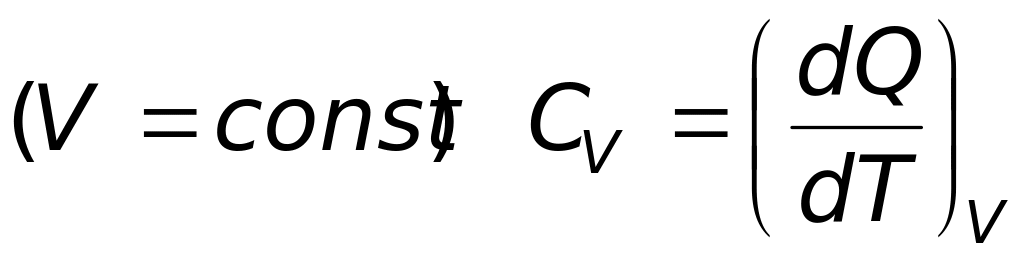 ;
;теплоёмкость при изобарном процессе
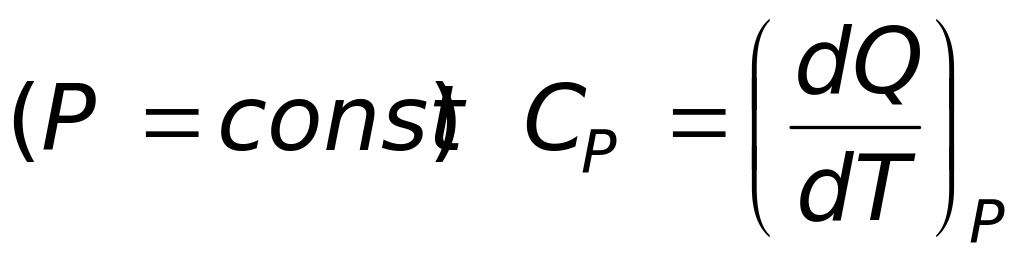 .
.
При изотермическом
процессе температура не меняется,
поэтому
![]() .
.
При изохорном процессе dQ=dU, так как работа в таком процессе не совершается, поэтому
|
(22.1) |
и, следовательно,
dU=CVdT. |
(22.2) |
Теплоёмкость при постоянном давлении
|
(22.3) |
Представим с помощью уравнения Менделеева-Клапейрона элементарную работу, совершаемую одним молем идеального газа при изобарном процессе в виде
dA=PdV=RdT. |
(22.4) |
Подставив (22.4) в (22.3), получим формулу Майера
CP = CV+R, |
(22.5) |
т.е. CP >CV на величину универсальной газовой постоянной.
Выразим теперь молярные теплоёмкости CV и CP через число степеней свободы. С учётом (2I.3), из (22.3) следует
|
(22.6) |
Зная CV, из формулы Майера находим
|
(22.7) |
Отношение
|
(22.8) |
называется коэффициентом Пуассона. Этот коэффициент с помощью (22.6) и (22.7) можно выразить через число степеней свободы
|
(22.9) |
Для одноатомного газа (i=3) = 1,67; для двухатомного (i=5) = 1.40; для многоатомного (i=6) = 1,33.
23. Адиабатный процесс
Адиабатным называется процесс, происходящий без теплообмена с окружающей средой.
В адиабатном процессе dQ = 0, поэтому первое начало термодинамики применительно к этому процессу принимает вид
dA + dU = 0; dA = -dU, |
(23.1) |
т.е. при адиабатном процессе газ совершает работу за счёт внутренней энергии.
С помощью (19.1) и (22.2) выражение (23.1) можно представить в виде
PdV = -CVdT. |
(23.2) |
Видно, что при адиабатном расширении (dV>0) dT<0, т.е. газ охлаждается. И, наоборот, при адиабатном сжатии (dV<0) dT>0, т.е. газ нагревается.
Выразим в (23.2) давление Р с помощью уравнения Менделеева – Клапейрона через другие параметры состояния и разделим в полученном уравнении переменные:
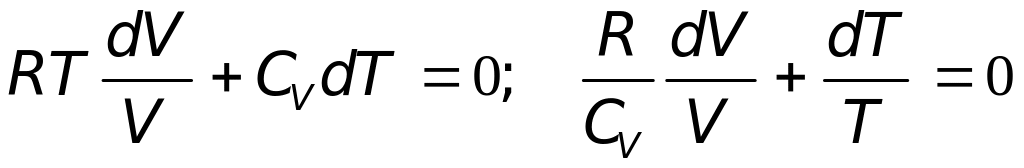 .
.
Поскольку R
= CP
- CV
, то
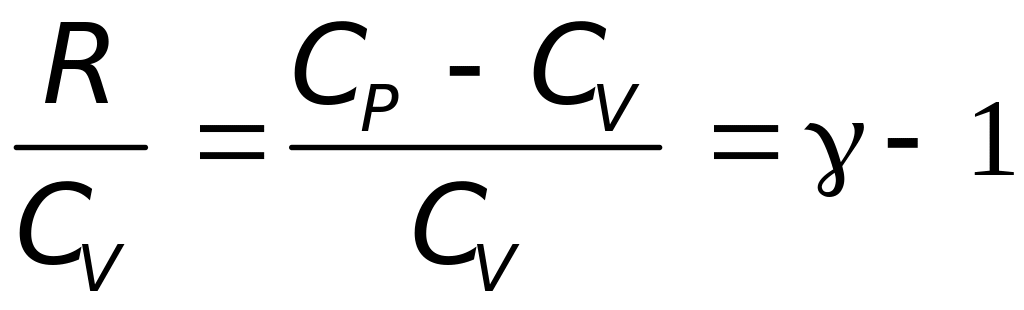 ,
,
поэтому
![]()
Проинтегрируем полученное уравнение:
Рис.
23.1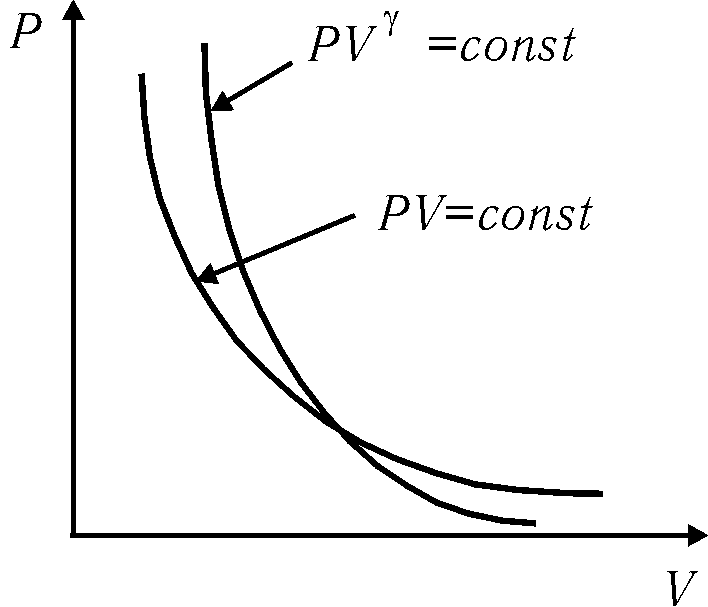
![]() .
.
Отсюда после потенцирования
|
(23.3) |
Это и есть уравнение адиабаты в координатах Т и V. Его можно записать в координатах P и V, если в (23.3) подставить температуру из уравнения Менделеева – Клапейрона:
|
(23.4) |
Поскольку >1, то график адиабаты выглядит круче изотермы — рис. 23.1.
