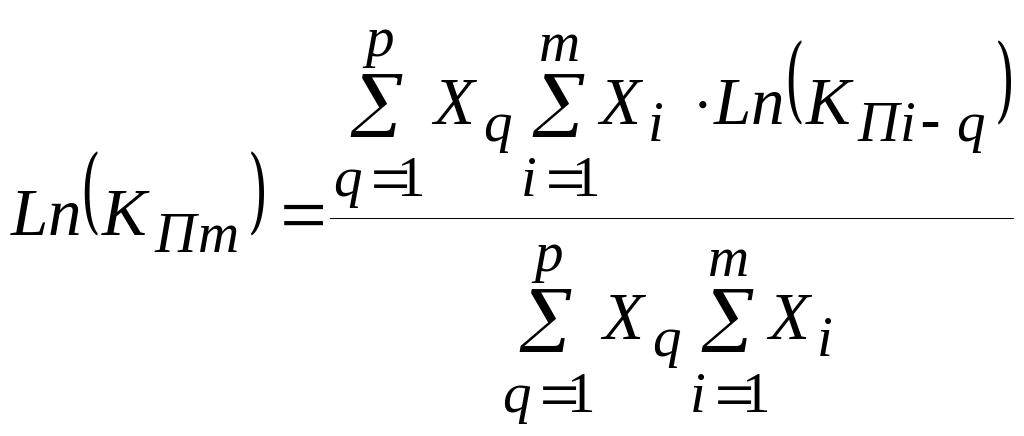- •Введение
- •1. Динамика рафинирования стали от примеси
- •2.Оценка равновесной концентрации водорода и азота в стали
- •3.Оценка равновесной концентрации серы в стали
- •4.Примеры расчетов
- •4.1.Десульфурация металла в открытом процессе
- •1) Постановка задачи
- •2) Исходные данные
- •3) Расчет
- •3.1) Расчет ионной доли анионов кислорода в шлаке
- •3.2) Расчет сульфидной емкости шлака
- •3.3) Расчет окислительного потенциала системы
- •3.4) Расчет коэффициента активности серы в металле
- •3.6) Расчет коэффициента распределения серы
- •3.7) Расчет равновесной концентрации серы
- •3.8) Расчет удельной мощности перемешивания
- •3.9) Расчет коэффициента объемного массопереноса
- •3.10) Расчет динамики десульфурации
- •4.2.Десульфурация металла при вакуум-шлаковой обработке
- •1) Постановка задачи
- •2) Исходные данные
- •3) Расчет
- •3.1) Расчет ионной доли анионов кислорода в шлаке
- •3.2) Расчет сульфидной емкости шлака
- •3.3) Расчет окислительного потенциала системы
- •3.4) Расчет коэффициента активности серы в металле
- •3.6) Расчет коэффициента распределения серы
- •3.7) Расчет требуемой кратности шлака
- •4.3.Удаление водорода при ковшевом вакуумировании
- •1) Постановка задачи
- •2) Исходные данные
- •3) Расчет
- •3.1) Расчет равновесной концентрации водорода
- •3.3) Расчет коэффициента объемного массопереноса
- •3.4) Расчет времени вакуумирования металла в ковше, необходимого для снижения содержания водорода до заданного уровня.
- •4.4.Удаление азота при ковшевом вакуумировании
- •1) Постановка задачи
- •2) Исходные данные
- •3) Расчет
- •3.1) Расчет равновесной концентрации азота
- •3.2) Расчет доли свободной поверхности
- •3.4) Расчет коэффициента объемного массопереноса
- •3.5) Расчет динамики удаления азота
- •Список использованных источников
2.Оценка равновесной концентрации водорода и азота в стали
О![]() ценка
равновесной концентрации водорода и
азота в металле основана на законе
Сивертса
ценка
равновесной концентрации водорода и
азота в металле основана на законе
Сивертса
, (12)
где [Г]равн – равновесная в данных термодинамических условиях
концентрация растворенного газа в металле;
![]() -
парциальное давление газа над металлом,
атм;
-
парциальное давление газа над металлом,
атм;
ɣГ – коэффициент активности газа в металле;
КГ – константа растворимости Сивертса, которая может быть рассчитана с использованием соотношений соответственно для водорода и азота
![]()
, (13)
![]()
. (14)
Коэффициент активности газа в металле определяется составом металла
![]() , (15)
, (15)
где
![]() -
параметры взаимодействия газа с
компонентами металла;
-
параметры взаимодействия газа с
компонентами металла;
[% i] – концентрации компонентов металла, %.
П![]() арциальное
давление газа определяется общим
давлением и долей газа в газовой фазе
арциальное
давление газа определяется общим
давлением и долей газа в газовой фазе
. (16)
А![]() зот,
в отличие от водорода, относится к
поверхностноактивным примесям и его
дегазация проходит через стадию адсорбции
в поверхностном слое. В связи с этим на
скорость удаления азота существенно
влияет наличие в металле других
поверхностноактивных примесей: серы и
кислорода, - которые могут блокировать
свободную поверхность границы раздела
фаз. В связи с этим при описании динамики
удаления водорода доля свободной
поверхности может быть принята равной
единице ( (1- θ) = 1), в то время как при
описании процесса удаления азота оценка
доли свободной поверхности производится,
используя выражение
зот,
в отличие от водорода, относится к
поверхностноактивным примесям и его
дегазация проходит через стадию адсорбции
в поверхностном слое. В связи с этим на
скорость удаления азота существенно
влияет наличие в металле других
поверхностноактивных примесей: серы и
кислорода, - которые могут блокировать
свободную поверхность границы раздела
фаз. В связи с этим при описании динамики
удаления водорода доля свободной
поверхности может быть принята равной
единице ( (1- θ) = 1), в то время как при
описании процесса удаления азота оценка
доли свободной поверхности производится,
используя выражение
, (17)
где aO , aS – активности кислорода и серы в металле;
FO , FS – коэффициенты поверхностной активности кислорода и серы
(при 1600 оС FO = 770 , FS = 620).
3.Оценка равновесной концентрации серы в стали
Оценить равновесную концентрацию серы в условиях распределения между металлом и шлаком можно, используя балансовое соотношение по сере (предполагая, что начальное содержание серы в шлаке равно нулю):
![]() , (18)
, (18)
где MMe , mшл – массы металла и шлака;
[S]нач – начальное содержание серы в металле, %;
[S]равн , (S)равн – равновесные концентрации серы в металле и шлаке после завершения процесса перераспределения, %.
Используя обозначения
![]() - коэффициент
распределения серы между металлом и
шлаком, доли единицы;
- коэффициент
распределения серы между металлом и
шлаком, доли единицы;
![]() - кратность шлака,
доли единицы;
- кратность шлака,
доли единицы;
д![]() ля
равновесного содержания серы может
быть получено соотношение
ля
равновесного содержания серы может
быть получено соотношение
. (19)
Соответственно, расчет кратности шлака, требуемой для получения заданного содержания серы в металле, может быть сделан с использованием выражения
![]()
. (20)
Кратность шлака, несомненно, является важным параметром шлакового режима и технологии в целом, однако возможности его изменения в реальных технологических условиях (особенно, внепечной обработки) существенно ограничены. Поэтому определяющее влияние на степень десульфурации оказывает величина коэффициента распределения серы между металлом и шлаком, которая может быть рассчитана по выражению:
![]()
, (21)
где СS – сульфидная емкость шлака;
![]() -
окислительный потенциал системы
«металл-шлак»;
-
окислительный потенциал системы
«металл-шлак»;
γ[S] – коэффициент активности серы в металле;
K[S] – константа равновесия реакции
½{S2} = [S] . (22)
![]()
(23)
Коэффициент активности серы в металле определяется составом металла
![]() , (24)
, (24)
где
![]() -
параметры взаимодействия газа с
компонентами металла;
-
параметры взаимодействия газа с
компонентами металла;
[% i] – концентрации компонентов металла, %.
Расчет сульфидной емкости шлака производится по соотношению:
![]() (25)
(25)
где
![]() - активность анионов кислорода в шлаке,
- активность анионов кислорода в шлаке,
![]() - константа
равновесия реакции десульфурации
- константа
равновесия реакции десульфурации
½{S2} + (O2-) = (S2-) + ½{O2} (26)
![]()
(27)
Активность анионов кислорода в шлаке отождествляется с ионной долей.
![]()
, (28)
При содержании в шлаке SiO2 меньше 10% расчет ионной доли анионов кислорода производится согласно модели совершенных ионных растворов. При больше содержании SiO2 расчет ионной доли производится в соответствии с представлениями полимерной модели оксидных расплавов по соотношению
![]()
, (29)
Обобщенную степень полимеризации рассчитывают, используя выражение
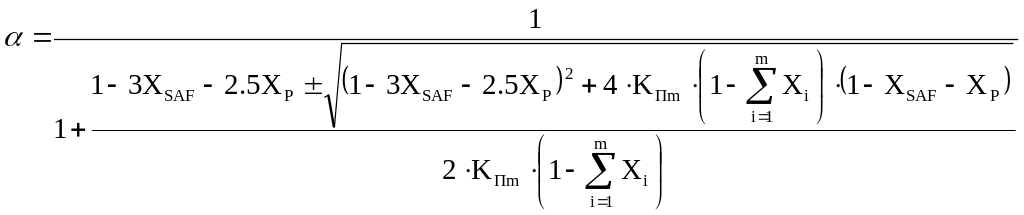
(30)
В соответствии с представлениями полимерной модели оксидных расплавов константа полимеризации многокомпонентного расплава КПm оценивается с использованием констант полимеризации КП i-q бинарных расплавов (в обозначении i – индекс основного оксида, q - индекс оксида элемента-комплексообразователя) по формуле:
|
(31) |
В соотношении используются мольные доли оксидов X, соответственно суммирование проводится по всем m основным оксидам и p оксидам элементов-комплексообразователей в расплаве. Современное состояние полимерной модели позволяет учесть вклад в общие свойства раствора четырех из них: Si, Al, Fe и P, причем комплексообразование с участием фосфора имеет свои особенности. В связи с этим используется величина мольной доли однотипных комплексообразователей (XSAF) и упрощенное обзначение (XP):
![]()
![]() . (32)
. (32)
В большинстве случаев, равновесное парциальное давление кислорода (и, соответственно, окислительный потенциал) рассчитывают, исходя из равновесия реакции
½{O2} = [O] (33)
По данным Петерсена и Чипмана температурная зависимость константы равновесия этой реакции определяется соотношением
![]() . (34)
. (34)
О![]() тсюда
тсюда
, (35)
![]()
. (36)
Это соотношение позволяет рассчитать окислительный потенциал системы, исходя из окисленности металла.
В условиях открытых процессов шлакового рафинирования величина «lg[O]» оценивается из равновесия с элементом – раскислителем и продуктами раскисления. Для раскисленной алюминием стали окисленность металла может быть определена, исходя из равновесия с алюминием
3[O] + 2[Al] = Al2O3 . (37)
![]()
(38)
![]()
(39)
Активность
продуктов раскисления
![]() отождествляется с активностью Al2O3
в рафинировочных шлаках и оценивается
в соответствии с представлениями
полимерной модели оксидных расплавов
по соотношению
отождествляется с активностью Al2O3
в рафинировочных шлаках и оценивается
в соответствии с представлениями
полимерной модели оксидных расплавов
по соотношению
![]() , (40)
, (40)
где
![]() ,
,![]() ,
,
![]() -
ионные доли
соответствующих ионов.
-
ионные доли
соответствующих ионов.
Ионную долю рассчитываем с учетом всех катионов, поступающих в шлак при диссоциации основных оксидов.
Ионная доля рассчитывается с использованием соотношения
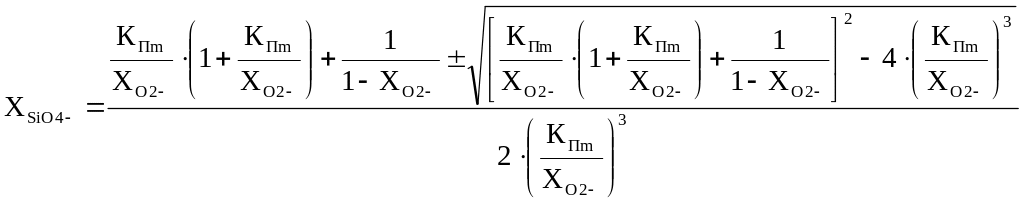
. (41)
В условиях вакуумных процессов (вакуум-шлаковое рафинирование) окислительный потенциал металла (lg[O]) оценивается по равновесию реакции
[O] + [C] = {CO} (42)
с использованием изотермы данной реакции
![]() , (43)
, (43)
где KC’ = 1/480 – константа равновесия обратной реакции.