
- •Міністерство охорони здоров’я України
- •Основи будови органічних речовин. Вуглеводні.
- •I модуль
- •Правила роботи і безпеки в лабораторії органічної хімії Загальні правила
- •Правила поводження з реактивами:
- •Робота з кислотами і лугами
- •Робота з шкідливими і отруйними речовинами
- •Робота з горючими речовинами
- •Робота з речовинами, що утворюють вибухові суміші
- •Правила поведінки при виникненні пожежі в лабораторії
- •Перша медична допомога при нещасних випадках
- •Зошит для лабораторно – практичних робіт.
- •Тематичний план лекційних та лабораторно -практичних занять Лекційний модуль I Змістовий модуль 1. Основи будови органічних речовин. Вуглеводні.
- •Лабораторно - практичний модуль I Змістовий модуль I. Основи будови органічних речовин
- •Шкала загальних самоосвітніх
- •Перелік тем і питань для самостійного вивчення в курсі органічної хімії
- •Література:
- •Форми контролю
- •Інструкція до практичного заняття № 1.
- •І. Контроль знань:
- •Іі. Хід роботи :
- •Ііі. Розв’язування вправ та завдань
- •І. Контроль знань:
- •Іі. Хід роботи ( див. Лабораторний практикум): ііі. Контрольні завдання :
- •Іv. Домашнє завдання :
- •Інструкція до лабораторного заняття № 3.
- •І. Контроль знань:
- •Іі. Хід роботи (див.Лаборатоний практикум): ііі. Контрольні завдання :
- •Іv. Домашнє завдання :
- •Інструкція до лабораторного заняття № 4.
- •І. Контроль знань:
- •Іі. Хід роботи (див. Лабораторний практикум): ііі. Контрольні завдання :
- •Іv. Домашнє завдання :
- •Інструкція до лабораторного заняття №5.
- •І. Контроль знань:
- •Іі. Хід роботи ( див. Лабораторний практикум): ііі. Контрольні завдання :
- •Іv. Домашнє завдання :
- •Інструкція до практичного заняття № 6
- •І. Контроль знань:
- •Іі. Хід роботи див.Лабораторний практикум): ііі. Контрольні завдання :
- •Іv. Домашнє завдання :
- •Перелік питань до підсумкового контролю модуля I
- •Методичні рекомендації щодо написання рефератів, доповідей.
- •При написанні роботи слід дотримуватися таких вимог:
- •Вимоги до оформлення робіт
Іі. Хід роботи (див.Лаборатоний практикум): ііі. Контрольні завдання :
Робота з індивідуальними картками.
Іv. Домашнє завдання :
Тема: Алкени, алкадієни, алкіни.
Література : 1. Черних В.П. та ін. Органічна хімія : Підручник для студентів вищих навчальних
закладів І-ІІ рівнів акредитації та учнів загальноосвітніх шкіл з класами
поглибленого вивчення хімії. / В.П.Черних, І.С.Гриценко, Н.М.Єлисєєва; – Х.:
вид-во НФаУ; Оригінал, 2004. с. 98 -145.
2. Черних В.П. Органічна хімія : У 3 кн.: Кн. 2. Вуглеводні та їх функціональні
похідні. /В.П.Черних, Б.С.Зименковський, І.С.Гриценко: (Підручник для
фармацевтичних ВУЗів та факультетів). - Х.: Вид-во «Основа» при Харк. ун-ті,
1993, с. 28 -68.
Інструкція до лабораторного заняття № 4.
Тема : Алкени, алкадієни.
Мета : вивчити будову, властивості і можливі шляхи застосування ненасичених вуглеводнів.
Література : 1. Черних В.П. та ін. Органічна хімія : Підручник для студентів вищих навчальних закладів І-ІІ рівнів акредитації та учнів загальноосвітніх шкіл з класами поглибленого вивчення хімії. / В.П.Черних,
І.С.Гриценко, Н.М.Єлисєєва; – Х.: вид-во НФаУ; Оригінал, 2004. с. 98 -145.
2. Черних В.П. Органічна хімія : У 3 кн.: Кн. 2. Вуглеводні та їх функціональні похідні. /В.П.Черних, Б.С.Зименковський, І.С.Гриценко: (Підручник для фармацевтичних ВУЗів та факультетів). - Х.: Вид-во «Основа» при Харк. ун-ті, 1993, с. 28 -68.
Реактиви: С2Н5ОН, Н2SO4 (конц.), розчини KMnO4, Na2CO3, бромна вода,
Посуд і допоміжне обладнання: пробірки, спиртівка, корки з газовідвідними трубками, пробіркотримачі, сірники.
Студент повинен знати :
Будову і властивості ненасичених вуглеводнів.
Способи добування алкенів, алкадієнів.
Основні галузі застосування ненасичених вуглеводнів.
Студент повинен уміти :
1. Писати формули ізомерів і називати їх за номенклатурою ІЮПАК.
2. Пояснювати властивості ненасичених вуглеводнів, виходячи з їх будови.
3. Писати рівняння реакцій, що підтверджують хімічні властивості алкенів, алкадієнів.
4. Порівнювати властивості насичених і ненасичених вуглеводнів.
5. Розв'язувати задачі на знаходження: молекулярної формули газоподібних органічних речовин на
основі їх густини, відносної густини і відомими масовими частками елементів, а також за масою,
об’ємом або кількістю речовин-продуктів її згоряння.
6. Ідентифікувати ненасичені вуглеводні.
ПЛАН :
Добування етилену і вивчення його властивостей.
І. Контроль знань:
Які вуглеводні називають ненасиченими? Алкенами? Алкадієнами?
Що таке π – зв’язок? Відмінність π - зв’язку від σ – зв’язку?
Порівняйте просторову будову алкенів, алкадієнів.
Яка ізомерія характерна алкенам, алкадієнам? Складіть ізомери для речовин складу С5Н10, С6Н12, та назвіть їх за номенклатурою ІЮПАК.
Напишіть структурні формули для речовин:
а) 4 – метил – 2 – пентен;
є) транс – 2 – пентен;
б) 2,4 – диметил – 2 – гексен;
ж) 1,4 – октадієн;
в) 2 – метил – 4 – хлор – 1 – пентен;
з) 2 – етил – 1,3 – пентадієн;
г) 5 – етил – 3 – гептин;
і) 2,5 – диметил – 2,4 – гексадієн;
д) ізопрену
к) 3 – вініл – 3 – метил – 1,4 – пентадієн;
Фізичні властивості алкенів, алкадієнів.
Розкрийте хімічні властивості етиленових, ацетиленових, дієнових вуглеводнів. Відповідь підтвердіть рівняннями хімічних реакцій.
Допишіть рівняння хімічних реакцій, назвіть вихідні речовини і продукти реакції за номенклатурою ІЮПАК:
а) Н3С – СН = СН2 + СІ2 → ;
ж) Н2С = С – СН = СН2 + НСІ → ;
І
СН3
б) Н3С – СН = СН2 + НВr → ;
з) n Н3С – СН = СН2 →;
в) Н3С – СН = СН – СН3 + Н2О →;
з) Н2С = СН – СН3 + [o]
 ;
;г) С7Н14 + О2 →;
і) Н2С = С = СН2 + Н2 →
д) Н3С – С = СН2 + [o]
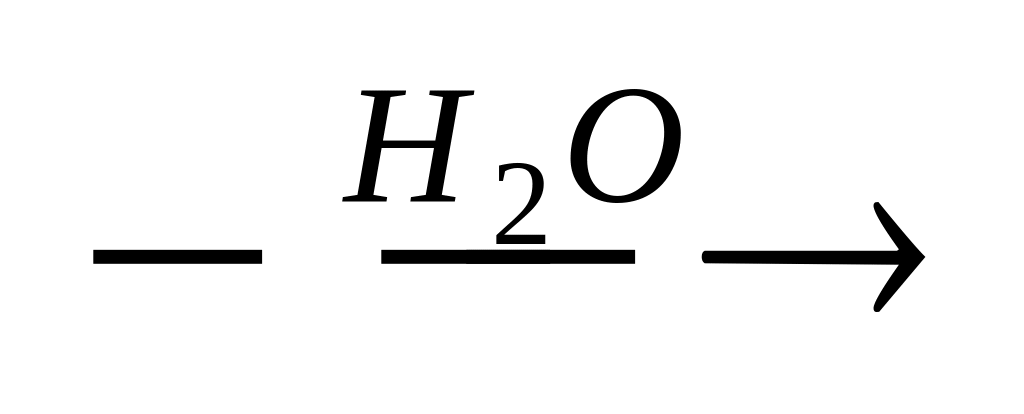 ;
;І
СН3
к) Н3С – СН = СН – СН3+О3→
ж) Н3С – СН = СН2 + НСІ → ;
л) С2Н4+ КМnO4 + Н2О →
Способи добування алкенів, алкадієнів.
Здійснити перетворення:
а) СН4 → СН3Вг → С2Н6 → С2Н4 → ( - СН2 – СН2 - )n;
→ СН3 – СН2 – ОН → С2Н4
б) С → СаС2
→ С2Н2
→ С2Н4
![]()
С2Н5Вг → СН3 – СН2 – СН2 – СН3;
в) СН4 → С2Н2 → С2Н6 → С2Н5СІ → СН3 – СН2 – СН3 → СН2 = СН – СН3 → СН3 – СООН .
г) етен → Х → бутан → У → бутен → дихлоробутан → бутин.
Де застосовують ненасичені вуглеводні?
Знайдіть формулу алкену, якщо 14г його приєднує 5,6л водню (н.у.) у присутності каталізатора.
При спалюванні 0,25моль невідомого вуглеводню утворилося 11,2л (н.у.) вуглекислого газу та 0,5 моль води. Встановіть молекулярну формулу невідомого вуглеводню.
При спалюванні 28мл газу утворилося 84мл карбон(ІV) оксиду та 67,5мг води. Густина газу за воднем дорівнює 21. Встановіть формулу газу. Об’єм газів виміряти за нормальних умов.
