
Прибавление многих высокомолекулярных веществ повышает устойчивость коллоидных растворов. Защитное действие выражается в повышении порога коагуляции. К числу наиболее эффективных защитных веществ относятся желатин, натриевые соли протальбиновой и лизальбиновой кислот, альбумин, казеин и др.
Способность ВМС к образованию адсорбционно-сольватных слоев на поверхности частиц называют защитным действием и широко используют в практике. Например, частицы кварца или металла, защищенного адсорбционным слоем белка, устойчивы, обратимы, и по своему поведению не отличаются от макромолекул белка. Вещество дисперсной фазы скрыто оболочкой, и частицы различного химического состава, защищенные одинаковыми оболочками, не различаются между собой по поверхностным свойствам. Это лежит в основе процессов микрокапсулирования.
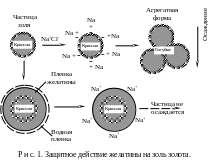
Механизм защитного действия сводится к тому, что защищающее вещество адсорбируется коллоидными частицами и образует на их поверхности защитный слой, который придает частицам свойства высокомолекулярных соединений. Это подтверждается тем, что защищенные золи ведут себя по отношению к электролитам так же, как защищающие их вещества. Валентность коагулирующего иона имеет сравнительно малое влияние на порог коагуляции, но последний зависит от гидратации ионов. Адсорбция защитного коллоида на защищаемой взвеси влияет на их электрокинетические свойства.
Для проявления защитного действия иногда достаточно добавления к коллоидному раствору очень небольшого количества высокомолекулярного вещества (доли процента).
Р. Зигмонди предложил количественный показатель защитного действия того или иного защитного коллоида – так называемое «золотое» число. Известно, что коллоидное золото весьма чувствительно к прибавкам электролитов, в высокодисперсном состоянии имеет красный цвет. При уменьшении степени дисперсности золь золота приобретает голубой цвет (рис. 1).
Золотое число выражается количеством миллиграммов защитного коллоида, достаточным, чтобы предотвратить изменение цвета 10 мл красного золя золота в голубой при прибавлении 1 мл 10%-ного раствора хлорида натрия.
Не существует систем с полным отсутствием взаимодействия между веществами дисперсной фазы и дисперсионной среды (даже в случае гидрофобных коллоидов – золей металлов). Ориентация молекул в сольватных слоях приводит к высокой вязкости, упругости, сопротивлению сдвигу – свойствам квазитвердых тел – и препятствует взаимопроникновению слоев при сближении частиц. Устойчивость дисперсных систем обеспечивается наличием термодинамических и кинетических факторов устойчивости.
Кинетическая устойчивость – свойство дисперсных систем удерживаться во взвешенном состоянии, не седиментируясь, а распределяясь по высоте в соответствии с гипсометрическим законом Лапласа – Перрена:
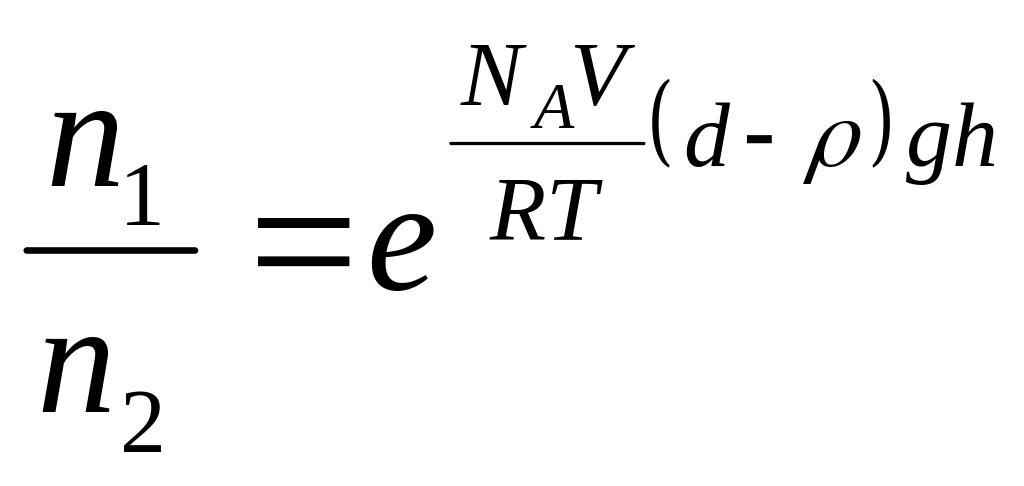 ,
,
где
![]() -
относительное изменение числа частиц
в единице объема в двух слоях жидкости,
отстающих на расстояние h
(слой 2 выше слоя 1); NA
– постоянная Авогадро; V
– объем отдельной частицы; d
- плотность частицы;
- плотность среды.
-
относительное изменение числа частиц
в единице объема в двух слоях жидкости,
отстающих на расстояние h
(слой 2 выше слоя 1); NA
– постоянная Авогадро; V
– объем отдельной частицы; d
- плотность частицы;
- плотность среды.
Агрегативная устойчивость коллоидных систем – способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем удерживать определенную степень дисперсности этой фазы в целом.
Наряду с кинетическими факторами, следует учитывать и термодинамические: необходимость затраты работы на преодоление упругих сил или на частичную десорбцию молекул сольватной оболочки при утончении зазора между частицами. При сближении частиц, окруженных полимерными слоями, происходит резкое понижение энтропии (а, следовательно, увеличение F) вследствие ограничения свободы движения сегментов цепей, в связи с перекрытием полимерных слоев.
Одним из важнейших кинетических факторов является структурно-механический, который обусловлен появлением защитных адсорбционно-сольватных слоев на поверхности мицелл (рис. 2).

Наибольшего развития достигают сольватные слои в результате адсорбции длинноцепочечных ПАВ и, в особенности, макромолекул ВМС. Большие размеры молекул, несущих собственные сольватные оболочки, создают на поверхности частиц адсорбционно-сольватные слои значительной протяженности и плотности. Устойчивость таких сильно лиофилизированных дисперсий близка к устойчивости лиофильных систем.
Многочисленные исследования свойств адсорбционно-сольватных слоев показали, что эти структуры следует рассматривать как двумерные квазикристаллические прослойки, а в случае адсорбции ВМС – как лиофильные пленочные студни. Такие слои обладают сопротивлением сдвигу и высокой вязкостью и не успевают «выдавиться» за короткое время столкновения частиц, образуя, таким образом, «структурно-механический барьер», препятствующий контакту частиц.
Вещества (ПАВ и ВМС), создающие структурно-механический барьер, называются стабилизаторами. Адсорбционные слои структурируются вследствие ориентации молекул и боковой когезии (в результате притяжения диполей полярных групп соседних молекул, образования водородных связей или гидрофобного взаимодействия неполярных групп). Прочность полимерных слоев увеличивается во времени (в отличие от слоев ПАВ), достигая предельного значения лишь через несколько часов, что обусловлено замедленной диффузией макромолекул и медленной ориентацией их на границе раздела фаз.
Макромолекулы белков и других полимеров развертываются в адсорбционном слое таким образом, что гидрофильные части обращены к водной фазе, образуя в ней свободные петли и складки сегментов цепей. Прочность таких белковых слоев на границе воды с углеводородом (эмульсии) на 2-3 порядка выше, чем на границе с воздухом (нерастворимые пленки). Это может быть объяснено более полной развертываемостью макромолекул и образованием большого числа макромолекулярных связей. Еще большей прочностью обладают смешанные пленки, образующиеся при введении малорастворимых ПАВ в адсорбционный слой желатина. Ориентация молекул ПАВ полярными группами в сторону желатина создает дополнительные контакты.
Влияние электрических зарядов на прочность макромолекулярных адсорбционных слоев оказывается более сложным, чем в случае сольватных слоев, образованных низкомолекулярными ПАВ или чистым растворителем. Повышение заряда (например, в результате диссоциации ионогенных групп макромолекул), усиливающее во всех случаях гидратацию, наряду с этим создает силы отталкивания между макромолекулами, уменьшая боковую когезию, а, следовательно, и прочность. В кислой и щелочной областях увеличение концентрации электролитов в растворе способствует упрочнению благодаря снижению эффективного заряда.
Таким образом, можно сознательно управлять прочностью адсорбционных слоев, а следовательно, и устойчивостью дисперсной системы, изменяя рН, концентрации ионов, вводя добавки ПАВ и т.д.
Необходимо отметить, что нарастание прочности по мере насыщения адсорбционного слоя приводит часто, после достижения некоторого оптимального значения, к резкому снижению стабилизирующего действия. Это понижение объясняется тем, что возникающие случайно разрывы сплошности не могут уже «самозалечиваться» из-за снижения подвижности макромолекулярного слоя, становящегося «хрупким».
Стабилизация, обусловленная особыми структурно-механическими свойствами адсорбционных слоев, может привести к практически безграничному повышению стабильности дисперсных систем вплоть до полного их фиксирования, образования сплошных пространственных структур - гелей.
 Таким
образом, адсорбционные макромолекулярные
слои являются весьма сильным фактором
стабилизации, обеспечивая устойчивость
дисперсной системы даже при очень
высоких концентрациях дисперсной фазы.
Наряду со структурно-механическими
свойствами (высокая вязкость и прочность),
стабилизирующее действие этих слоев
обусловлено и другими причинами. Так,
в зазоре между двумя частицами, окруженными
адсорбционно-сольватными слоями,
происходит увеличение концентрации,
а, следовательно, возникает осмотическое
расклинивающее давление.
Молекулярно-кинетическая природа
явления не ограничена ионно-электростатической
компонентой и придает ему универсальный
характер.
Таким
образом, адсорбционные макромолекулярные
слои являются весьма сильным фактором
стабилизации, обеспечивая устойчивость
дисперсной системы даже при очень
высоких концентрациях дисперсной фазы.
Наряду со структурно-механическими
свойствами (высокая вязкость и прочность),
стабилизирующее действие этих слоев
обусловлено и другими причинами. Так,
в зазоре между двумя частицами, окруженными
адсорбционно-сольватными слоями,
происходит увеличение концентрации,
а, следовательно, возникает осмотическое
расклинивающее давление.
Молекулярно-кинетическая природа
явления не ограничена ионно-электростатической
компонентой и придает ему универсальный
характер.
Взаимодействие между молекулами сольватной оболочки может изменить свойства адсорбционных слоев и их влияние на устойчивость дисперсных систем.
При определенной ориентации молекул сольватной оболочки возникает дополнительная сила отталкивания за счет одноименных зарядов полярных молекул. В результате возникает сила отталкивания 7, что нарушает структуру адсорбционного слоя, снижает его прочность и структурно-механические свойства (рис. 3).
Во многих случаях зависимость устойчивости (выраженной через какую-либо количественную характеристику, например ск), от количества добавленного «защитного» коллоида (ВМС) проходит через ясно выраженный минимум, т.е. устойчивость понижается при добавлении ВМС в количестве, недостаточном для защитного действия. Это явление, особенно характерное для линейных макромолекул, несущих полярные группы на обоих концах цепи (например поливиниловых спиртов), объясняется в настоящее время тем, что длинная молекула полимера присоединяется двумя концами к двум разным частицам дисперсной фазы, скрепляя их углеводородным мостиком. Этот вид коагуляции носит название флокуляции и приводит к образованию рыхлых хлопьевидных коагулянтов – флокул.
Добавка высокомолекулярных веществ не всегда повышает устойчивость золей. У некоторых коллоидных растворов они понижают пороги коагуляции и даже вызывают коагуляцию. Повышенная чувствительность коллоидного раствора к коагулирующим электролитам при добавлении ПАВ носит название сенсибилизации.
Снижение устойчивости гидрозолей особенно сильно выражено, когда коллоидные частицы и ионы защищающего вещества имеют различный знак заряда. Сенсибилизация может обусловливаться связыванием защитным веществом ионов, стабилизирующих коллоидные частицы (Н.П. Песков); в частности, этим можно объяснить сенсибилизацию золей гидроксида железа при добавлении казеина (связывание ионов железа казеином).
В процессе коагуляции высокодисперсного золя гидроксида железа образуются сравнительно небольшие по размерам седиментационно устойчивые агрегаты. Поэтому исследование коагуляции частиц Fe(OH)3 удобнее всего проводить с помощью турбидиметрического метода. Применимость этого метода основана на сильной зависимости интенсивности светорассеяния от размеров частиц. При коагуляции частиц она повышается, соответственной увеличивается оптическая плотность золя. Поскольку при прохождении светового потока через окрашенные золи часть света рассеивается, а часть поглощается, то при изучении коагуляции в таких системах методом турбидиметрии необходимо исключить поглощение света. Для золя Fe(OH)3 этого можно достичь, проводя измерения при = 480 нм.
Приборы и реактивы:
Фотоэлектрокалориметр (ФЭК-56М).
Коническая колба емкостью 250 мл.
Пробирки емкостью 20 мл.
Золь гидроксида железа ();
Раствор казеина;
Раствор электролита (Na3PO4, Na2SO4, CH3COONa);
Градуированная пипетка на 5 мл;
Бюретка.
Ход работы
Определение порога коагуляции золя.
1.1. В 10 пробирок налить золь, воду и электролит в следующих объемах:
Таблица 1
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Объем золя, мл |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Объем воды, мл |
10,0 |
9,0 |
8,5 |
8,0 |
7,5 |
7,0 |
6,5 |
6,0 |
5,5 |
5,0 |
Объем электролита Vэл, мл |
0 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
5,0 |
Оптическая плотность, D |
|
|
|
|
|
|
|
|
|
|
Электролит вводят в каждую пробу золя за 2-4 мин непосредственно перед измерением ее оптической плотности.
1 .2.
Измерить оптическую плотность золя в
каждой колбе с помощью фотоэлектроколориметра,
полученные данные записать в таблицу.
.2.
Измерить оптическую плотность золя в
каждой колбе с помощью фотоэлектроколориметра,
полученные данные записать в таблицу.
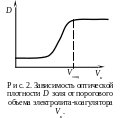
1.3. Построить график зависимости D = f(Vэл), по нему найти пороговый объем электролита Vк, вызывающие быструю коагуляцию золя.
1.4. Рассчитать значение ск по формуле
![]()
где сэл – концентрация электролита, моль/л;
Vк - пороговый объем электролита, мл;
V - объем золя, мл.
2. Определение защитного числа казеина.
2.1. В 10 пробирок налить золь и растворы в следующем объеме и последовательности:
Таблица 2
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Объем золя, мл |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
Объем воды, мл |
5 |
6 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
10 |
Объем раствора казеина Vст, мл |
5,0 |
4,0 |
3,5 |
3,0 |
2,5 |
2,0 |
1,5 |
1,0 |
0,5 |
0 |
Объем раствора электролита, мл |
В объеме, соответствующем Vк |
|||||||||
Оптическая плотность, D |
|
|
|
|
|
|
|
|
|
|
 Общий
объем проб должен быть одинаковым и
составлять 20 мл. Электролит-коагулятор
добавить через 10-15 минут после введения
казеина (для адсорбции казеина на
частицах золя). Оптическую плотность
золя измерить через 3-5 минут после
введения электролита. Измерения
производить при
= 480 нм (толщина кюветы 10 мм). Значения D
записать в таблицу 1.
Общий
объем проб должен быть одинаковым и
составлять 20 мл. Электролит-коагулятор
добавить через 10-15 минут после введения
казеина (для адсорбции казеина на
частицах золя). Оптическую плотность
золя измерить через 3-5 минут после
введения электролита. Измерения
производить при
= 480 нм (толщина кюветы 10 мм). Значения D
записать в таблицу 1.
2.3. Построить график зависимости D = f(Vст). Найти объем раствора казеина Vзащ, необходимый для предотвращения коагуляции золя.
2.4.
Рассчитать защитное число
![]() ,
,
где сст – концентрация раствора стабилизатора, г/л;
Vзащ –объем раствора стабилизатора, необходимый для предотвращения коагуляции золя, мл;
V – объем золя, мл.
