
- •Лабораторна робота №1
- •Теоретичні відомості
- •Довжини пробігу розчинника
- •Література
- •Лабораторна робота №2
- •Теоретичні відомості
- •Кількісне визначення концентрації білків.
- •Самостійна робота студентів
- •Визначення білку біуретовим методом
- •2.Визначення білку біуретовим методом по Ярош
- •3. Визначення білку за методом Лоурі
- •Література
- •Лабораторна робота №3
- •Теоретичні відомості
- •Самостійна робота студентів
- •Нанесення точок на хроматографічний папір
- •Лабораторна робота №4
- •Теоретичні відомості
- •Будова гема

Правила роботи в хімічній лабораторії
1. Одягти халати, підібрати довге волосся.
2. Підготувати робоче місце (звільнити стіл, не класти сумки на прилади ).
3. Робота з активними (кислоти, луги), леткими речовинами та розчинниками
проводиться в витяжній шафі.
4. Якщо на шкіру потрапила кислота – змити слабким розчином соди або
великою кількістю води.
5. Якщо на шкіру потрапив розчин лугу – змити слабким розчином оцтової
або лимонної кислоти.
6. Працювати на справних приладах.
Якщо прилад сипле іскрами, його необхідно відключити від електромережі або відключити струм на загальному щиті.
При пожежі викликати пожежників, скористатися вогнегасником, засипати вогонь піском або накрити ковдрою.
9.Після закінчення роботи помити посуд, прибрати на своєму робочому
місці.
10.Посуд та інструменти для проведення лабораторної роботи видаються
черговим за студенський білет, який повертається коли черговий здає
лаборанту чисто вимитий після проведення лабораторної роботи посуд.
11. Для лабораторних робіт необхідно придбати та підписати зошит на 18-20
аркушів. Протокол лабораторної роботи потрібно вести акуратно,
підрахунки та записи робити чітко та розбірливо.
12. Після проведення інструктажу розписатися в журналі за його проведення.
Цим підписом ви берете на себе відповідальність за дотримання техніки
безпеки в даній лабораторії.
Лабораторна робота №1
(4 години)
Тема: Правила роботи в лабораторії. Розділення амінокислот методом ТШХ на силуфолових пластинках.
Мета роботи: Вивчити хроматографічний метод розділення амінокислот з використанням розподільної хроматографії на силуфолових пластинках.
Теоретичні відомості
Хроматографія (хромо — колір, графо — пишу) це фізико-хімічний метод розділення рідких та газоподібних сумішей на складові.
Хроматографічний метод, описаний вперше М.С. Цвєтом у 1903 р., широко використовується в біохімії, мікробіології, а також у промис-ловості для одержання, очистки та ідентифікації органічних та неорганічних сполук. Він дає змогу розділяти та аналізувати складні суміші речовин, очищати їх від домішок, концентрувати та ідентифікувати речовини.
Всі хроматографічні системи складаються, як правило, з двох фаз: нерухомої, яка може бути твердою або рідкою, та рухомої, яка рухається по нерухомій фазі. Рухома фаза, в потоці якої переміщується суміш, що розподіляється, називається елюентом, а розчин, який виходить з шару нерухомої фази та містить розчинені компоненти суміші – елюатом.
Поведінка молекул в хроматографічних процесах визначається будовою та характером хімічних звязків між окремими атомами та групами, взаємодією частинок речовини що розділяється і фази, з якою ці частинки стикаються.
Хроматографічні методи класифікують за такими ознаками:
1. За агрегатним станом — газова, рідинна, газорідинна хроматографія;
2. За механізмом розділення — адсорбційна, іонообмінна, розподільна хроматографія.
3.За формою проведення процесу — колоночна, капілярна, площинна (паперова і хроматографія в тонкому шарі ХТШ).
Для характеристики поведінки зон речовин, що хроматографуються у паперовій хроматографії вводять величину хроматографічної рухомості Rf:
Хроматографічна рухомість (Rf) речовини в даній системі розчинників характеризується відношенням відстані між стартом (точкою нанесення речовини на хроматограму), положенням максимума концентрації в плямі речовини на хроматограмі і відповідним йому положенням фронту рідини, який необхідно зупинити на певній відстані від краю пластинки (фініш).
l (відстань, пройдена розчиненим компонентом (пляма амінокислоти)
Rf1 = ----------------------------------------------------------------------------------
L (відстань, пройдена фронтом розчинника)
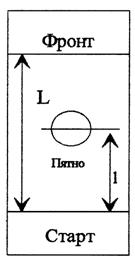
Рис. 1.1. Визначення Rf компонентів суміші: l — шлях, який долають компоненти суміші та розчинник (рухома фаза);
На величину Rf впливає наявність в речовині функціональних груп
(-СООН, -ОН, -NН2, -NO2, -H, -Cl), водневі звязки всередині молекули, що знижують розчинність речовин в воді та полярних розчинниках, температура плавлення, електролітична дисоціація, здатність до утворення комплексних сполук досліджуваної речовини, рН рухомої фази.
Розподільна хроматографія в тонкому шарі (ТШХ).
У цьому методі хроматографія відбувається в тонкому шарі сорбенту нанесеному на тверду інертну підкладку. Найбільшого поширення набули пластинки з підкладкою виготовлену з алюмінієвої фольги або полімеру. Частіше всього адсорбентом може бути сілікагель, оксид алюмінію, целюлоза, поліамід та ін. Для більш міцного закріплення адсорбента на жорсткій пластині-підложці використовують реагенти для звязування (гіпс, крохмаль, силіказоль та ін.). Суміш адсорбента з цим реагентом наносять на підложку дуже тонким слоєм (біля 100 мкм). Ми користуємося цим видом хроматографії для визначення амінокислот в суміші, що наноситься на силуфолову пластинку.
САМОСТІЙНА РОБОТА СТУДЕНТІВ
Ознайомитися з правилами роботи в лабораторії та технікою безпеки.
Підготувати силуфолову пластинку до хроматографії (відмітити лінію старту та точки 1, 2, 3, 4). Підписати.
Нанести розчини відомих амінокислот на точки 1, 2, 3 та розчин суміші невідомих амінокислот на точку 4.
Розмістити пластинку в камері з розчинником.
Визначити час початку та закінчення хроматографії.
Висушити хроматограму.
Проявити хроматограму.
Ідентифікувати плями амінокислот виявлені на силуфоловій пластинці.
Визначити амінокислоти, що входили до складу невідомої суміші.
10.Вирахувати хроматографічну рухомість (Rf ) окремих плям
амінокислот.
11.Зробити висновок (ідентифікувати склад суміші невідомих
амінокислот, Rf амінокислот, час хроматографії).
Реактиви:
Суміш розчинників н-бутанол, оцтова кислота, вода в обємному співвідношенні 4:1:5 (40 мл н-бутанолу, 10 мл оцтової кислоти, 50 мл дистильованої води) струшують протягом 1-2 хв. в ділильній воронці. Після розшарування нижній шар зливають, а верхній використовують як рухому фазу.
0,5%-й розчин нінгідрину в ацетоні (95 частин 0,5%-го розчину нінгідрину в ацетоні, 1 частина льодяної оцтової кислоти і 4 частини води) змішують безпосередньо перед визначенням.
0,03 М розчини різних амінокислот (наважку амінокислот, що відповідає 0,03 М розчину, розчиняють в 0,01 н соляній кислоті).
Розчини суміші амінокислот невідомої концентрації.
Матеріали та обладнання: силуфолові пластинки, дозатори з наконечниками, контейнери з кришкою для суміші розчинників, контейнери з кришкою для розчину нінгидрину, витяжна шафа, термостат або сушильна шафа, лінійка, олівець
Підготовка до проведення лабораторної роботи
На лабораторному столі знаходяться розчини амінокислот та розчини суміші невідомих амінокислот.
Студенти розділяються на бригади по 2 особи.
Кожна бригада одержує 3 розчини визначених для неї амінокислот та 1 невідому суміш кількох амінокислот.
1 бригада – Суміш №1
2 бригада – Суміш №2
3 бригада – Суміш №3
4 бригада – Суміш №4
5 бригада – Суміш №5
6 бригада – Суміш №6
7 бригада – Суміш №7
8 бригада – Суміш №8
9 бригада – Суміш №9
Лаборант видає кожній бригаді 1 силуфолову пластинку. Щоб запобігти забрудненню силуфолової пластинки її необхідно тримати за бокові грані.
Студенти проводять попереднє тренування в нанесенні води на звичайний папір за допомогою дозатора. Олівцем підписують пластинку (прізвище або № бригади).
Члени бригади беруть по 1 колбі з розчином амінокислоти, наносять їх на пластинку і повертають розчини на стіл.
Хід роботи
На силуфоловій пластинці олівцем відмічають лінію старту (1,5-2 см від нижнього краю пластинки) та 4 точки для нанесення стандартних розчинів окремих амінокислот та невідомої суміші.
-
лінія старту
___х____х____х____х____
1 2 3 4
Нанесення точок на силуфолову пластинку.
За допомогою мікропіпетки на відмічені точки наносять однаковий об'єм розчину кожної амінокислоти (по 1 краплі), причому кожну наступну краплину наносимо після просушування попередньої на повітрі. На точки 1, 2, 3 наносять розчини відомих амінокислот, а на точку 4 такий же обєм розчину суміші невідомих амінокислот, які в ході хроматографії не перекриваються на хроматограмі.
Після нанесення всіх розчинів амінокислот пластинку висушують на повітрі і розміщують в герметичному контейнері, на дно якого наливають шар розчинника (елюента) товщиною 0,5 см так, щоб нижній край пластинки був занурений на 1-1,5 см в розчинник. Верхній край пластинки закріплюють тримачем. Щоб уникнути випаровування елюента, хроматографію проводять в закритих камерах, що забезпечує рівновагу між рухомою рідкою фазою та її парами. Робота з органічними розчинниками проводиться у витяжній шафі. В якості рухомого розчинника використовується суміш н-бутанол —оцтова кислота—вода (4:1:5).
Відмічаємо час початку та закінчення хроматографії. Під час проведення хроматографії спостерігають за рухом фронту розчинника (розгонка). Хроматографія вважається закінченою, коли фронт руху розчинник знаходиться за 1-1,5 см від верхнього краю пластинки.
Після закінчення хроматографічного розділення амінокислот пластину дістають з контейнера, висушують на повітрі до наступного дня в чистій витяжній шафі при кімнатній температурі. Щоб визначити місцезнаходження невидимих плям амінокислот, тобто проявити пластинку, її обробляють реактивами, специфічними для речовин що розділяються. У випадку амінокислотних сумішей пластину занурюють на кілька секунд у кювету з 0,5 %-м розчином нінгідрину в ацетоні, просушують на повітрі і протягом 15 хвилин прогрівають для проявлення забарвлення в термостаті при 60 °С.
Після проявлення хроматограми плями амінокислот обмальовують олівцем, щоб зберегти місцезнаходження окремих амінокислот, ідентифікують плями відомих амінокислот та визначають амінокислотний склад невідомої суміші, порівнюючи положення окремих її плям з положенням стандартів.
Відносне положення амінокислот на хроматограмах, отриманих з суміші н-бутанол—оцтова кислота—вода, показано на малюнку 1.
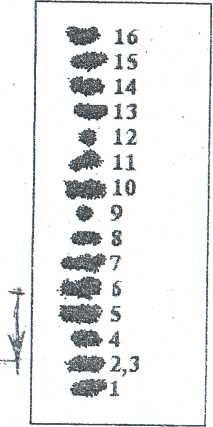
Малюнок 1. Відносне положення амінокислот на хроматограмах:
1 - цистин; 2 - лізин; 3 - гістидин; 4 - аргінін; 5 - аспарагінова кислота; 6- серин; 7 - гліцин; 8 - глутамінова кислота; 9 - треонін; 10- аланін; 11- пролін; 12 - тирозин; 13 - метіонін; 14 - валін; 15 - фенілаланін; 16 - лейцин (ізолейцин).
Вимірюючи відстань між лінією старту і центром плями кожної амінокислоти, знаходять величину хроматографічної рухомості Rf (відношення довжини пробігу кожної плями амінокислоти до довжини пробігу розчинника, яка вимірюється відстанню між стартовою лінією та лінією фінішу розчинника).
Довжини пробігу речовини
Rf = ------------------------------------------
