
- •Концепции современного естествознания
- •Введение
- •1. Естественнонаучная и гуманитарная культуры
- •1.1. Единство и взаимосвязь естественнонаучных и гуманитарных наук (культур)
- •1.2. Основные характерные черты естествознания
- •1.3. Структуры естественнонаучного познания
- •2. Этапы развития естественнонаучной картины мира
- •2.1. Картина мира античных философов
- •2.3. Современная картина мира
- •2.4. Иерархия материального мира
- •Расстояние млн св. Лет
- •Малое Облако (видимое с ребра)
- •3. Строение материи
- •3.1. Фундаментальные взаимодействия
- •3.2. Законы сохранения и превращения
- •3.3. Особенности микромира
- •3.3.1. Радиоактивность
- •3.3.2. Корпускулярно-волновой дуализм микромира
- •4. Процессы в веществе
- •4.1. Методы описания систем и процессов
- •4.1.1.Термодинамический метод описания систем и процессов
- •4.1.2. Первое начало термодинамики
- •4.1.3. Второе начало термодинамики
- •4.1.4. Статистическая природа второго начала термодинамики
- •4.2. Устойчивость, неустойчивость, бифуркация
- •5. Биологический уровень жизни
- •5.1. Основные понятия
- •5.2. Предмет биологии, ее структура и этапы развития. Критерий жизни
- •5.3. Структурные уровни живого
- •5.3.1. Молекулярно-генетический уровень
- •5.3.2. Клеточный уровень живого
- •5.3.3. Организменный уровень живых систем
- •5.3.4. Популяционно-видовой уровень
- •5.3.4. Биоценоз, биогеоценоз
- •6.3.6. Биосферный уровень. Ноосфера
- •5.4. Проблемы происхождения жизни
- •6. Науки о земле
- •6.1. Образование планет
- •6.1.1. Планеты земной группы
- •6.1.2. Планеты - гиганты
- •6.2. Строение Земли
- •6.3. Водная оболочка Земли (гидросфера)
- •6.4. Атмосфера
- •6.5. Климат Земли
- •Заключение
- •Библиографический список
4.1.2. Первое начало термодинамики
Первое начало термодинамики является математическим выражением закона сохранения энергии в замкнутой (изолированной) системе в случае, когда в ней имеют место механические и тепловые процессы.
В XVIII в. появилась первая формулировка первого начала термодинамики: «Вечный двигатель первого рода невозможен». Другими словами, была доказана невозможность создания механического вечного двигателя (устройства, с помощью которого можно было бы производить механическую работу без внешнего воздействия на него).
Первое начало термодинамики записывают в виде
Q
=
![]() U+A,
U+A,
где Q - количество теплоты, полученное (или отданное) системой;
А - работа, совершенная системой над внешней средой;
U- изменение внутренней энергии системы.
Под внутренней энергией системы понимают полный запас кинетической и потенциальной энергии данной системы. Сюда входят энергия движения частиц и молекул, из которых состоят макрочастицы, энергия взаимодействия атомов в молекулах и отдельных составляющих атомов частиц.
Математическая формулировка первого начала термодинамики: количество теплоты Q, полученное системой, идет на изменение (приращение) ее внутренней энергии и на совершение работы против внешних сил.
4.1.3. Второе начало термодинамики
Несмотря на всю важность и общность первого начала термодинамики, оно оказалось недостаточным для полного описания термодинамических процессов и систем.
Недостатками первого начала являются:
1. Теплота (Q), входящая в уравнение, не выражена через параметры системы.
2. Не указывается направление процессов, происходящих в системе, и условия достижения равновесного состояния.
Эти недостатки легко просматриваются на простом примере падения тела в поле силы тяжести (рис. 9).
Стр. 50
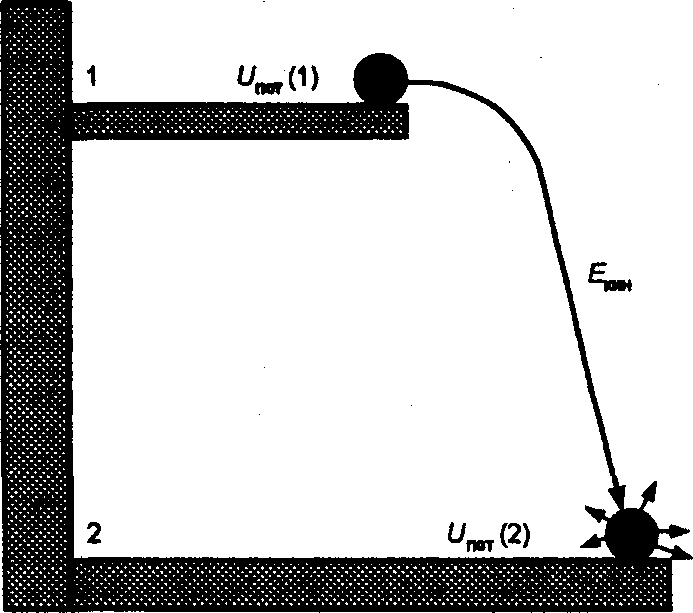
Рис. 9. Схема падения тела
При падении тела из положения 1 в положение 2 наблюдается переход потенциальной энергии в кинетическую. При резкой остановке тела в положении 2 кинетическая энергия переходит в тепловую энергию хаотического движения частиц тела, опоры, воздуха и в виде тепла рассеивается в окружающем пространстве. Первому началу термодинамики не противоречил бы и обратный процесс: тело в положении 2 отбирает энергию из окружающей среды, охлаждая ее, и переходит, имея запас энергии, в положение 1.
Хорошо известно, что многие процессы, происходящие в реальном мире, необратимы. Направленность тех или иных процессов и является объектом описания второго начала термодинамики.
Второе начало термодинамики было впервые сформулировано Р. Кла-узиусом (1850) как обобщение фактов, наблюдаемых при изучении процессов теплопередачи: «Теплота не может сама собой переходить от холодного тела к нагретому».
В 1854 г. Р. Клаузиус вводит понятие энтропии (S) - некоторой функции состояния, изменение которой при температуре Т определяется для изолированной системы соотношением
![]()
Стр. 51
При обратимых
процессах полное
изменение энтропии
![]() системы равно нулю. Однако если процесс
необратим, то изменение энтропии
больше нуля, т. е. энтропия в изолированных
системах при протекании необратимых
процессов возрастает (
системы равно нулю. Однако если процесс
необратим, то изменение энтропии
больше нуля, т. е. энтропия в изолированных
системах при протекании необратимых
процессов возрастает (![]() ).
).
Величина
![]() - количество теплоты, полученное или
отданное системой вследствие необратимых
процессов, протекающих внутри системы.
- количество теплоты, полученное или
отданное системой вследствие необратимых
процессов, протекающих внутри системы.
Отсюда если система
изолирована и находится в равновесном
состоянии, то
![]() ,
а следовательно, и
,
а следовательно, и
![]() Если же изолированная система находится
в неравновесном состоянии, то
Если же изолированная система находится
в неравновесном состоянии, то
![]() Значит, для изолированных систем с
помощью энтропии можно предсказать
направление самопроизвольных процессов
(они идут в сторону равновесного
состояния).
Значит, для изолированных систем с
помощью энтропии можно предсказать
направление самопроизвольных процессов
(они идут в сторону равновесного
состояния).
