Порядок проведения опыта Штерна.
Опыт проводился в следующей последовательности. По платиновой нити, располагающейся по оси малого цилиндра, пропускался электрический ток. Нить нагревалась практически до температуры плавления серебра Тп = 1234° К, и серебро начинало испаряться. Часть атомов серебра проходило сквозь щель. Отфильтрованные диафрагмой, далее они двигались по радиальным направлениям к внутренней поверхности большого цилиндра прямолинейно и равномерно со скоростью, соответствующей температуре платиновой нити. Стенка большого цилиндра охлаждалась так, чтобы попадающие на нее атомы «прилипали» к ней, образуя налет серебра в форме щели, но немного больших размеров. [17, С. 147].
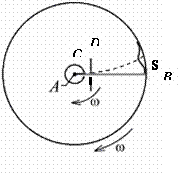
Сначала прибор покоился, и изображение щели на экране (латунной пластинке) приходилось как раз против нее самой (рис. 3). Затем прибор приводился в быстрое вращение вокруг собственной оси с частотой 1500 - 2700 об/мин и, результаты опыта существенно изменялись. Каждый атом по-прежнему двигался прямолинейно, но за время, которое требовалось атому, чтобы, пройдя щель, долететь до латунной пластинки, последняя успевала повернуться на некоторый угол, и атом уже прилипал к ней не точно против щели, а несколько в стороне [ там же](рис. 4).
Смещение полоски серебра при вращении установки позволяло определить величину скорости движения атомов серебра и сравнить ее со значением, полученным теоретическим путем.
Способ нахождения скорости атомов серебра был достаточно прост. Атом, двигаясь со скоростью υ, проходил расстояние:
![]()
где R и r – радиусы внешнего и внутреннего цилиндров, а τ – время прохождения этого расстояния.
Любая точка внешнего цилиндра за это время проходила путь:
|
|
|
|
Решая эти уравнения совместно, О. Штерн определил среднюю скорость движения атомов:

Измеряя значения ω, R, r и S можно рассчитать среднюю скорость движения атомов серебра при температуре нити – Тн. Меняя температуру накала нити можно найти температурную зависимость скорости теплового движения атомов.
|
Рис. 4. При вращении прибора по часовой стрелке налет серебра смещается.
Толщина налета серебра определялась в опыте О.Штерна оптическим методом.
Экспериментальный метод определения числа Авогадро - опыт Перрена
NA = (6,022045?0,000031)?1023, число молекул в моле любого вещества или число атомов в моле простого вещества. На заре развития атомной теории (1811) А.Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объемах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при стандартных температуре и давлении (0? С, 1,01?105 Па) равный 22,41383 л. Эта величина известна как молярный объем газа. Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й.Лошмидт; было установлено, что в 1 см3 идеального газа при нормальных (стандартных) условиях содержится 2,68675?1019 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул. Метод Лошмидта представляет только исторический интерес. Он основан на предположении, что сжиженный газ состоит из плотноупакованных сферических молекул. Измеряя объем жидкости, которая образовалась из данного объема газа, и зная приблизительно объем молекул газа (этот объем можно было представить исходя из некоторых свойств газа, например вязкости), Лошмидт получил оценку числа Авогадро 1022. Определение, основанное на измерении заряда электрона. Единица количества электричества, известная как число Фарадея F, - это заряд, переносимый одним молем электронов, т.е. F = Ne, где е - заряд электрона, N - число электронов в 1 моль электронов (т.е. число Авогадро). Число Фарадея можно определить, измеряя количество электричества, необходимое для растворения или осаждения 1 моль серебра. Тщательные измерения, выполненные Национальным бюро стандартов США, дали значение F = 96490,0 Кл, а заряд электрона, измеренный разными методами (в частности, в опытах Р.Милликена), равен 1,602?10-19 Кл. Отсюда можно найти N. Этот метод определения числа Авогадро, по-видимому, является одним из самых точных. Эксперименты Перрена. Исходя из кинетической теории, было получено включающее число Авогадро выражение, описывающее уменьшение плотности газа (например, воздуха) с высотой столба этого газа. Если бы удалось подсчитать число молекул в 1 см3 газа на двух разных высотах, то, воспользовавшись указанным выражением, мы могли бы найти N. К сожалению, сделать это невозможно, поскольку молекулы невидимы. Однако в 1910 Ж.Перрен показал, что упомянутое выражение справедливо и для суспензий коллоидных частиц, которые видны в микроскопе. Подсчет числа частиц, находящихся на разной высоте в столбе суспензии, дал число Авогадро 6,82?1023. Из другой серии экспериментов, в которых измерялось среднеквадратичное смещение коллоидных частиц в результате их броуновского движения, Перрен получил значение N = 6,86?1023. В дальнейшем другие исследователи повторили некоторые из экспериментов Перрена и получили значения, хорошо согласующиеся с ныне принятыми. Следует отметить, что эксперименты Перрена стали поворотным моментом в отношении ученых к атомной теории вещества - ранее некоторые ученые рассматривали ее как гипотезу. В.Оствальд, выдающийся химик того времени, так выразил это изменение во взглядах: "Соответствие броуновского движения требованиям кинетической гипотезы... заставило даже наиболее пессимистично настроенных ученых говорить об экспериментальном доказательстве атомной теории". Расчеты с использованием числа Авогадро. С помощью числа Авогадро были получены точные значения массы атомов и молекул многих веществ: натрия, 3,819?10-23 г (22,9898 г/6,02?1023), тетрахлорида углерода, 25,54?10-23 г и т.д. Можно также показать, что в 1 г натрия должно содержаться примерно 3?1022 атомов этого элемента.
Литература.
1. Карненков С. Х. «Основные концепции естествознания». – М.: Культура и спорт, ЮНИТИ, 1998.
2. Мигдал А. Б., Асламазов Л. Г. «Энциклопедический словарь юного физика». Москва: Педагогика, 1984.
3. Миронов А. В. «Концепции современного естествознания». – ПЗ Пресс, 2003.
4. Самыгин С. Н. «Концепции современного естествознания». – Ростов н/Д: «Феникс», 2003.
5. http://www.coolreferat.com/%D0%93%D0%B8%D1%80%D0%BE%D1%81%D0%BA%D0%BE%D0%BF