
- •1.1.Нарушения метаболизма гли.
- •1.2.Нарушения метаболизма цис
- •1.3. Нарушения метаболизма фен.
- •1.4. Нарушения метаболизма трп
- •1.5. Нарушения метаболизма гис
- •Виды гомеостаза:
- •Энергетический гомеостаз (роль глюкозы и жирных кислот как субстратов, инсулина и стг как регуляторов, понятие дневного и ночного типа энергетического обеспечения)
- •1.2. Репродуктивный гомеостаз (развитие и рост организма, половое созревание)
- •Адаптационный гомеостаз
- •2. Гиперлипопротеинемии – общая характеристика, типы, классификация.
- •3. Сфинголипидозы. Общие признаки заболевания. Классификация.
- •Показатели кислотно-основного состояния:
- •2. Гуморальный (белки системы комплемента, белки острой фазы) и клеточный (нейтрофилы, эозинофилы, базофилы, моноциты, естественные киллеры и тучные клетки) компоненты «неспецифического» иммунитета.
- •3. Клеточный компонент (нейтрофилы, эозинофилы, базофилы, моноциты, естественные киллеры и тучные клетки).
- •Семейство белков главного комплекса гистосовместимости.
- •Недостаточность дегидрогеназы глюкозо-6-фосфата может служить причиной гемолитической анемии.
- •Причинами гемолитической анемии могут быть нарушения структурных белков мембран.
- •Гемоглобин –главный белок цитозоля эритроцитов
- •Таласемии – болезни, вызываемые нарушениями синтеза цепей глобина.
2. Гуморальный (белки системы комплемента, белки острой фазы) и клеточный (нейтрофилы, эозинофилы, базофилы, моноциты, естественные киллеры и тучные клетки) компоненты «неспецифического» иммунитета.
«Неспецифический» иммунитет включает в себя несколько компонентов.
Гуморальный компонент (белки системы комплемента, белки острой фазы). Система комплемента представляет собой комплекс функционально связанных белков-ферментов, которые лизируют чужеродные клетки. Кроме того, система комплемента участвует в активации фагоцитов, процессах свертывания крови. Ферменты комплемента находятся в неактивном состоянии и активируются под действием различных внешних факторов. Имеется два основных пути активации системы комплемента: классический и альтернативный. Наличие антител против какого-либо антигена является основанием для активации комплемента и осуществляется по классическому пути. Альтернативный путь не связан с иммунными реакциями. Он реализуется до синтеза соответствующих антител и является неспецифическим механизмом защиты организма от бактерий или вирусов.
Белки острой фазы. Неспецифическую резистентность организма обеспечивают также белковые структуры, которые получили название белки острой фазы.
К ним относятся интерферон, фибронектин, лизоцим, С-реактивный белок, а2-макроглобулин. Они участвуют в различных механизмах, направленных на уничтожение чужеродных клеток. Например, С-реактивный белок связывается с бактериальной мембраной в сайте фосфохолина, что вызывает активацию системы комплемента.
3. Клеточный компонент (нейтрофилы, эозинофилы, базофилы, моноциты, естественные киллеры и тучные клетки).
Клеточный компонент включает большую часть белых клеток крови:
1) лейкоциты (гранулоциты), к которым относят нейтрофилы (полиморфно-ядерные клетки), составляющие 90—95% от всех лейкоцитов, эозинофилы (3—5%) и базофилы (0,5—1%);
2) моноциты и продукты их дифференцировки в тканях — макрофаги;
3) NK-клетки (естественные киллеры) — один из типов лимфоцитарных клеток;
4) тучные клетки.
Все клетки крови развиваются из полипотентных стволовых клеток, но в процессе дифференцировки приобретают специфическое строение и функциональные свойства.
Нейтрофилы и моноциты (макрофаги) могут фагоцитировать бактерии и грибы, поэтому их называют фагоцитами.
Эозинофилы участвуют в борьбе с многоклеточными паразитами (например, гельминтами), базофилы и тучные клетки вовлечены в развитие воспалительной реакции, они выделяют медиаторы воспаления (гистамин, серотонин, лейкотриены и т.д.). Благодаря действию медиаторов развиваются основные механизмы воспаления. NK-клетки осуществляют иммунологический надзор за опухолевыми клетками и клетками, инфицированными вирусами, обнаруживают их и уничтожают.
4. Фагоцитарные клетки. Типы фагоцитарных клеток. Образование фагосомы. Биохимические принципы фагоцитоза.
Способность некоторых клеток крови к фагоцитозу – одна из защитных функций крови. В фагоцитозе участвуют 2 типа лейкоцитов – нейтрофилы и моноциты (макрофаги). Одним из механизмов разрушения чужеродных клеток является использование кислородных радикалов. В макрофагах активируется глюкозо-фосфатный шунт, увеличивается выход NADFH на фоне повышенного потребления кислорода. Образовавшиеся синглетный кислород и супероксид являются мощными антибактерицидными агентами. Эффект усиливается за счет сочетанного действия активного кислорода, миелопероксидазы и атомов галогенов. Кислороднезависимая цитотоксичность связана с действием кислых гидролаз и лизоцима макрофагов, а также специальных катионных белков, способных разрушать бактериальную мембрану.
Образование фагосомы начинается с взаимодействия специфических рецепторов фагоцитов с бактериями или комплексом антиген-антитело. Активированный рецептор передает сигнал в клетку с участием инозитолфосфатной системы. Фагоцитарный ответ клетки включает формирование фагосомы, слияние ее с лизосомой, образование фаголизосомы, активацию кислородзависимых бактерицидных механизмов уничтожения микробов и выработку клетками токсичного для микробов оксида азота, а также действие кислороднезависимых механизмов уничтожения микроорганизмов.
Особенности энергетического метаболизм нейтрофилов. Понятие «Респираторного взрыва». Изменение окислительно-восстановительного и энергетического статуса нейтрофилов. Дефекты метаболизма отдельных ферментов. Нарушения активности ферментов участвующих в образовании активных форм кислорода (миелопероксидазы, NADPH-оксидазы). Недостаточность глюкозо-6-фосфат дегидрогеназы.
Особенности энергетического метаболизм нейтрофилов. Энергия, необходимая нейтрофильным гранулоцитам для осуществления их функций, получается преимущественно путем анаэробного гликолиза, поэтому они способны активно функционировать в тканях, бедных кислородом: воспаленных, отечных или плохо кровоснабжаемых. Они сохраняют активность в очагах воспаления и при низких значениях рН. Источником энергии нейтрофилов служат поглощаемая извне глюкоза и внутриклеточные запасы гликогена, которые быстро истощаются при стимуляции – в ходе фагоцитоза и переваривания микробов.
"Респираторный взрыв" – быстро развивающаяся (начиная с первой минуты) метаболическая реакция, сопровождающая фагоцитоз. Она характеризуется резким усилением окислительных процессов в нейтрофильных гранулоцитах (с увеличением потребления ими кислорода в 10–15 раз). Эта реакция обусловлена активацией, преимущественно, немитохондриальных ферментов, расположенных в плазмолемме и мембранах фагосом, и сопровождается образованием токсических реактивных биоокислителей (метаболитов кислорода). Реакции образования активных форм кислорода катализируются ферментным комплексом мембраны фагосом – NADFH-оксидазой (образует супероксидный анион О2- ) и супероксиддисмутазой (образует Н2О2).
Биоокислители (перекись водорода, синглетный кислород, супероксидный и гидроксильный радикал) образуются в гиалоплазме при респираторном взрыве и транспортируются в фаголизосому. В последней миелопероксидаза катализирует реакцию взаимодействия перекиси водорода с ионами хлора, образуя мощное бактерицидное вещество гипохлорит.
Изменение окислительно-восстановительного и энергетического статуса нейтрофилов вызвано дефектами метаболизма отдельных ферментов. Наиболее часто встречаются нарушения функций ферментов, участвующих в образовании активных форм кислорода (миелопероксидазы, NADPH-оксидазы).
NADPH-оксидазная недостаточность. Один из основных функциональных дефектов нейтрофилов и моноцитов связан с недостаточностью гексозомонофосфатного шунта, который увеличивает выход NADFH на фоне повышенного потребления кислорода при респираторном взрыве.
Различают несколько генетически обусловленных форм данного нарушения. Однако функциональные дефекты, которые проявляются со стороны респираторного взрыва нейтрофилов, не отличаются при различных формах.
Недостаточное количество NADFH не позволяет образовываться О2- . Главным ферментом респираторного взрыва является NADFH-оксидаза. Этот фермент состоит из 4 субъединиц. Дефект в любой субъединице этого фермента, как и недостаточное количество NADFH приводит к развитию хронического гранулематоза и неспособности нейтрофилов генерировать респираторный взрыв.
Недостаточность глюкозо-6-фосфатдегидрогеназы. Передается по Х-связанному типу наследования. Приводит к нарушению функционирования ПФЦ и вызывает клиническую картину сходную с хроническим гранулематозом. Однако проявления обычно наступают позже и выявляются признаки гемолитической анемии.
Миелопероксидазная недостаточность. Миелопероксидаза – фермент обеспечивающий превращения перекиси водорода в гипохлорид (OСl-). Описаны случаи полной или частичной недостаточности этого фермента. Лейкоциты больных с миелопероксидазной недостаточностью характеризуется нормальной активностью гексозомонофосфатного шунта, нормальной продукцией кислородных радикалов и перекиси водорода.
Миелопероксидазная недостаточность лейкоцитов может быть связана с накоплением и замедленным выбросом миелопероксидазы из азурофильных гранул. На клеточном уровне данная патология обусловлена нарушениями процессов перестройки цитоскелета (сборки микротрубочек). Отличительной чертой данного нарушения является наличие в клетках больших азурофильных гранул.
20.
Клеточный ответ, обусловленный Т-лимфоцитами. Т-клеточные антигенраспознающие рецепторы, белки главного комплекса гистосовместимости.
Клеточный ответ связан со специфическим узнаванием клетками иммунной системы антигенов, расположенных на поверхности других клеток организма (фрагменты вирусных белков и белков, образующихся при трансформации клеток).
Т-лимфоциты развиваются в тимусе и отвечают за клеточный иммунитет. Различают три основных вида Т-лимфоцитов:
Т-киллеры, или цитотоксические Т-лимфоциты, уничтожают клетки организма, зараженные вирусами, и вместе с В-лимфоцитами непосредственно участвуют в защите организма. Поэтому Т-киллеры и В-лимфоциты называют эффекторными клетками.
Т-хелперы и Т-супрессоры играют регуляторную роль, соответственно усиливая или подавляя размножение и созревание других клеток иммунной системы. Их объединяют в группу регуляторных клеток.
Т-лимфоциты могут узнавать инфицированную клетку, если соответствующий антиген расположен на ее поверхности. Взаимодействие с антигеном возможно только в комплексе с поверхностными маркерами – группой белков комплекса гистосовместимости МНС (от англ. Major histocompatibility complex).
Антиген, поглощенный антигенпрезентирующими клетками (АПК), деградирует на отдельные антигенные полипептиды, которые ассоциируются с белками МНС и перемещаются на поверхность клетки. К АПК, в частности, относятся дендритные клетки, макрофаги, а также В-клетки.
АПК представляют Т-хелперам фрагменты антигена (эпитопы), способные взаимодействовать с рецепторами Т-клеток.
Когда хелперные Т-клетки узнают «свой» антиген, они активируются и начинают продуцировать цитокины – белковые регуляторы иммунного ответа, осуществляющие межклеточные взаимодействия при иммунном ответе. Цитокины – небольшие белки или полипептиды. Они могут действовать как на клетку, которая их продуцирует, так и на другие вблизи расположенные клетки. К цитокинам относятся интерлейкины (ИЛ), интерфероны, факторы некроза опухолей, факторы роста, хемотоксические факторы и др.
Действие Тц-клеток на клетки-мишени. Главная функция Тц-клеток связана с уничтожением клеток, зараженных вирусами. При помощи специфического рецептора Тц-клетки распознают экзогенный антиген и присоединяются к клетке-мишени.
Для уничтожения инфицированных клеток Тц и НК имеют несколько механизмов воздействия. Одним из таких механизмов является воздействие на мембрану клетки-мишени гранул Тц или НК, содержащих белок перфорин и гранзимы — ферменты, ассоциированные с гранулами. Перфорин — мономерный белок, при воздействии на мембраны вызывает образование пор. В присутствии Са2+ мономеры перфорина связываются с мембраной клетки-мишени, полимеризуются и образуют трансмембранный канал. Это может привести к осмотическому шоку, неконтролируемому удалению внутриклеточных структур и, как следствие, гибели клетки. Гранзимы представляют собой набор цистеиновых протеиназ, расщепляющих полипептидные цепи по остатку аспарагиновой кислоты и вызывающих активацию ядерных протеиназ-каспаз. Те, в свою очередь, в результате ограниченного протеолиза активируют ядерную ДНК-азу и индуцируют программированную гибель клеток — апоптоз.
Т-супрессорные (Тс)-клетки. Некоторые Т-клетки способны подавлять те или иные механизмы иммунного ответа, поэтому их называют супрессорными клетками. Они образуют гетерогенную популяцию со смешанными функциями. Одна из субпопуляций Тс синтезирует и секретирует цитокин, способный ингибировать фактор роста. Клетки этой субпопуляции являются истинными супрессорами. Другие Тс-клетки совместно с Т-хелперами контролируют активность В-клеток и Тц-клеток — главных эффекторных клеток иммунной защиты, т.е. выполняют чисто регуляторную функцию без подавления клеточного роста.
Семейство Т-клеточных антигенраспознающих рецепторов.
Антитела связывают антигены в жидкостях организма (гуморальный иммунитет), а Т-лимфоциты взаимодействуют с антигенами на поверхности зараженных вирусами и измененных в результате опухолевой трансформации собственных клеток организма.
Т-лимфоциты узнают антигены только в комплексе с молекулами МНС I или II. На поверхности Т-лимфоцитов присутствуют рецепторы, распознающие антигены чужеродной клетки. Они представляют собой гликозилированные гетеродимеры, состоящие из двух неравнозначных цепей (α и β). Каждая цепь содержит два домена, один из которых имеет константную, а другой — вариабельную структуру. С-концевые участки каждой цепи встроены в плазматическую мембрану. Единственный антигенсвязывающий участок распологается между двумя вариабельными доменами. По своему строению рецепторы Т-клеток имеют много общего с иммуноглобулинами. Кроме того, у всех активированных Т-клеток рецептор нековалентно связан с белком ТЗ, состоящим из трех полипептидных цепей (γ, δ и ε). Этот белок участвует в передаче сигнала от антигенрецепторного комплекса внутрь клетки.
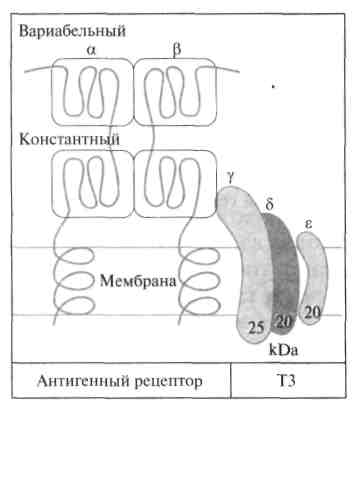
Рис.Строение Т-клеточного рецептора.
