- •Тема: Квантовая механика. Физика твердого тела. Элементы атомной физики. Вариант №12
- •1. Модель атома Бора.
- •Задача 1.12
- •2. Волны де Бройля. Краткое теоретическое описание
- •Задача 2.12
- •3. Соотношение неопределенностей Гейзенберга
- •Задача 3.12
- •4. Введение в квантовую механику. Уравнение Шредингера.
- •Задача 4.12
- •5. Потенциальная яма и потенциальный барьер.
- •Задача 5.12.
- •6. Строение Атома.
- •Задача 6.12
- •13.Строение Атомных ядер. Краткое теоретическое описание.
- •Задача 13.12.
- •14.Радиоактивность. Краткое теоретическое описание.
- •Задача 14.12

Министерство образования и науки Российской Федерации
Государственное образовательное бюджетное учреждение высшего профессионального образования
Н ациональный
минерально-сырьевой университет “Горный”
ациональный
минерально-сырьевой университет “Горный”
Расчетно-Графическое Задание
По дисциплине: Физика
(наименование учебной дисциплины согласно учебному плану)
Тема: Квантовая механика. Физика твердого тела. Элементы атомной физики. Вариант №12
Выполнил: студент гр. ЭР-10-2 ______________ /Поликашов С.А./
(подпись) (Ф.И.О.)
Проверил: профессор ______________ /Мартынов В.Л./
(подпись) (Ф.И.О.)
Санкт-Петербург
2012
1. Модель атома Бора.
Краткое теоретическое обоснование
В соответствии с
постулатами Бора, электрон в атоме
водорода может двигаться лишь по круговым
орбитам. (рис.1), для которых момент
импульса L=
mevr
удовлетворяет условию mevr
= n![]() ,
где me
– масса
электрона; r
– радиус орбиты; v
– линейная скорость движения электрона;
=h/2π=
1,0546*10-34
Дж*с; n-
целое число, n=
1,2,3,…
,
где me
– масса
электрона; r
– радиус орбиты; v
– линейная скорость движения электрона;
=h/2π=
1,0546*10-34
Дж*с; n-
целое число, n=
1,2,3,…
Радиус орбиты с номером n
![]() ,
,
где
![]() - электрическая
постоянная ; Z
– заряд ядра атома; е – заряд электрона.
- электрическая
постоянная ; Z
– заряд ядра атома; е – заряд электрона.
Энергия электрона зависит от n следующим образом:
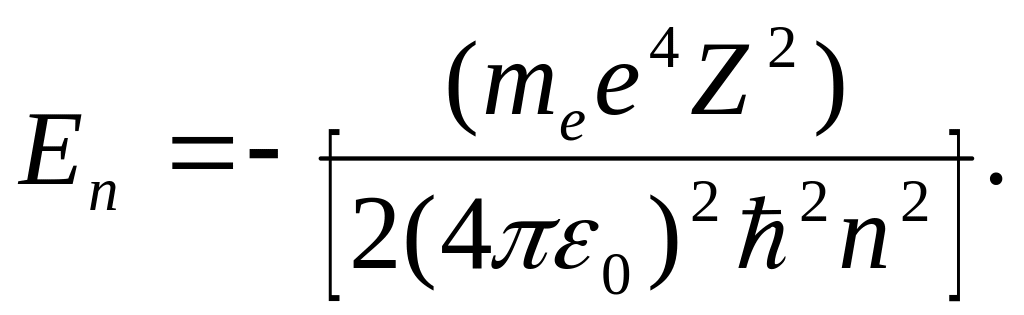
При переходе электрона с орбиты n1 орбиту n2 (n1 > n2) излучается фотон, частота которго определяется обобщенной формулой Бальмера:
![]()
Здесь R=![]() - постоянная Ридберга
- постоянная Ридберга
Длина волны излученного фотона находится из аналогичного соотношения для волнового числа.
![]() где
с – скорость света в вакууме; R’=1,09*107
м-1
где
с – скорость света в вакууме; R’=1,09*107
м-1
Квантово-механическая модель строения атома
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
Квантовое число |
Символ |
Описание |
Значения |
Главное |
n |
Энергетический уровень орбитали |
Положительные целые числа: 1, 2, 3... |
Орбитальное |
l |
Форма орбитали |
Целые числа от 0 до n-1 |
Квантовое |
m |
Ориентация |
Целые числа от -l до +l |
Спиновое |
ms |
Спин электрона |
+½ и -½ |
Задача 1.12
Найти квантовое число n, соответствующее возбужденному состоянию He+, если при переходе в основное состояние этот ион испустил последовательно два фотона с длинами волн 121,4 и 30,35 нм соответственно.
Дано: Решение

λ1 =121,4*10-9 м Порядковый номер гелия Z =2. Частота кванта первого перехода
согласно формуле Бальмера –Ридберга:
λ2 =30,35*10-9 м

![]()
n
- ? ![]()
Аналогично запишем для второго перехода:
![]()
Исключим из системы уравнений (1)-(2) неизвестную m:
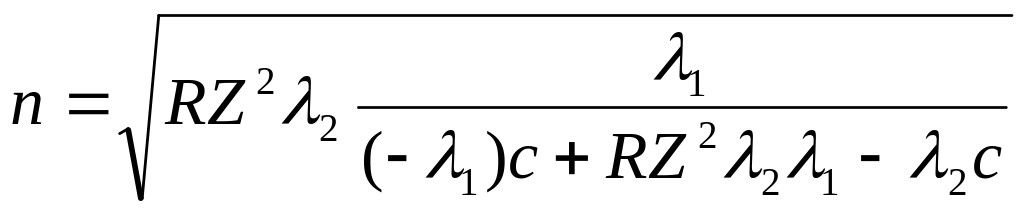 =
=![]()
Далее считая все значения мы получаем что n =5.
Ответ: n=5.