
- •Екзаменаційні питання
- •5.05170104 «Виробництво хліба, кондитерських, макаронних виробів і харчоконцентратів» Розглянуто та затверджено
- •В 500мл розчину міститься 10,8214г Na2co3. На титрування 25,00мл цього розчину витрачено 22,60мл розчину нсі. Визначити молярну концентрацію і титр розчину нсі.
- •Обчислити молярну масу речовини еквівалента окислювача та відновника в реакції:
Міністерство освіти та науки, молоді та спорту України
Миколаївський державний коледж економіки та харчових технологій
Екзаменаційні питання
з дисципліни „Аналітична хімія“
для студентів денного відділення
спеціальностей 5.05170101 «Виробництво харчової продукції»,
5.05170104 «Виробництво хліба, кондитерських, макаронних виробів і харчоконцентратів» Розглянуто та затверджено
на засіданні циклової комісії
природничонаукових дисциплін
Протокол №_____від _________2012р.
Голова циклової комісії
______________І.В.Пінчук
Миколаїв ‑ 2012
Як відкрити катіон Са2+ у присутності Ва2+. Відповідь підтвердити складанням рівнянь хімічних реакцій в молекулярному та іонному вигляді. Складіть схему аналізу.
З наважки ВаСІ2 Н2О масою 0,4044 г добули осад масою 0,1345г. Обчислити вміст барію (%) в ВаСІ2 Н2О.
В 500мл розчину міститься 10,8214г Na2CO3. На титрування 25,00мл цього розчину витрачено 22,60мл розчину НСІ. Визначити молярну концентрацію і титр розчину НСІ.
Як відкрити катіон Nа+ у присутності солей амонію. Відповідь підтвердити складанням рівнянь хімічних реакцій в молекулярному та іонному вигляді. Складіть схему аналізу.
Добуток розчинності АgI дорівнює 8,7 10-17. Обчислити розчинність АgI (моль/л; г/л).
На титрування розчину щавлевої кислоти витрачено 15,00см3 розчину КМnО4, з титром Т(КMnО4/Н2С2О4) = 0,00670г/см3. Визначити масу безводної щавлевої кислоти Н2С2О4 в досліджуваному розчині.
Як відкрити катіон калію у присутності катіону амонію. Скласти схему аналізу. Відповідь підтвердити складанням рівнянь хімічних реакцій в молекулярному та іонному вигляді.
Розчинність Аg2CrO4 за температури 250С дорівнює 1,31 10-4моль/л. Обчислити добуток розчинності цієї солі.
На титрування 20,00мл розчину щавлевої кислоти, приготовленого в мірній колбі об’ємом 100мл з наважки масою 0,6304г, витратили 19,50мл розчину КОН. Розрахувати масу КОН в 500мл розчину.
Яка група аніонів не має групового реактиву? Якими реакціями можна відкрити ці аніони. Відповідь підтвердити складанням рівнянь реакцій.
25г подрібнених сосисок висушили до постійної маси. Маса сухого залишку становить 6,3г. Обчислити вміст вологи (%) у сосисках.
В мірній колбі об’ємом 500мл розчинили NаОН. На титрування 25,00мл цього розчину витратили 22,50мл розчину НСІ. Титр розчину НСІ дорівнює 0,003646 г/мл. Розрахуйте масу NаОН в 500мл розчину.
Пояснити, чому додавання незначної кількості соляної кислоти або гідроксиду натрію до буферної суміші хлориду амонію з гідроксидом амонію не викликає зміни рН розчину. При проведенні визначення якого показника використовують аміачний буфер.
Обчислити молярну масу речовини еквівалента окислювача та відновника в реакції:
KI + H2SO4 I2 + K2SO4 + H2S + Н2О
Знайти масу Nа2СО3 у розчині, якщо на титрування 25,00см3 розчину Nа2СО3 витрачено 24,00см3 розчину НСІ, титр якого за Nа2СО3 дорівнює 0,05333г/см3.
Як розділити суміш катіонів Сu2+ та Рb2+? Скласти схему аналізу. Відповідь підтвердити складанням рівнянь хімічних реакцій в молекулярному та іонному вигляді.
При прожарюванні 0,7562г гідроксиду алюмінію утворився оксид алюмінію масою 0,3845г. Визначити масову частку (%) АІ2О3 в зразку.
Який об’єм розчину НСІ, С(НСІ) = 0,2 моль/л необхідний для нейтралізації 25,00мл розчину КОН, титр якого становить 0,008978 г/мл?
Які сполуки утворюються при дії К2СrО4 на суміш катіонів ІV аналітичної групи. Скласти рівняння відповідних реакцій в молекулярному та іонному вигляді.
Для аналізу наважку сухого СаСО3 масою 0,8099г розчинили в соляній кислоті. Після прожарювання маса осаду склала 0,8470г. Обчислити масову частку оксиду кальцію в зразку, якщо гравіметрична форма осаду СаSО4.
Обчислити молярну концентрацію розчину НСІ, якщо на титрування 20,00мл його витрачено 19,20мл NaОН з молярною концентрацією 0,10моль/л.
Визначили вміст кислоти в молоці титруванням гідроксидом натрію у присутності лакмусу. Результат виявився неправильним. Яку помилку допустили? Дати обґрунтовану відповідь, скласти рівняння реакції.
При аналізі магнезиту MgCO3 з наважки масою 0,7855г після відповідної обробки отримали 0,5976г гравіметричної форми Mg2Р2О7. Визначити масову частку (%) MgO в зразку.
Яку масу Na2S2O3 5H2O потрібно взяти для приготування 500мл розчину, з молярною концентрацією речовини еквівалента 0,1моль/л.
Дати характеристику люмінесцентному аналізу. Принцип дії та методика роботи з використанням люміноскопу «Філін».
Для аналізу взяли суху наважку сполуки кальцію масою 0,5246г. Маса отриманої гравіметричної форми СаО складає 0,2215г. Визначити масову частку (%) кальцію в зразку.
На титрування 20,00мл розчину H2C2O4 з титром 0,006900г/мл витратили 25,00мл розчину KMnO4. Обчислити нормальну концентрацію розчину KMnO4.
Як діє груповий реактив на катіони ІІІ аналітичної групи? Відповідь підтвердити складанням рівнянь реакцій в молекулярному та іонному вигляді.
При аналізі вапняку з наважки масою 0,5210г після відповідної обробки добули прожарений осад СаО масою 0,2218г. Обчислити масову частку (%) СаСО3 в зразку.
Чому дорівнює титр розчину щавлевої кислоти, якщо в 100мл розчину міститься 0,3216г цієї кислоти.
Як діє груповий реактив на катіони ІІ аналітичної групи? Відповідь підтвердити складанням рівнянь реакцій в молекулярному та іонному вигляді.
Наважка сухого кальциту СаСО3 масою 1,5120г після прожарювання до постійної маси склала 0,8470г. Обчислити масову частку (%) СаО в зразку.
Обчислити масу наважки AgNO3 для приготування 500мл розчину, нормальна концентрація якого 0,05моль/л.
При визначенні вмісту феруму(ІІ) в солі Мора в точці еквівалентності замість рожевого забарвлення отримали буре. Чи можна вважати одержаний при такому титруванні результат правильним? Відповідь підтвердити складанням рівнянь відповідних хімічних реакцій.
З наважки природного кальциту масою 1,500г після відповідної обробки добули гравіметричну форму СаSО4 масою 0,9620г. Обчислити масову частку (%) СаСО3 в зразку
На титрування 20,00мл розчину NaCІ, нормальна концентрація якого 0,05моль/л, витрачено 19,64мл розчину AgNO3. Визначте титр розчину AgNO3.
Визначили вміст кислоти в молоці титруванням гідроксидом натрію у присутності індикатора метилового оранжевого. Результат виявився неправильним. Яку помилку допустили? Дати обґрунтовану відповідь, скласти рівняння відповідної реакції.
З наважки сплаву срібла масою 0,1000г після відповідної обробки отримали 0,1196г осаду АgCI (гравіметричної форми). Розрахуйте масову частку (%) срібла в сплаві.
На титрування 20мл розчину соляної кислоти з Т = 0,003517г/мл затрачено 21,55мл розчину гідроксиду натрію. Обчислити: а) ТNаOH / HCI; б) ТNаOH; в) ТNаOH /
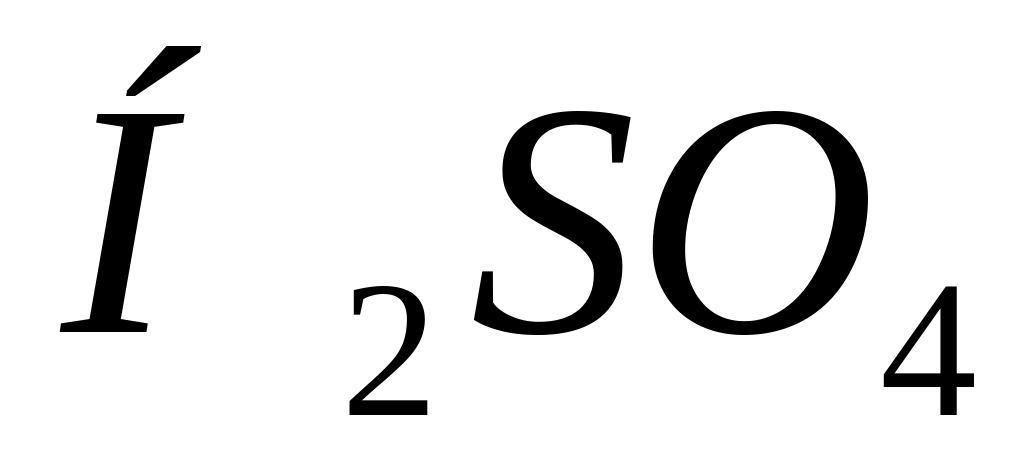
Чи можна відокремити у розчині:
катіони мангану від катіонів хрому;
катіони феруму від катіонів цинку;
катіони алюмінію від катіонів мангану?
Відповідь підтвердити складанням рівнянь хімічних реакцій в молекулярному та іонному вигляді.
