
- •7. Диаграмма состояния с неограниченной растворимостью.
- •1 3 Диаграма состояния железо – углеродистых сплавов.
- •15. Чугуны. Хим. Состав, классификация и назначение серых чугунов.
- •16. Влияние скорости охлаждения на процесс графитизации в серых чугунах. Серые чугуны на ф., ф-п, п. И п-ц основе.
- •20. Второе основное превращение в стали - Превращение аустенита в перлит.
- •21. Диаграмма превращения аустенита.
- •22. Мартенситное превращение и его особенности.
- •23. Четвёртое основное превращение - превращение мартенсита при отпуске.
- •31.Легированные стали, особенность химического состава, назначение, классификация, маркировка легирующих элементов.
- •32. Влияние легирующих элементов на основные параметры термической обработки стали и её структуру.
- •33. Влияние легирующих элементов на полиморфное превращение железа
- •34. Классификация легированных сталей по структурам
- •35. Классификация легированных сталей в зависимости от содержания углерода и легирующих элементов в стали
- •36. Особенности термической обработки инструментальных быстрорежущих сталей, маркировка
- •37.Методы поверхностного упрочнения.
- •39. Термическая обработка цементируемой стали.
- •42. Конструкционные стали, особенности термической обработки.
- •43. Отпускная хрупкость легированных сталей.
- •44. Инструментальные стали.
- •45. Штамповачные стали для холодного и горячего деформирования металла
- •46 Полимеры и их классификация
- •48. Термомеханическая кривая и три состояния полимера.
- •49. Отличие полимеров от низкомолекулярных веществ.
- •50. Особенности мех. Свойств полимеров.
- •51. Пластмассы и их классификация.
- •52. Резины, определение, состав и назначение ингредиентов.
1. Металловедение – наука, изучающая состав, строение, свойства металлов и сплавов и закономерности их изменения в зависимости от внешних факторов (тепловых, механических, электрических, радиоактивных и химических). За последние годы достижения материаловедения обеспечили небывалый прогресс в разработке конструкционных и инструментальных материалов в различных областях техники. Исследования реальной структуры твердых тел показали принципиальную возможность получения кристаллических и некристаллических материалов с прочностью, приближающейся к теоретической, определяемой прочностью межатомных связей. Впервые существование связи между строением и ее свойствами было установлено П.П.Аносовым (1799-1851). Он изобрел микроскоп. Важнейшие положения научного металловедения были заложены русским металлургом Д.К.Черновым (1839-1921). Он в работе, опубликованной в 1868 г., показал, что в стали в твердом состоянии при ее нагреве (или охлаждении) до определенных температур (критических точек) происходят фазовые превращения, вызывающие значительные изменения свойств стали. Работы Чернова создали фундамент современного металловедения термической обработки. Большую роль в развитии металловедения сыграли работы Н.С.Курнакова, применившего для исследования металлов методы физико-химического анализа.
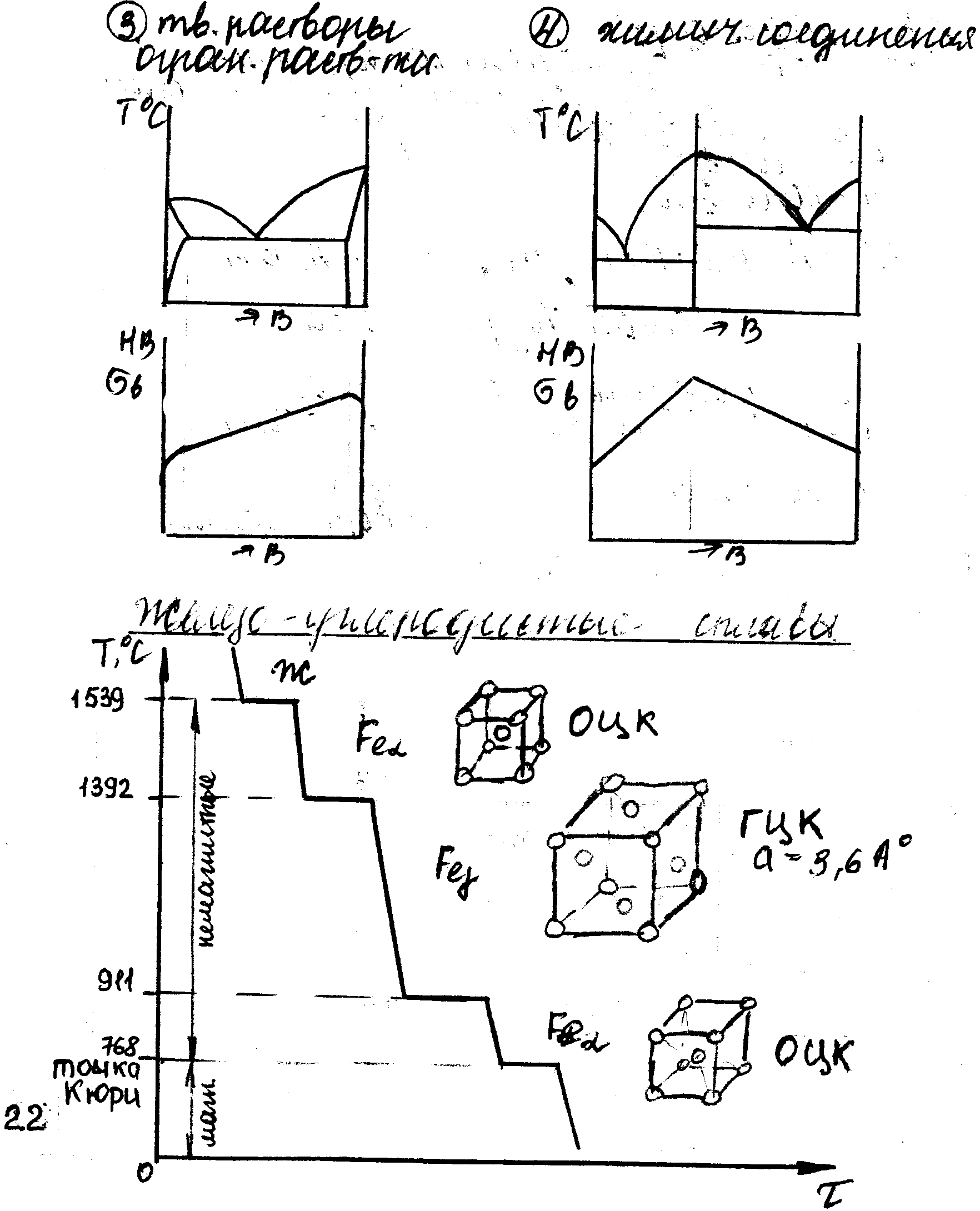
2. Особенности атомно-кристаллического строения. Твердое состояние характеризуется определенным закономерным расположением атомов в пространстве. Многократное повторение кристаллографических плоскостей в пространстве, расположенных || друг другу воспроизводит пространственную крист. решетку. Под элементарной ячейкой понимают наименьший комплекс атомов, который при своем многократном повторении в пространстве воспроизводит простр. кристал. решетку. Бывают: простая кубическая, объемно-центрированный куб (ОЦК) (Fe, W, молибден), гранецентрированный куб (ГЦК) кубическая (Al, Pb, Ni, Au, Ag, Pl), гексагональная плотноупакованная (ГПУ) (кобальт, кадмий), тетрагональная. Аллотропия – способность металла изменять свою кристаллическую решетку под действием температуры. Анизотропия – различие свойств в зависимости от направления испытания.
1) Период решётки – расстояние между атомами в узлах.
2) Координационное число – кол-во атомов, находящихся на наименьшем расстоянии от взятого тела.
3) Базис – кол-во атомов приходящихся на одну ячейку.
Чем больше период решётки и Координационное число, тем больше атомов находящихся в ячейке и это плотноупакованная решётка.
Металлы с ОЦК и ГЦК более твёрдые.
3. Крист. металлов. Кристаллизация – переход металла из жидкого состояния в твердое, образование кристаллической решетки. Температура Ts – равновесная (теоретическая) температура крист-ции. TФ – фактическая температура крист. Для перехода металла из жидкого в твердое состояние металл необходимо переохладить. n = Ts - TФ – степень переохлаждения. Процесс кристаллизации начинается с того, что в жидком металле появляются центры кристаллизации. Вокруг этих центров начинают расти кристаллы. Оба процесса происходят одновременно. 1) в начальный момент Vкр увеличивается, быстро увеличивается кол-во центров кристаллизации. 2) пока кристаллы окружены жидкостью, он имеет правильную форму. 3) взаимное столкновение кристаллов приводит к нарушению правильности формы. 4) кристалл – зерно. Параметры: число центров крист. и скорость роста кристаллов из этих центров. Изменение величины зерна в процессе кристаллизации без изменения скорости кристаллизации называется модифицированием. Вводятся вещества, tПЛ которых выше tпл основного металла, они называются модификаторы (готовые центры крист.). В процессе крист. происходят фазовые превращения. Фаза – однородная часть неоднородной системы, разделенная от других частей системы поверхностью раздела, при переходе через которую структура и св-ва вещества изменяются скачком.
4. Сплавы – Механические смеси. Сплавы – это сложные вещества, которые получаются в результате сплавления или спекания нескольких простых веществ. Вещества, которые входят в состав сплава, называются компонентами сплава. Механические смеси: Pb-Sb, Pb-Sn, Zn-Sn, Fe-C. Условие образования м. с.: компоненты должны быть взаимно растворимы в жидком состоянии, нерастворимы в твердом состоянии и не образовывать хим. соединения.
Если одно вещество А находится в избытке, то процесс кристаллизации состоит из двух стадий: кристаллизации А и кристаллизации мех смеси. Эвтектика – механическая смесь, состоящая из 2-х или более фаз, одновременно кристаллизующихся из жидкости. В сплавах-мех.смеси первым крист-ся компонент находящийся в избытке относительно эвтектоидной концентрации.
5. Методика построения двухкомпонентных диаграмм состояния. Диаграмма состояния дает представление о строении сплава и показывает изменение состояния сплава в зависимости от т-ры и концентрации компонентов. Строится по кривым охлаждения сплавов с различной концентрацией. Ликвидус – линия, выше которой сплав находится в жидком состоянии. Солидус – ниже неё – в твёрдом состоянии.
6. Сплавы – Твердые растворы. Если сохраняется взаимная растворимость компонентов в твердом состоянии, то такие сплавы – называются твердыми растворами. Компоненты должны быть взаимно растворимы и в жидком, и в твердом состоянии, не образовывать хим. соединения. Твердые растворы замещения: при добавлении к компоненту А атомов В, В замещают атомы А в крист. решетке (в узлах). Компонент, кристаллическая решетка которого сохраняется, называется растворителем. Компонент, кристаллическая решётка решетка которого растворяется называется растворённым. Если размеры атома растворенного компонента больше размеров атомов растворителя, то период решётки увеличивается, если меньше – уменьшается. Период решётки – расстояние между атомами в узлах. Условия образования твердых растворов неограниченной растворимости: 1) компоненты должны иметь один тип крист. решетки; 2) малое различие атомов (размеров) растворителя и т.д.; 3) компоненты должны близко находиться друг от друга в табл. Менделеева (одинаковые строение валентных оболочек). Твердые растворы внедрения – всегда растворы ограниченной растворимости; тв. растворы внед. образуют элементы 1,2 периода табл. Менделеева. При внедрении атомы размещаются между атомами А. Период кр. решётки увеличивается.
7. Диаграмма состояния с неограниченной растворимостью.
В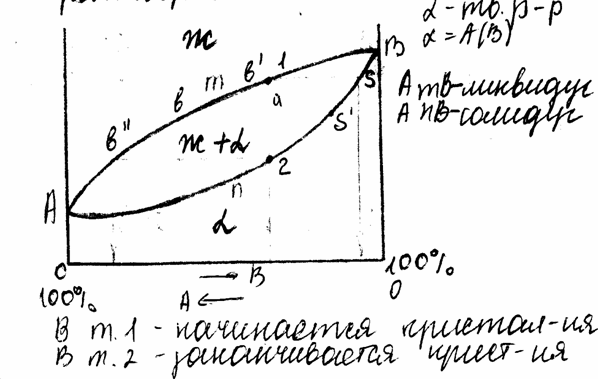 процессе крист. концентрация компонентов
в жидкой фазе – по линии ликвидус, в
твердой фазе – по линии солидус. Вначале
крист. выделившиеся кристаллы обогащены
более тугоплавким компонентом. В процессе
крист. в результате диффузии происходит
выравнивание компонентов твердой фазы
и достигает “В”. Неоднородность
химического состава в размере зерна
носит название дендритной ликвации. В
размере слитка – зональная
ликвация(неоднородность хим. состава
в размере слитка).
процессе крист. концентрация компонентов
в жидкой фазе – по линии ликвидус, в
твердой фазе – по линии солидус. Вначале
крист. выделившиеся кристаллы обогащены
более тугоплавким компонентом. В процессе
крист. в результате диффузии происходит
выравнивание компонентов твердой фазы
и достигает “В”. Неоднородность
химического состава в размере зерна
носит название дендритной ликвации. В
размере слитка – зональная
ликвация(неоднородность хим. состава
в размере слитка).
8. Диаграммы сплавов с ограниченной растворимостью и сплавов – химические соединение. 1) крист. решетка отличается от решеток элементов, образующих это соединение; 2) атомы расположены упорядоченно (каждый из атомов занимает свое место); 3) сохраняется простое кратное весовое соотношение элементов. 4) все хим. соединения имеют постоянную t плавления; 5) большое различие свойств хим. соединения от свойств элементов, образующих его; 6) хим. соединения имеют высокую твердость, но очень хрупкие.
![]() F
– предыдущая
растворимость B
в А
F
– предыдущая
растворимость B
в А
![]() L
– предыдущая растворимость А в В, AFCLB
- солидус
L
– предыдущая растворимость А в В, AFCLB
- солидус
Сплавы которые расположены левее и правее точек показывающих предельную растворимость кристаллизуются по типу тв. растворов неограниченной растворимости

Д иаграмма
сплавов хим. соединение.
иаграмма
сплавов хим. соединение.
Аbc –ликвидус, CdB – оба компонента кристаллизуются, аb- процесс кристаллизации избыточного компонента, bc – кристаллизуется хим. соединение. Kbf – солидус, ndm - солидус
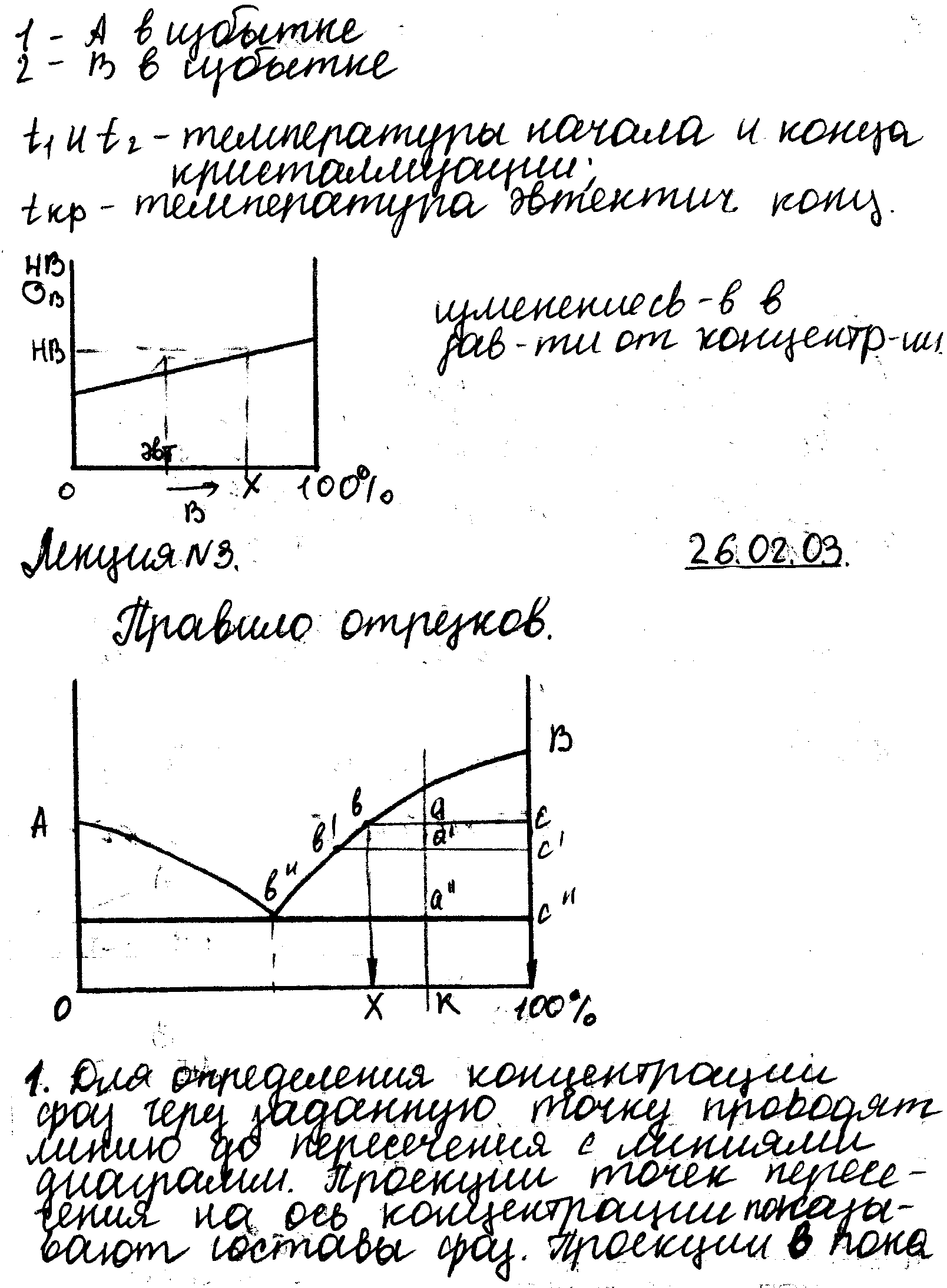 9.
Правило отрезков. Для
определения концентрации фаз через
заданную точку проводят линию точку до
пересечения с линиями диаграммы. Проекции
точек пересечения на ось концентрации
показывает нам состав фаз. QЖ*ab=QТВ*ac,
QЖ=aс/bс,
QТВ=ab/bc.
Для определения количественного
соотношения фаз через точку проводят
линии до пересечения с линиями диаграммы.
Отрезки прямой между заданной точкой
и точками, показывающими состав фаз,
обратно пропорциональны количествам
этих фаз.
9.
Правило отрезков. Для
определения концентрации фаз через
заданную точку проводят линию точку до
пересечения с линиями диаграммы. Проекции
точек пересечения на ось концентрации
показывает нам состав фаз. QЖ*ab=QТВ*ac,
QЖ=aс/bс,
QТВ=ab/bc.
Для определения количественного
соотношения фаз через точку проводят
линии до пересечения с линиями диаграммы.
Отрезки прямой между заданной точкой
и точками, показывающими состав фаз,
обратно пропорциональны количествам
этих фаз.
10. Закон Курнакова. Между составом, структурой сплава и его свойствами существует определенная закономерность.
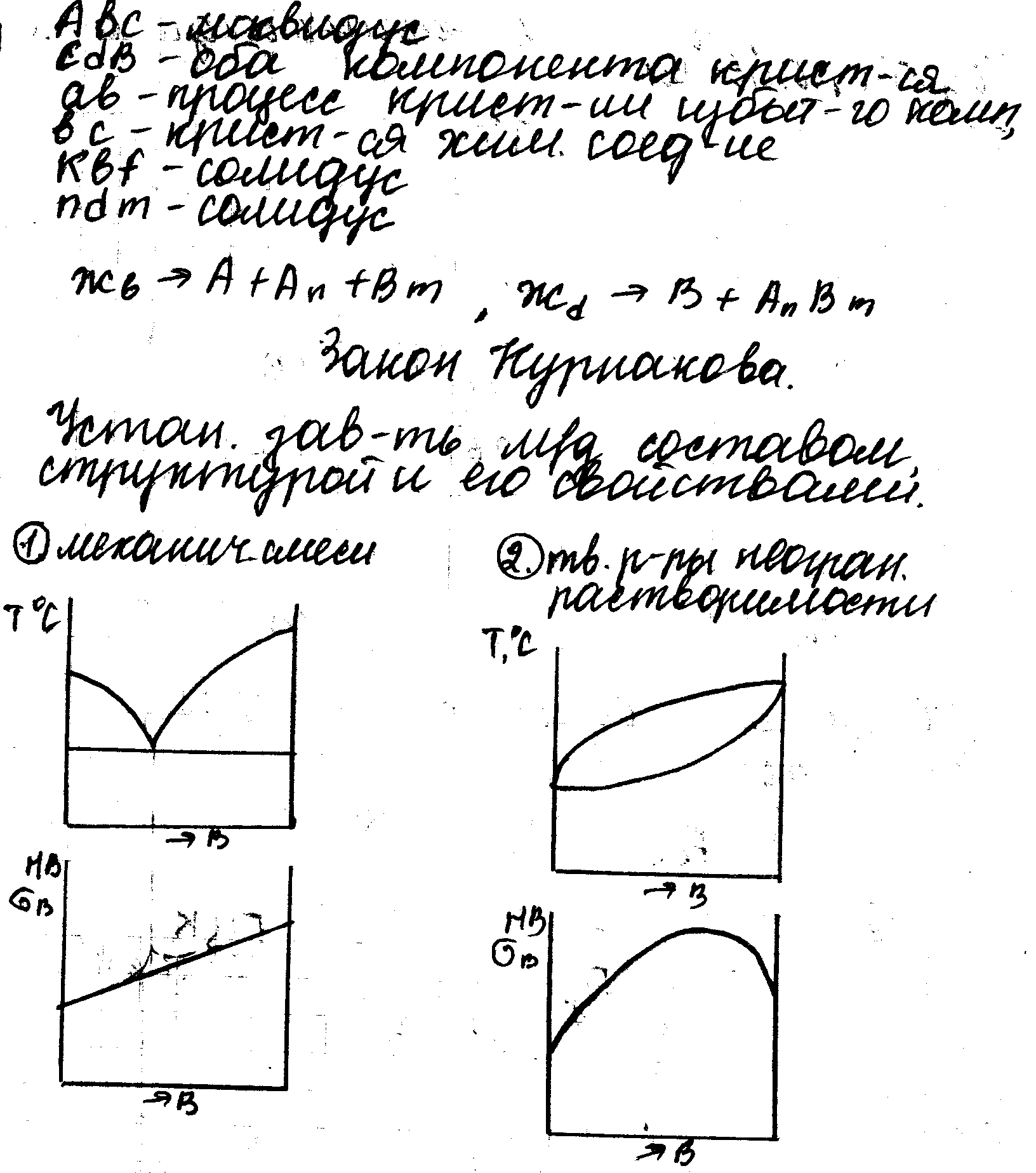
1 мех смеси
2 твёрдые растворы неграниченной растворимости
3 твёрдые растворы ограниченной раств.
4 хим соединения
11. Мех. св-ва металлов. Механические свойства металлов определяются в различных случаях нагружения: 1) статическое испытание (очень медленно прикладывают); 2) динамическое испытание (с большой скоростью или ударом); 3) повторно-переменные (нагрузка изменяется по величине и знаку). К статическим испытаниям относится испытание на растяжение, сжатие, кручение, изгиб и определение твердости. Статические испытания позволяют определить упругие сво-ва металлов, сопротивление малым и большим пластич. деформациям, сопротивление разрушению, а также пластические характеристики. Твердость – это способность металла сопротивляться пластической деформации или сопротивляться внедрению (по Бриннелю HB и Рокуэллу HRC). Предел упругости – это напряжение, при котором остаточная деформация составляет некоторую величину, а именно 0.001, 0.003, 0.005% от первоначальной длины образца. Относительное удлинение и сужение при динамическом нагружении. Предел ползучести – это max длительно действующее напряжение при высокой температуре, которое вызывает остаточную деформацию в 1% за 100, 1000, 10 000, 100 000 часов. Предел выносливости – это способность металла сопротивляться усталости, выдерживать максимальное напряжение N раз.
1 2. Сплавы железа с углеродом. Полиморфизм железа. Точка Кюри – переход железа из ферромагнитного состояния в парамагнитное (выше 768° железо не магнит). Феррит – твердый раствор углерода в модификации α-железа, имеет крист. решетку ОЦК и существует при температуре, равной или ниже 727°С. Максимальная растворимость углерода равна 0,02%. Аустенит – твердый раствор внедрения углерода в γ-железе, имеет крист. решетку ГЦК. Максимальная растворимость углерода равна 2,14%. Цементит – химическое соединение железа с углеродом – карбид железа Fe3C, содержит 6,67% углерода, имеет сложную крист. решетку, не испытывает аллотропических превращений.
