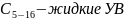- •Вопрос 1. Классификация месторождений ув по их составу и свойствам.
- •Вопрос 2. Эффект Джоуля –Томсона в технологических процессах добычи газа.
- •Вопрос 3. Физико – химические свойства газа.
- •Вопрос 4. Влагосодержание природных газов и методы его определения.
- •Вопрос 5. Кристаллогидраты природных газов. Состав. Условия образования и разложения
- •Вопрос 6. Фазовые превращения природных ув смесей. Классификация месторождений природных газов по фазовой диаграмме.
- •Вопрос 7. Особенности конструкции газовых скважин. Оборудование устья, ствола и забоя газовой скважины.
- •Вопрос 8. Давления в газовых месторождениях. Измерения и расчет. Определение распределения давления по стволу остановленной и работающей скважины.
- •Вопрос 9. Температурный режим и пластовая температура месторождений природных газов при их разработке. Расчет распределения температуры в стволе остановленной скважине.
- •Вопрос 10. Движущие силы, определяющие приток газа к скважине. Режимы месторождений природных газов.
- •Вопрос 11. Подсчет газа и конденсата объемным методом и методом падения пластового давления.
- •Вопрос 12. Особенности притока газа к скважинам. Двучленная формула.
- •Вопрос 13. Гидродинамические методы исследования скважин. Виды и назначение исследований.
- •Вопрос 14. Газогидродинамические исследования при стационарных режимах фильтрации. Методика проведения и интерпретация результатов.
- •2. Изохронный метод.
- •3.Ускоренный изохронный метод.
- •4.Экспресс метод.
- •5.Монотонно – ступенчатое изменение дебита.
- •Вопрос 15. Газогидродинамические исследования при нестационарных режимах фильтрации. Методика проведения и интерпретация результатов.
- •Вопрос 16. Технологический режим работы газовых скважин. Факторы, влияющие на режимы эксплуатации скважин. Выбор режима.
- •Вопрос 17. Материальный баланс газовой залежи.
- •Вопрос 18. Периоды разработки месторождений природных газов. Основные показатели разработки.
- •Вопрос 19. Сбор и подготовка конденсата и газа на месторождениях. Основные требования. Промысловые газосборные сети.
- •Вопрос 20. Низкотемпературная сепарация газа. Основные принципы.
- •Вопрос 21. Подготовка газа абсорбционным и адсорбционным способом. Технология. Абсорбенты. Десорбция.
- •Вопрос 22. Промысловые дожимные компрессорные станции (пдкс). Назначение. Схемы применения.
- •Вопрос 23. Неравномерности потребления газа. Роль хранилищ газа. Коэффициенты неравномерности.
- •Вопрос 24. Подземное хранение газа (пхг). Преимущества и недостатки различных способ создания и эксплуатации пхг.
- •Вопрос 25. Хранение газа в твердых непроницаемых коллекторах.
- •Вопрос 26. Хранение газа в солевых отложениях. Конструкции и методы создания каверн.
- •2 Метода:
- •Классификация запасов и ресурсов углеводородов.
Вопрос 3. Физико – химические свойства газа.
Природный газ представляет собой естественную смесь газообразных УВ, в составе которой преобладает метан. Образуется в недрах земли при медленном анаэробном (без доступа воздуха) разложении органических веществ.
Состав пластовой смеси:
УВ парафинового ряда

Кислые газы
Азот
СО, СО2
сероводород
Инертные газы
Гелий
Неон
аргон
Металл (Ртуть)
Вода
Ниже рассмотрены основные свойства природных газов, которые необходимо знать как на стадии разведки, так и при разработке месторождений:
Плотность.
-отношения массы газа к единице его объема. Зависит от его состава , давления и температуры.
Плотность газовой смеси при стандартных условиях( Т=293К, р=0,1013МПа) определяется с помощью молекулярной массы смеси и её молярного объема:

Vмол ст=24,04 л/моль
Плотность газа при заданных давлении и температуре определяется по известной плотности в стан условиях по формуле:

z- коэффициент сверхсжимаемости
В расчетах часто пользуются понятием относительной плотности газа:

Вязкость.
(Внутреннее трение) Свойство текучих тел оказывать сопротивление перемещению одной их части относительно другой. Она зависит от состава газа, давления и температуры.
Величина силы трения между двумя движущимися слоями пропорциональна площади соприкосновения этих слоев и изменению скорости движения в направлении, перпендикулярным плоскости соприкосновения слоев.
-Кинематическая
-Динамическая
Вязкость газа в пластовых условиях:
=атм* ( при атмосферном давлении, но при пластовой температуре)
*- приведенная вязкость.

Mi-молекулярная масса i-того компонента
Xi-молярная концентрация
i- коэффициент динамической вязкости при заданной температуре и атмосферном давлении.
Теплоемкость газа.
-это отношение количества теплоты, подведенной к газу, и изменению его температуры. Теплоемкость газов зависит от состава газа, процесса передачи тепла, давления и температуры.
Различают два типа теплоемкости:
При Р=const, Cp
При υ=const, Cv
Отношение теплоемкости к массе называется удельной теплоемкостью.
Удельная теплоемкость УВ компонентов снижается по мере повышения из молекулярной массы.
Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме называют коэффициентом адиабаты: Ср/Сv.
Теплота сгорания.
-кол-во тепла, выделяющегося при полном сгорании единицы объема (или массы) газа в определенных условиях.
Чем тяжелей компонент, тем выше его объемная теплота сгорания.
Теплопроводность.
-кол-во тепла, проходящего через его массы без перемещения, конвекции и теплообмена. Теплопроводность λ зависит от состава газа, Р и Т и определяется графическим и аналитическим способами.
Коэффициент теплопроводности является коэффициентом пропорциональности между количеством передаваемого тепла и градиентом температуры, площади передачи, продолжительностью процесса теплопередачи и толщиной газового слоя.
Коэфсверхсжимаемости газов.
Коэффициент сверхсжимаемости газа- это отношение Vгаза при заданных термобарических условиях к объему этого же газа определенному при идентичных термобарических условиях по законам идеального газа. Другими словами коэффициент характеризует отклонение объема реального газа от объема идеального газа.
Z=
V=
Коэффициент зависит от состава газа, давления и температуры. Значение коэффициента может быть определено аналитическим и графическим способами.
Графическая зависимость z от Рпр и Тпр испытывают газы, содержащих не более 2% высококипящих УВ , 2% ароматических УВ и 5% полярных и кислых компонентов.
Для смесей с содержанием метана более 96%:
Z=(0,4
Идеальный газ- математическая модель газа , в которой предполагается , что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией, т. е. между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействиями между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Уравнение состояния идеального газа:
Vид=
N-кол-ва вещества газа, R-универсальная газовая постоянная
Реальный газ- газ, который не описывается уравнением состояния идеального газа Менделеева - Клапейрона. Зависимости между его параметрами показывают, что молекулы реальных газов имеют конечные размер и форму, оказывают значительное взаимное влияние и занимают определенный объем. Поэтому для их характеристики нужно учесть параметры, которые связаны с молекулярным взаимодействием.
Для более точных расчетов коэффициент сверхсжимаемости природных газов должен быть определен по кубичсеким уравнениям состояния газов.
Критические параметры газа.
Критическим называют такое состояние вещ , при котором плотность вещ и его насыщенного пара равны.
Давление паров при критической температуре называется критическим давлением.
Максимальная температура, при которой жидкость и паровая фазы ещё могут существовать в равновесии, называется критической температурой . При более высокой темп жидкая фаза не может существовать.
Для природных газов, представляющих смесь отдельных компонентов, критические параметры определяются как псевдокритические по составу газа и по известной относительной плотности газа .
Если природный газ содержит мене 10 % высококипящих углеводородных фракций , то псевдокритические параметры определяются:
Рпкр=хi*Pkpi и Тпкр=xi*Tkpi Для газов, содержащих более 10% углеводородных и неуглеводородных компонентов, псевдокритические параметры определяются:
Рпкр=К2 /J2 и Тпкр= К 2 /J
При наличии в газе Н2S,N2, СО2 необходимо на величины Рпкр и Тпкр внести поправки. Эти поправки определяются графически или расчетным путем.
Приведенные параметры.
Если приведенные параметры природных газов одинаковы, то они находятся в соответственных состояниях, при которых их физические свойства z,, одинаковы.
Рпр=Р/Ркр и Тпр=Т/Ткр
Уравнение состояния газа.
Для любого газа уравнение состояния идеального газа:
PV=GRT
G- количество газа, R- работа расширения 1 моля газа на 1 градус С , в условиях Р=const
При больших давлениях объемы молекул становятся сравнимыми с объемом газа и требуют учета при составлении уравнение состояния реального газа.
PV=zRT
z-коэффициент пропорциональности .
Уравнение Ван-Дер-Ваальса:
(р+а/у2 )(V-в)=RT
y-удельный объем газа
а/у- постоянная, связанная межмолекулярными силами.
В- поправка на объем самих молекул.
Состав газовой смеси.
Массовая концентрация:
gi=(Gi/Gcмеси )*100%
Gi-масса i-того компонента
Молярная концентрация:
Xi=(Ni/Nсмеси)*100%
N-кол-во вещества i-того компонента
Объемная концентрация по закону Авагадро:
Vi=Vi/Vcмеси=Ni/Nсмеси=Хi
Для характеристики газовой смеси необходимо знать её среднюю молярную массу, среднюю плотность и плотность относительно по воздуху.
Если известен молярный состав смеси
(%) , то её молекулярная масса:

n-кол-во компонентов, составляющих газовую смесь, Хi-мольные концентрация компонентов(%), Мi- молярные массы компонентов.
Если задан массовый состав смеси (%), то средняя молярная масса:

gi-массовые концентрации компонентов.
Переход от мольного состава к массовому и обратно:
gi=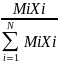
Влагосодержание газа.
См. ниже- 4 вопрос.